SPE和QuEChERS净化测定番茄中链格孢霉毒素方法比较
周贻兵,兰优,李磊,吴玉田,郭华
(贵州省疾病预防控制中心,贵州贵阳550004)
番茄是重要的蔬菜作物之一,在其种植、储藏过程中易受多种病原真菌的危害,特别是易受链格孢霉属真菌的侵害[1],可产生70 多种有毒代谢产物,统称为链格孢霉毒素[2-3],其中主要有链格孢酚(alternariol,AOH)、交链格孢酚单甲醚(alternariol monomethyl ether,AME)、腾毒素(tentoxin,TEN)以及细交链格孢菌酮酸(tenuazonic acid,TeA)。链格孢霉毒素具有细胞毒性[4]、基因毒性以及急性毒性[5],会对人体健康产生危害。因此,为了解番茄中链格孢霉毒素的污染状况,本试验对番茄中链格孢霉毒素进行检测,这对控制番茄及其制品的质量安全,维护人类健康具有重要的意义。
目前,我国尚未颁布食品中链格孢霉毒素的限量和检测方法标准,相关文献报道的链格孢霉毒素的检测方法主要有薄层色谱法[6]、液相色谱法[7],液相色谱-质谱联用[8-10]等方法。液相色谱质谱法因具有定性准确、灵敏度高等特点已成为检测链格孢霉毒素的主流方法,但番茄中含有较高的色素等组分,不同样品前处理方法对链格孢霉毒素测定结果具有较大影响,本文比较了固相萃取(solid-phase extraction,SPE)和QuEChERS 两种不同净化手段对回收率的影响,对准确测定番茄中链格孢霉毒素含量具有一定的参考意义。
1 材料与方法
1.1 主要仪器
U3000 超高效液相色谱、TSQ Quantum Ultra 三重四极杆串联质谱仪:Thermo Fisher 公司;3-18K 台式高速冷冻离心机:Sigma 公司;Milli-Q 超纯水机:Millipore;MS3 涡旋混均仪:德国 IKA;KQ55-DE 型数控超声波清洗机:昆山市超声仪器有限公司。
1.2 标准品及耗材
1 mg/瓶 AOH、AME、TeA,0.5 mg/瓶 TEN 标准品:普瑞邦生物科技有限公司。将链格孢霉毒素标准品配制成浓度为100 μg/mL 的标准储备液,-20 ℃冰箱保存,备用。
甲醇、乙腈(色谱纯)、PEP 固相萃取柱(200 mg/6cc):美国Thermo 公司;甲酸:纯度99 %,阿拉丁试剂(上海)有限公司;碳酸氢铵、氯化钠、无水硫酸镁、磷酸二氢钠:优级纯,上海国药集团化学试剂有限公司;C18吸附剂:粒径40 μm,上海安普实验科技股份有限公司;实验用水为一级水;24 份番茄样品:贵阳市的超市或农贸市场。
1.3 样品前处理
SPE 净化法[11]:称取5.0 g 匀浆的番茄样品于50 mL聚丙烯刻度离心管中,加入25 mL 乙腈-甲醇-0.05 mol/L磷酸二氢钠溶液(pH=3.0)(体积比 45 ∶10 ∶45)涡旋混匀,超声提取 30 min,10 000 r/min 离心 5 min,转移上清液,用水定容至30 mL,混匀。准确移取6.0 mL 提取液,加入 15 mL 0.05 mol/L 磷酸二氢钠溶液(pH=3.0),混匀,PEP 柱净化,用5 mL 甲醇和5 mL 乙腈洗脱,抽干柱子,合并洗脱液,45 ℃水浴氮吹近干,用2 mL 乙腈-1 mmol/L 碳酸氢铵水溶液(体积比 50 ∶50)溶解,涡旋混匀30 s,10 000 r/min 离心5 min,取上清液在优化的色谱质谱条件下进样分析。
QuEChERS 净化法[12]:称取 5.0 g 匀浆的番茄样品于50 mL 聚丙烯刻度离心管中,加入10 mL 0.4%甲酸-乙腈,涡旋混匀,超声提取30 min,加入0.5 g 氯化钠、5 g 无水硫酸镁,涡旋1 min,10 000 r/min 离心5 min,取 1.5 mL 上层提取液于 QuEChERS(25 mg C18)净化管中,涡旋1 min,取0.5 mL 净化液于2 mL 塑料离心管中,加入0.5 mL 1 mmol/L 碳酸氢铵水溶液,摇匀,10 000 r/min 离心5 min,取上清液在优化的色谱质谱条件下进样分析。
1.4 仪器工作条件
1.4.1 超高效液相色谱条件
ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm×1.7 μm),柱箱温度:35 ℃,流动相:1 mmol/L 碳酸氢铵溶液-甲醇;流速:0.2 mL/min,进样体积:10 μL。线性梯度洗脱条件见表1。
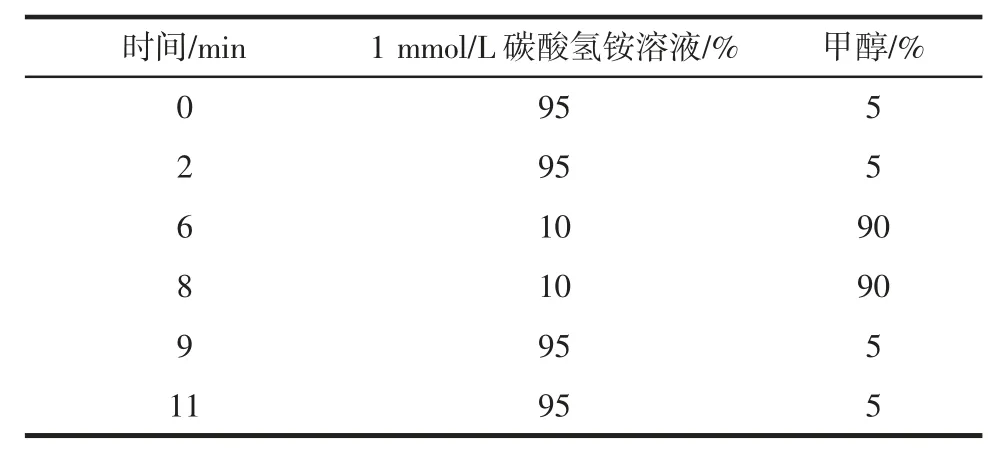
表1 梯度洗脱条件Table 1 Gradient elution conditions
1.4.2 质谱条件
离子化模式:电喷雾离子源正负离子切换扫描,,ESI+喷雾电压:3 800 V,ESI-喷雾电压:3 200 V,离子源温度:320 ℃,脱溶剂温度:300 ℃,鞘气(N2)压力:276 kPa,辅助气(N2)压力:104 kPa,碰撞气(Ar)压力:0.2 Pa,多反应监测(multi-reactions monitoring ,MRM)参数见表2。
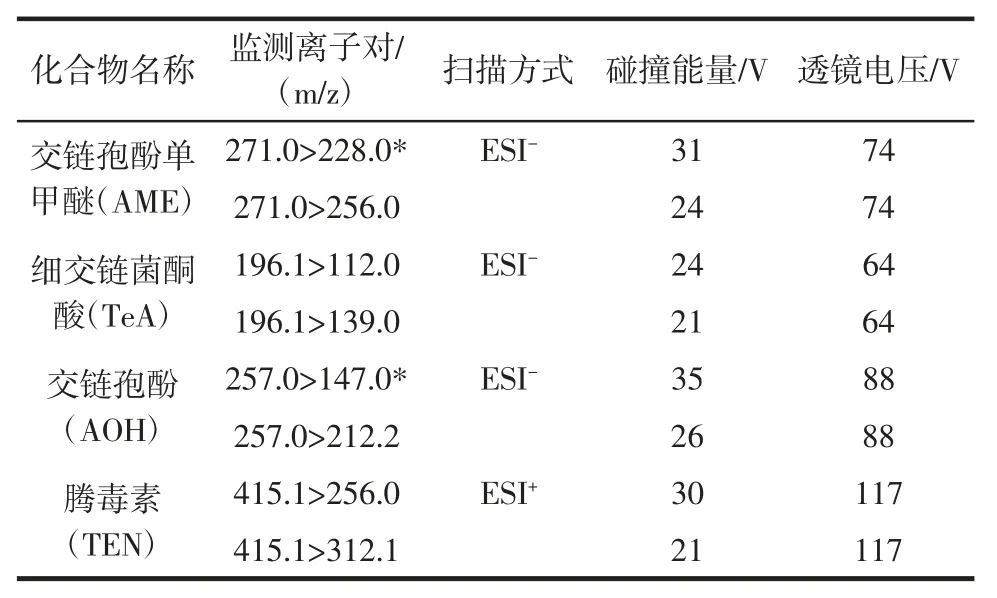
表2 质谱参数Table 2 The parameters of mass spectrum
2 结果与讨论
2.1 质谱及色谱条件的优化
分别采用ESI+和ESI-模式下对目标物进行全扫描,找出响应较大的准分子离子,改变碰撞能量,进行二级质谱扫描,找出2 个信号较强且稳定性好的子离子构成监测离子对,结果见表2。
TeA、AME、AOH 在ESI-离子模式下响应值较高,而ALT 和TEN 在ESI+响应较高,所以本试验采用正负切换扫描模式测定5 种链格孢霉毒素。考察甲醇-0.1%甲酸水溶液、甲醇-0.01%氨水水溶液、甲醇-20 mmol/L醋酸铵、甲醇-1 mmol/L 碳酸氢铵不同流动相条件下5 种链格孢霉毒素的分离情况。使用甲醇-0.01%氨水水溶液为流动相,TeA 形态的改变,在C18色谱柱上无保留,在死时间位置出峰,当使用甲醇-0.1%甲酸水溶液为流动相时,TEA 以分子态形式存在,出峰推迟,峰形拖尾;使用甲醇-20 mmol/L 醋酸铵时,除了TEN 外,其余4 种链格孢霉毒素的响应值下降;为了使各组分达到基线的完全分离,峰形较好,本文选择了甲醇-1 mmol/L 碳酸氢铵为流动相,正负切换扫描模式测定4 种链格孢霉毒素,获得良好的效果,MRM 图谱见图1。
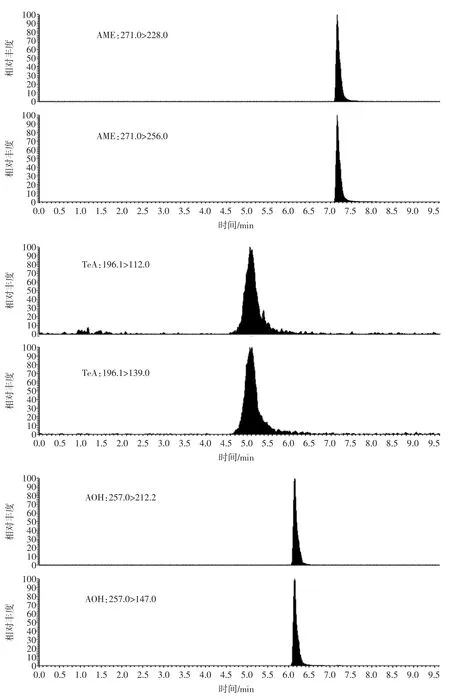
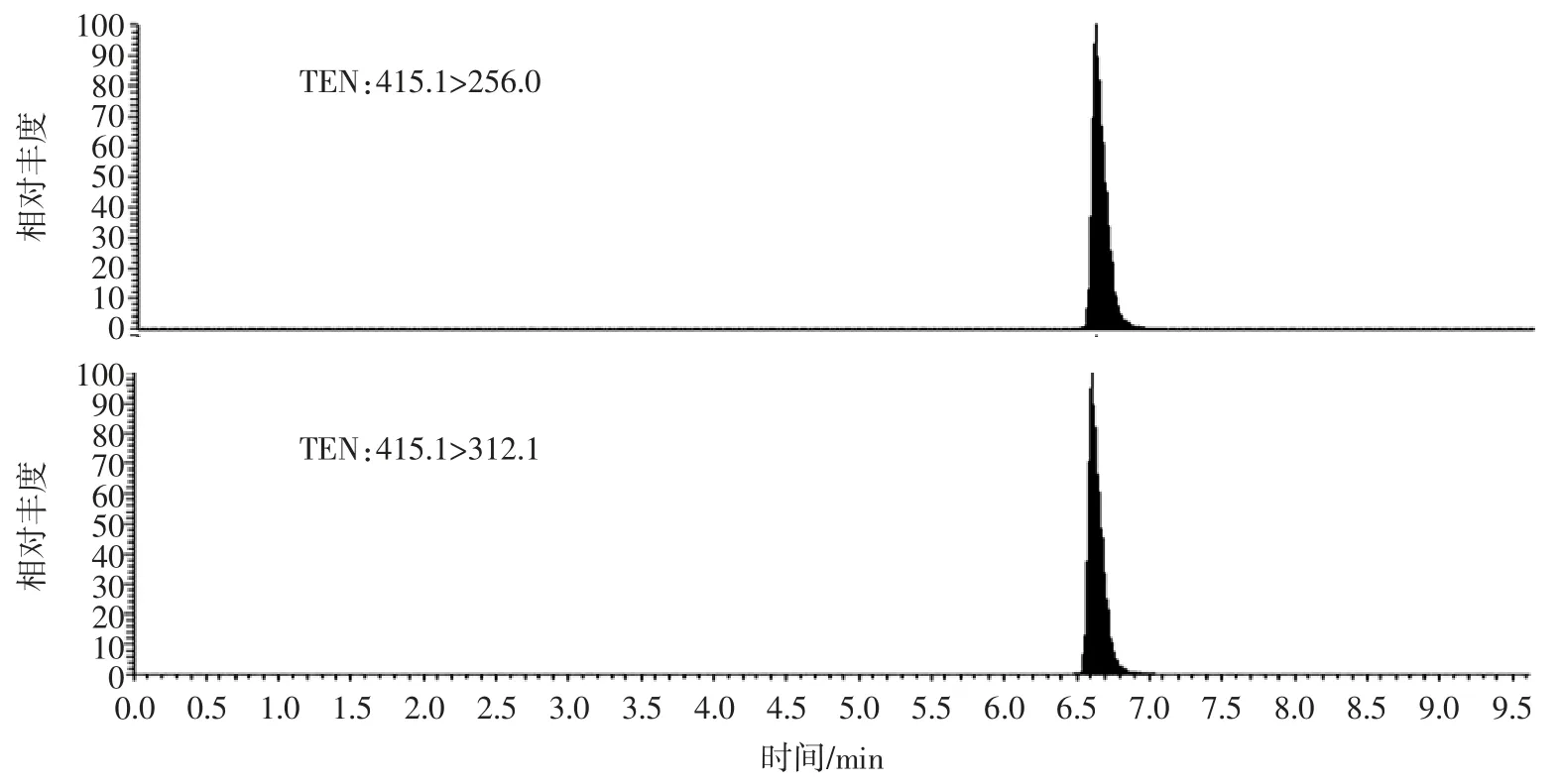
图1 种链格孢霉毒素的MRM 图谱Fig.1 MRM chromatograms for four kinds of alternaria toxins
2.2 提取液的比较
TeA 是一种酸,用酸化提取液有利于提高其提取效率[9],在SPE 净化方法时,选择磷酸二氢钠溶液(pH=3.0)-甲醇-乙腈溶液提取,而在QuEChERS 方法中由于磷酸二氢钠是非挥发性盐,会结晶堵塞喷针和离子传输管等,因此常选择挥发性的酸,所以本文选择了甲酸酸化的乙腈作为提取液,本试验将含(0.1 %、0.2 %、0.4%、0.8%、1.6%)甲酸-乙腈溶液为作为提取剂,分别对样品进行提取,结果表明:在乙腈中加入0.1%~0.4%的甲酸时,TEA 的回收率升高显著,回收率大于70%,其余4 种链格孢霉毒素的回收率变化不明显,但甲酸含量过高,基质中过多的酸性物质进入乙腈层,竞争电离,产生抑制效应,回收率反而下降,综合考虑,选择0.4%甲酸-乙腈作为提取液,获得良好的提取效果。
2.3 净化方法的选择
番茄样品提取液中含有色素、糖等共萃组分需采取一定的净化方法去除干扰,提高链格孢霉毒素定量结果的准确性。QuEChERS 方法使用的净化剂种类繁多,不同的净化剂去除干扰物质的效果各不相同,比较了常使用净化剂有C18、N-丙基乙二胺(N-propylethane-1,2-diamine,PSA)、石墨化炭黑(graphitizable carbon,GCB)的净化效果。GCB 主要用于去除样品提取液中的色素,但对平面结构的物质有吸附作用,当使用GCB 作为净化剂时,AOH、AME 几乎没有回收;PSA 主要用于吸附样品中的有机酸等弱酸性成分和糖类,采用 PSA 净化,TeA 和 AOH 的回收率随着 PSA 的用量增加而降低,ALT、TEN、AME 变化不显著;C18对去除脂类和蛋白质有较好的效果,TEA 未净化前,有较强的基质抑制效应,采用25 mg 的C18净化后,能有效的消除基质效应,5 种链格孢霉毒素的回收率在80 %~115 %之间,满足回收率要求,综合考虑,选择25 mg C18作为净化剂。
2.4 标准曲线、检出限与定量限
根据番茄中链格孢霉毒素含量水平,将4 种链格孢霉毒素用乙腈-1 mmol/L 碳酸氢铵水溶液(体积比50 ∶50) 稀 释 成 2.5、5.0、10.0、20.0、40.0、60.0、80.0、100、160 ng/mL 标准系列,在优化的仪器工作条件下进行分析,以待测目标物的质量浓度(x)为横坐标、峰面积(y)为纵坐标绘制标准曲线,以S/N=3 计算方法的检出限,以S/N=10 计算方法的定量,结果见表3。
4 种链格孢霉毒素在2.5 ng/mL~160 ng/mL 浓度范围内,线性关系良好,相关系数(r2)大于0.994 3,相比而言,由于使用SPE 净化时,稀释倍数低,检出限和定量限相对于QuEChERS 法要灵敏。
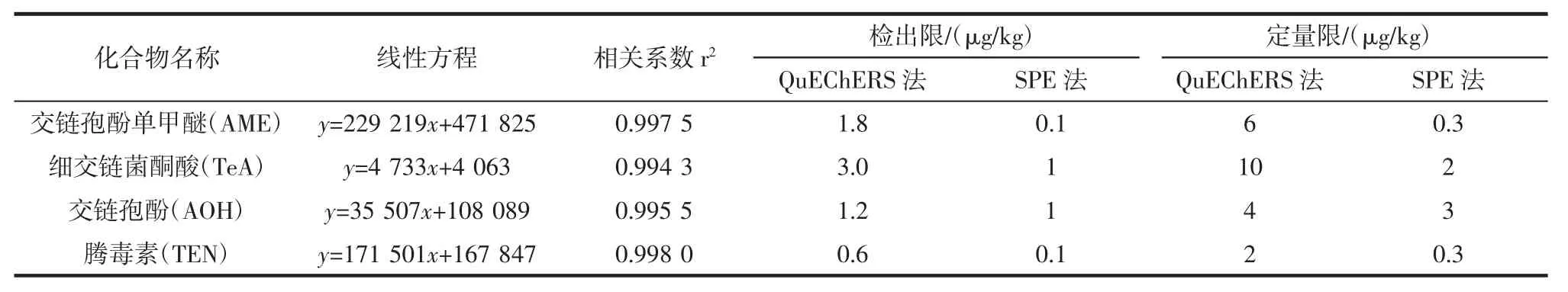
表3 番茄酱中4 种链格孢霉毒素的线性方程、相关系数(r2)、检出限及定量限Table 3 Regression equations,correlation coefficients(r2),detection limits(LOD)and quantification limits(LOQ)of the four alternaria toxins in tomato
2.5 方法的准确度和精密度
在 5.0 g 番茄空白样品中加入 10、200、360 μg/kg标准溶液,折算最终仪器的测定浓度,分别位于标准曲线的彽、中、高,每个添加浓度水平测定6 份平行样,方法的加标回收率及精密度相对标准偏差结果见表4。
番茄样品提取液中含有色素、糖等共萃组分需采取一定的净化方法去除干扰,提高链格孢霉毒素定量结果的准确性。将传统的SPE 法与QuEChERS 方法进行了比较,从表4 可以看出,SPE 的回收率在21 %~69 %,相对标准偏差值为1.3%~7.3%,交链孢酚单甲醚回收率最高,约69%,交链孢酚回收率最低,低、中、高平均回收率22.7%,净化过程中损失严重,而采用QuEChERS 方法的平均回收率在81%~115%,精密度相对标准偏差在2.1 %~11.2 %,回收率远高于SPE法,且QuEChERS 方法与SPE 净化法操作简便快速。
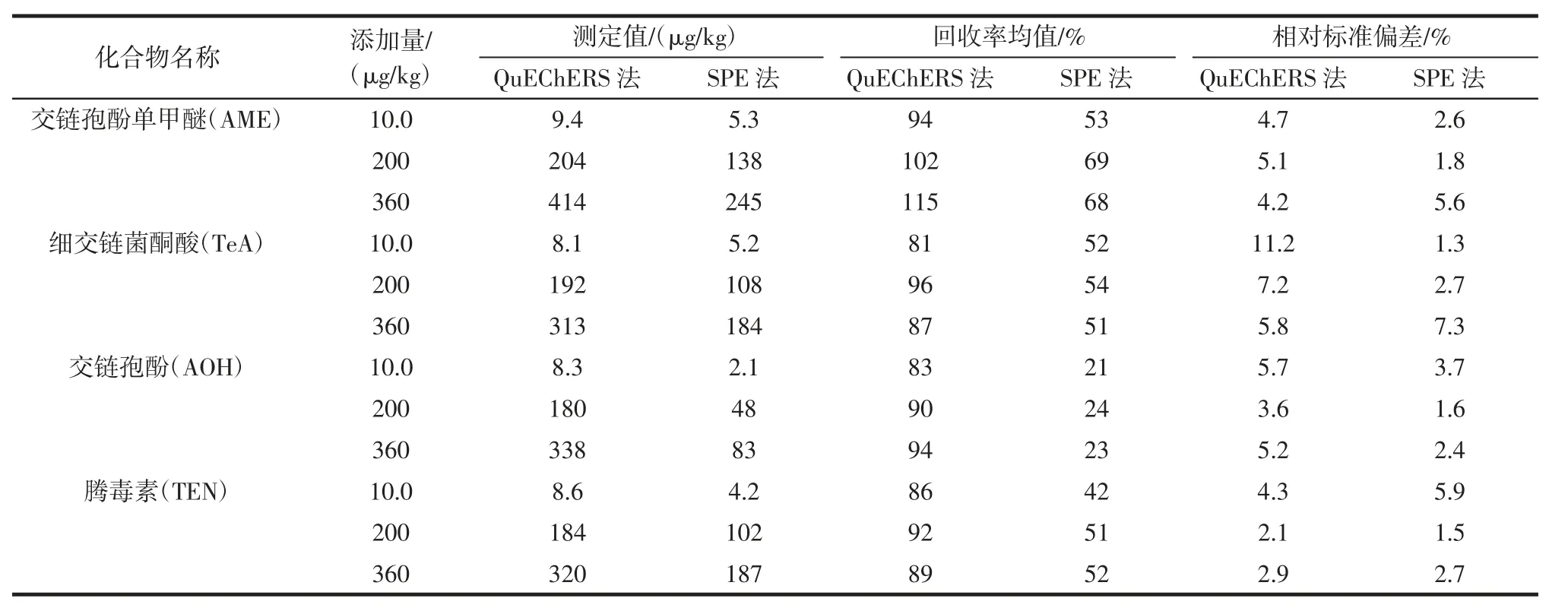
表4 方法的加标回收率及精密度(n=6)Table 4 Recoveries and precisions for the method(n=6)
2.6 样品的检测
应用QuCHERS 方法对24 份不同霉变程度的番茄样品中4 种链格孢霉毒素含量进行了测定,TeA、AOH、AME含量分别在 16.4 μg/kg~132.6 μg/kg、6.13 μg/kg~23.8 μg/kg、6.26 μg/kg~14.6 μg/kg 之间;有 1 份样品检出TEN,含量为4.21 μg/kg,且霉变部分的链格孢霉毒素远高于未霉变部分的含量,但未霉变部分仍受到链格孢霉毒素的污染,所以当番茄霉变后,去除霉变部分食用仍有一定程度的潜在风险,图2 为阳性样品的TIC 图谱。
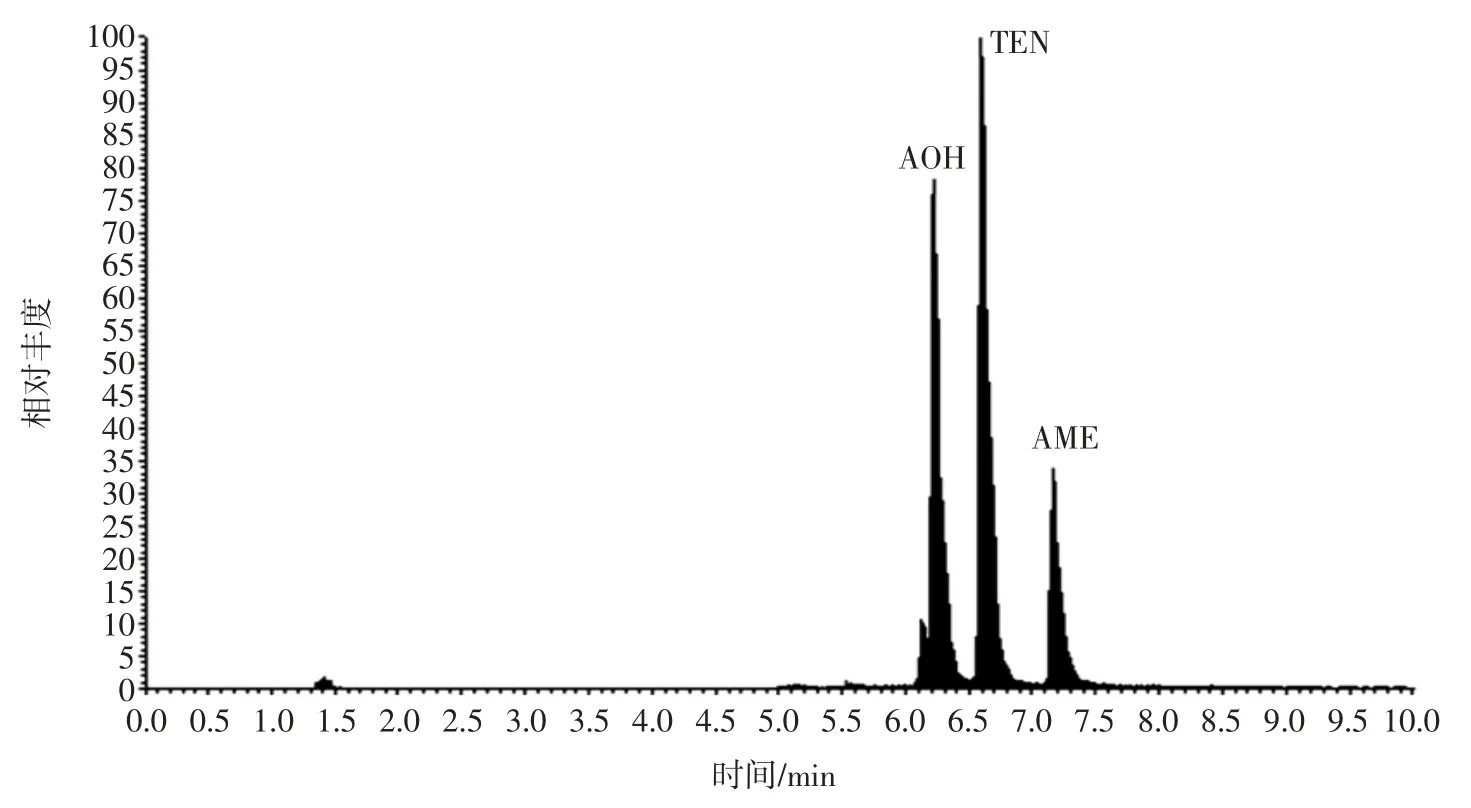
图2 阳性样品的TIC 图谱Fig.2 TIC chromatograms of positive samples
3 结论
本文将不同净化方法SPE 和QuEChERS 测定番茄中链格孢霉毒素方法进行了比较,采用SPE 法的理论检出限、定量相对于QuEChERS 方法更灵敏,但SPE 固相萃取净化的回收率在21 %~69 %,远低于QuEChERS 方法的平均回收率在 81 %~115 %,且QuEChERS 方法操作简便,避免固相萃取柱活化、上样、洗脱、氮吹等步骤,简便快捷,避免SPE 过柱过程中堵柱,更适用于番茄中链格孢霉毒素含量的测定。

