黄葵素抑制巨噬细胞浸润和活化改善db/db小鼠肾纤维化实验研究
浦 强,徐巍龙,李 楠,王丽娟,余江毅*
1南京中医药大学附属医院,南京 210029;2如皋市中医院,如皋 226500
糖尿病是一种慢性代谢紊乱疾病,近年来其发病率迅速增加[1]。糖尿病肾病(diabetic kidney disease,DKD)是糖尿病最常见的微血管并发症之一。DKD不仅是慢性肾病和终末期肾病的主要原因,也是心血管疾病(cardiovascular disease,CVD)的主要原因[2],严重威胁着人类健康,给人类造成沉重的社会和经济负担。目前糖尿病肾病的主要治疗措施包括控制血糖、血压,调节脂代谢,抗氧化,肾素-血管紧张素系统抑制剂应用等,但疗效不理想[3]。因此,积极寻找更加有效的糖尿病肾病防治措施具有重要的实际意义。
糖尿病肾病是以炎性细胞浸润和促炎因子过表达为特征的慢性炎性疾病[4]。巨噬细胞是关键的炎症细胞,在糖尿病肾病的发展和进展中起着重要作用[5]。巨噬细胞浸润肾小球和小管间质是绝大多数肾损伤的主要病理特征。过度浸润的巨噬细胞被肾环境中异常升高的致病因子激活,例如高糖,糖基化终产物(AGEs)和肾素激活后,巨噬细胞激活后可以分泌炎性细胞因子和趋化因子如肿瘤坏死因子TNF-α、白细胞介素IL-1β、单核细胞趋化蛋白MCP-1等,导致肾小球内细胞和基底膜损伤,引起间质纤维化[6]。研究发现去除肾脏募集的巨噬细胞可以有效地减少肾损伤的过程[7]。因此,阻断巨噬细胞活化途径,干预糖尿病肾病慢性炎症,延缓肾纤维化可能是预防和治疗糖尿病肾病肾损伤的有效策略。
本课题组临床实践发现,中药黄蜀葵花及制剂应用于糖尿病肾病、急慢性肾炎、肾病综合征等疾病的治疗,具有良好降低尿蛋白,改善肾损伤的临床疗效。药理研究表明,黄蜀葵花制剂可通过下调肾组织p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)信号通路,减少肾组织内转化生长因子TGF-β1的表达及炎症细胞的浸润,减轻阿霉素肾病肾组织的炎性损伤[8];并可以抑制Nod样受体蛋白(NLRP3)炎症小体活化和Toll样受体4/核转录因子信号通路[9];或抑制蛋白激酶B (protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白mTOR/核糖体蛋白S6激酶(ribosomal protein S6 kinase,P70S6K)信号通路[10],减少肾组织中TGF-β1的蛋白质表达,缓解糖尿病肾病大鼠模型肾脏炎症损伤。这些都表明,黄蜀葵花具有明确的抗炎,肾保护作用。但黄蜀葵花对糖尿病肾病背景下肾脏巨噬细胞浸润及活化状态研究尚少。
黄葵素(total flavones ofAbelmoschusmanihot,TFA)是由黄蜀葵花醇提获得,主要成分为黄蜀葵花总黄酮,本课题组前期研究发现黄葵素具有抗炎、抗纤维化、抗氧化的肾保护作用,降低尿蛋白,延缓糖尿病肾病的病情进展[11,12]。鉴于此,本研究以db/db小鼠为研究对象,观察不同给药剂量黄葵素对db/db小鼠肾组织巨噬细胞浸润、活化及肾脏炎症、纤维化的影响作用,从而阐明黄葵素对肾脏保护作用的可能机制,为临床防治DKD提供新依据。
1 材料和方法
1.1 动物
4周龄SPF级db /db雄性小鼠(BKS.CGm+/+LeprdbNJU)20只,同背景的db/m小鼠5只,体重约20 g,购自南京大学-南京生物医药研究所,动物许可证号:SCXK(苏)2015-0001。所有实验动物喂养程序严格按照南京中医药大学制定的实验动物保护条例执行。
1.2 药物
黄葵素由江苏省中医院制剂部提供,黄葵素溶于0.5%羧甲基纤维素钠溶液制成混悬液。
1.3 主要试剂
苏木精-伊红(HE)染色试剂盒、胶原纤维染色(Masson)染色试剂盒、免疫组化试剂盒(南京建成科技有限公司);Trizol(日本Takara公司);逆转录试剂盒、SYBR-Green PCR试剂盒(南京诺唯赞生物科技公司);SDS-PAGE凝胶配制试剂盒(南京碧云天生物技术有限公司);ECL检测试剂盒(南京凯基生物技术有限公司);波形蛋白(Vimentin)抗体、胶原蛋白III(Collagen III,Col III)抗体(北京四正柏生物科技有限公司);F4/80抗体(武汉三鹰生物技术有限公司)、β-actin抗体(美国cell signaling technology公司);辣根过氧化物酶HRP标记驴抗兔IgG(北京博奥森生物技术有限公司)。
1.4 主要仪器
SONO PULS超声细胞破碎机(德国Bandelin公司);Applied Biosystems 7500实时定量RT-PCR仪(美国ABI公司);激光共聚焦显微系统TCS SP5(德国Leica公司);倒置式生物显微镜CKX31(日本Olympus公司);超灵敏化学发光成像仪LAS4000(美国GE公司);小型蛋白电泳转移系统(美国Bio-Rad公司);蛋白转印槽Mini-protean Tetra Cell(美国Bio-Rad公司);冷冻型台式大容量高速离心机5810R(德国Eppendorf公司)。
2 方法
2.1 动物造模与分组
按随机数字表法将20只db/db小鼠按实验分为模型组、黄葵素低剂量治疗组(97.5 mg/kg/d,TFA-L)、黄葵素中剂量治疗组(195 mg/kg/d,TFA-M)、黄葵素高剂量治疗组(390 mg/kg/d,TFA-H),每组各5只,以同背景的db/m小鼠5只为空白对照组。
2.2 给药方法及处理
第8周db/db小鼠血糖、尿蛋白明显升高视为造模成功,db/db小鼠黄葵素治疗组按低、中、高剂量(97.5、195、390 mg/kg/d)黄葵素混悬液灌胃,db/m空白对照组与模型组小鼠给予等体积的0.5%羧甲基纤维素钠溶液,1次/天,连续16周。于第24周处死小鼠,收集血及肾组织。
2.3 指标检测
2.3.1 血、尿检测
第8、12、16、20、24周留取尿液;第24周摘眼取血。血、尿标本统一送江苏省中医院检验科用全自动生化分析仪检测尿微量白蛋白/肌酐比值(albumin-creatinine ratio,ACR)及血肌酐,血尿素氮等。
2.3.2 肾脏组织HE、Masson染色
肾组织蜡块连续切片(3 μm),经脱蜡、梯度乙醇脱水和HE染色,最后中性树胶封片。按各试剂盒说明书要求,进行HE、Masson染色,显微镜下400倍视野观察肾组织病理改变。
2.3.3 肾组织免疫组织化学标本留取及巨噬细胞标记F4/80的表达检测
肾组织蜡块连续切片(3 μm)采用二甲苯常规脱蜡、入水,3%过氧化氢封闭15 min,10%BSA封闭37 ℃ 孵育30 min。一抗孵育4 ℃过夜,PBS洗后二抗孵育37 ℃,1 h,DAB显色,水洗,梯度乙醇脱水,二甲苯透明,中性树胶封片。显微镜下观察肾脏组织病理改变。细胞内或胞膜出现黄褐色为阳性表达。最后分析各组切片的平均光密度(Mean of IOD)值(Image-Pro Plus 6.0软件分析)。
2.3.4 实时荧光定量聚合酶链技术(real-time quantitative polymerase chain reaction,RT-qPCR)法检测肾组织中炎症因子TNF-α、IL-1β和诱导型一氧化氮合酶(iNOS)mRNA的表达
根据Total RNA提取试剂、逆转录试剂盒、扩增试剂盒说明书要求进行提取组织的总RNA、逆转录及在Applied Biosystems 7500进行扩增反应。引物由上海生工生物公司设计合成,以GAPDH基因作为内参,各引物序列号见下表,结果分析采用2-ΔΔCT法计算mRNA的相对表达量。

表1 引物序列表Table 1 Primer sequence list
2.3.5 Western blot法检测肾组织中巨噬细胞标记F4/80及纤维化指标Collagen III、Vimentin蛋白表达
取肾组织50 mg,按全蛋白提取试剂盒,匀浆肾脏组织提取蛋白。按照BCA试剂盒测定蛋白浓度。将蛋白浓度用裂解液配平后,加入4x loading buffer,3 min,95 ℃ 蛋白变性3 min。按试剂盒制备分离胶和浓缩胶后,将等量的各样本20 uL分别上样、SDS-PAGE电泳、转膜,根据目的蛋白的位置留取所需PVDF膜,封闭2 h,分别加入兔抗小鼠一抗,4 ℃ 摇床孵育过夜,加入HRP标记的驴抗兔二抗,室温孵育2 h,ECL化学发光法显影,实验独立重复3次。将结果用Image Lab软件进行灰度值分析,及计算与内参β-actin的比值(GraphPad Prism8.0.1软件分析)。
2.4 统计学处理
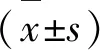
3 结果
3.1 各组小鼠尿ACR水平
随着实验时间推移,与对照组小鼠相比,模型组小鼠尿ACR水平显著升高(P<0.01),表明db/db小鼠出现糖尿病肾损伤的症状,且尿蛋白排泄随肾脏损伤进展逐渐增加。与模型组小鼠相比,各剂量黄葵素干预后小鼠尿ACR升高水平总体呈抑制趋势,低剂量组仅第16周差异存在统计学意义(P<0.05);中、高剂量组第12、16、20、24周所测得尿ACR水平均有统计学意义(P<0.05),尤其高剂量组第20周存在显著差异(P<0.01)。表明黄葵素降蛋白尿水平与黄葵素给药剂量相关。
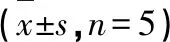
表2 各组小鼠尿ACR比较Table 2 Comparison of urine ACR in mice of each
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Note:Compared with control,*P<0.05,**P<0.01;Compared with model,#P<0.05,##P<0.01.
3.2 各组小鼠肾功能改变
实验结束时,与对照组小鼠相比,模型组小鼠血肌酐、尿素氮水平明显升高(P<0.01),提示db/db小鼠肾损伤明显,肾功能下降。与模型组小鼠相比,黄葵素给药组小鼠血肌酐、血尿素氮水平总体呈抑制的趋势,中剂量组血肌酐、高剂量组血尿素氮下降差异具有统计学意义(P<0.05),且高剂量组血肌酐下降呈显著差异(P<0.01)。
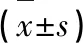
表3 各组小鼠肾功能比较Table 3 Comparison of renal function in each group of
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Note:Compared with control,*P<0.05,**P<0.01;Compared with model,#P<0.05,##P<0.01.
3.3 各组小鼠肾脏病理改变
HE染色结果显示,db/m对照组小鼠肾脏组织结构较清晰,肾小管排列较有序,间质无明显水肿表现;而db/db模型组小鼠肾组织出现肾小球体积扩大,系膜细胞及基质增生,部分肾小管扩张,肾小管上皮细胞空泡变性,但是通过黄葵素给药治疗后,这些病理改变呈剂量依赖性的减轻(图1)。
Masson染色结果显示,db/m对照组小鼠肾脏组织结构正常,肾小球基底膜和间质无明显胶原纤维的沉积,db/db模型组小鼠肾脏组织显示肾小球基底膜增厚,大量的胶原纤维沉积在肾间质,肾小管排列结构不清晰。而通过黄葵素治疗后,胶原纤维沉积呈剂量依赖性减轻(图2)。
3.4 各组小鼠肾间质纤维化改变
Western Blot法检测小鼠肾纤维化指标Col III、Vimentin蛋白结果显示:与对照组小鼠相比,模型组小鼠肾脏Col III、Vimentin蛋白表达显著增加(P<0.01);与模型组小鼠相比,黄葵素各剂量干预后,治疗组小鼠肾脏Col III、Vimentin蛋白表达均呈不同程度的抑制,且呈剂量依赖,高剂量较中剂量,中剂量较低剂量相比,两种蛋白减少更明显;其中与模型组db/db小鼠相比,黄葵素低剂量治疗组Vimentin下降差异无统计学意义,其他黄葵素治疗组Col III、Vimentin下降呈显著差异(P<0.01)(图3)。
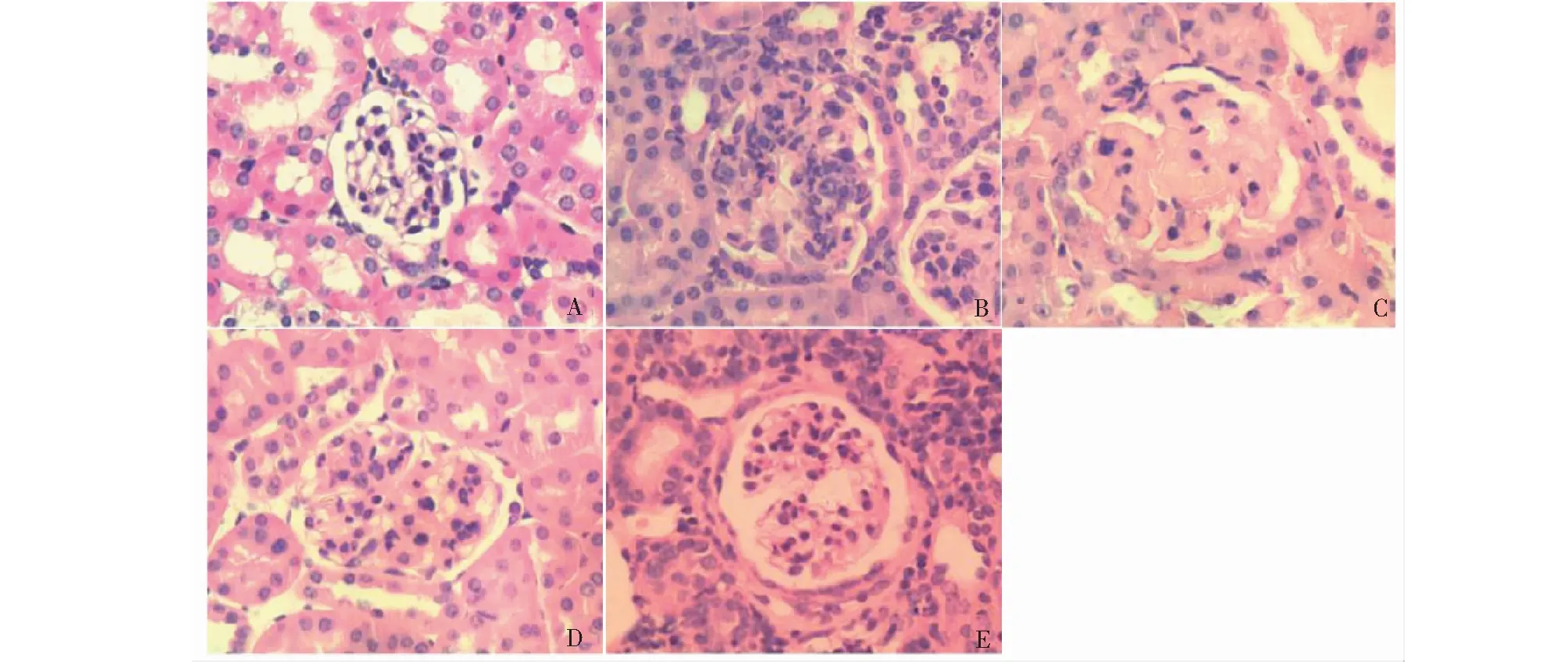
图1 HE染色各组小鼠肾组织病理形态学变化(×400)Fig.1 Pathological changes of renal tissue in mice of HE staining (×400) 注:A~E:db/m对照组、模型组、黄葵素低剂量组、黄葵素中剂量组、黄葵素高剂量组。Note:A~E:Control,Model,TFA-L,TFA-M,TFA-H.
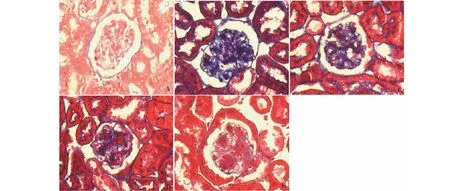
图2 Masson染色各组小鼠肾组织病理形态学变化(×400)Fig.2 Pathological changes of kidney tissue in each group of Masson staining mice (×400) 注:A~E:db/m对照组、模型组、黄葵素低剂量组、黄葵素中剂量组、黄葵素高剂量组。Note:A~E:Control,Model,TFA-L,TFA-M,TFA-H.
3.5 各组小鼠炎症介质表达结果
3.5.1 免疫组化检测巨噬细胞标记F4/80表达
免疫组化表明:对照组小鼠肾组织仅有少量巨噬细胞标记F4/80阳性巨噬细胞浸润。与对照组小鼠相比,模型组小鼠肾组织可见大量F4/80标记的棕染细胞,差异具有统计学意义(P<0.05);与模型组小鼠相比,黄葵素各剂量组小鼠肾组织F4/80表达呈不同程度下降,且黄葵素中、高剂量治疗组差异具有统计学意义(P<0.05)(图4和表4)。
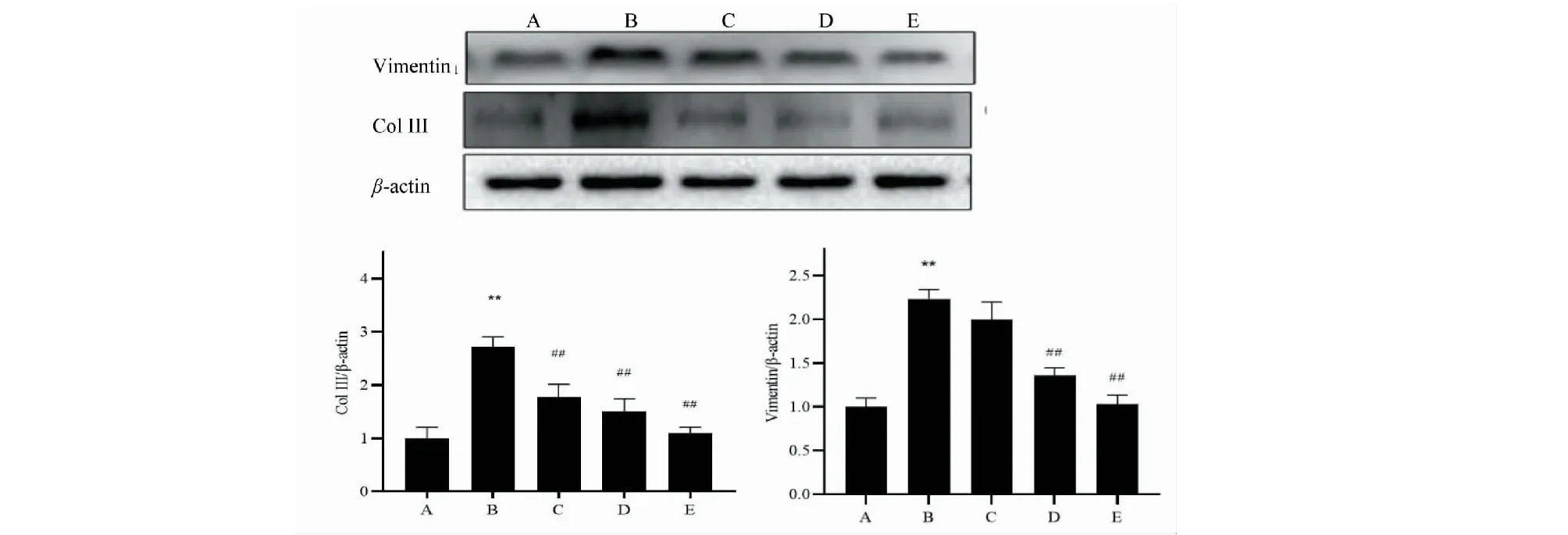
图3 蛋白印迹检测及光密度分析各组小鼠肾组织Vimentin、Col III蛋白的表达 Fig.3 Western blot analysis and optical density analysis of the expression of Vimentin and Col III protein in kidney tissues of mice 注:A~E:db/m对照组、模型组、黄葵素低剂量组、黄葵素中剂量组、黄葵素高剂量组;与对照组比较,*P <0.05,**P <0.01;与模型组比较,#P <0.05,##P <0.01。Note:A~E:Control,Model,TFA-L,TFA-M,TFA-H;Compared with control,*P <0.05,**P <0.01;Compared with model,#P <0.05,##P <0.01.
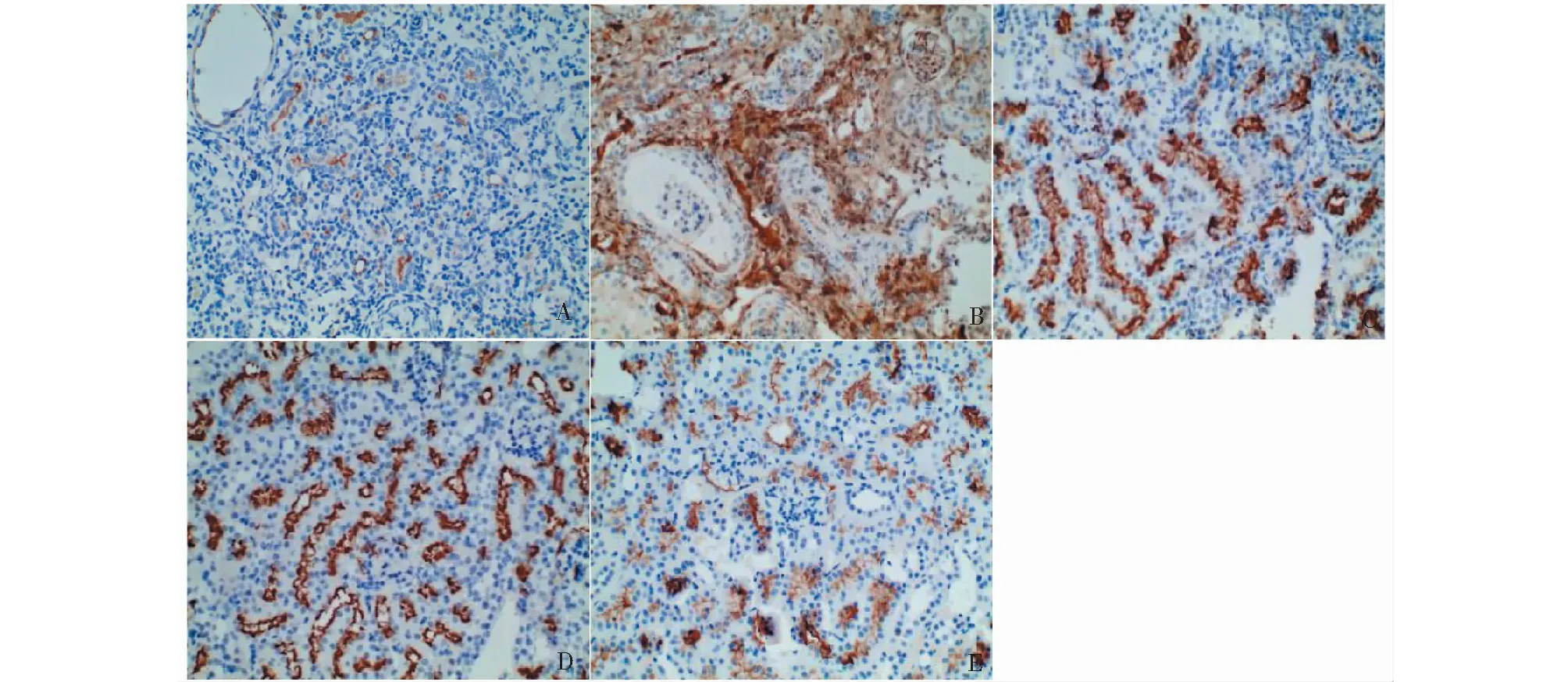
图4 各组小鼠肾组织中F4/80免疫组化变化(×200)Fig.4 Immunohistochemical changes of F4/80 in renal tissues of mice (×200)
3.5.2 Western blot法检测巨噬细胞标记F4/80表达
Western blot结果显示:与对照组小鼠相比,模型组小鼠肾组织中F4/80蛋白表达明显增加(P<0.01);与模型组小鼠相比,黄葵素给药治疗后,F4/80表达均呈不同程度的降低,黄葵素低剂量组差异无统计学意义(P>0.05),黄葵素中剂量组差异具有统计学意义(P<0.05),黄葵素高剂量组差异具有显著差异(P<0.01)。上述结果提示,巨噬细胞浸润参与了db/db小鼠肾损伤的过程,黄葵素治疗可抑制巨噬细胞的浸润(图5)。
3.5.3 RT-qPCR法检测各组小鼠肾组织炎症因子TNF-α、IL-1β和iNOS的mRNA表达
RT-qPCR结果显示:与对照组小鼠相比,模型组小鼠TNF-α、IL-1β的mRNA在肾脏表达显著上调(P<0.01),黄葵素各治疗组糖尿病小鼠TNF-α、IL-1β的表达呈显著下降(P<0.01)(图6),且呈剂量依赖性,表明黄葵素抑制了糖尿病肾组织中炎症因子的转录表达,发挥抗炎作用;iNOS为M1型巨噬细胞活化的标志,与对照组小鼠相比,模型组小鼠iNOS的mRNA在肾脏表达显著上调(P<0.01),黄葵素低、中、高剂量治疗各组糖尿病小鼠iNOS的表达呈显著下降(P<0.01)(图6),可见iNOS转录表达明显被黄葵素干预抑制,表明黄葵素还可以调控肾组织中浸润的巨噬细胞向M1型分化的作用,进一步抑制炎症因子的产生。
4 讨论
黄蜀葵花为锦葵科植物黄蜀葵Abelmoschusmanihot(L.)Medic.的干燥花冠,甘寒,归肾、膀胱经。具有清热利湿,消肿解毒等功效[13]。在临床实践中,我们课题组发现本虚为糖尿病肾病的发病机理,湿热致瘀为糖尿病肾病肾脏纤维化的主要病机,早期标实以湿热瘀阻,应立足于清利湿热,祛瘀扶正为原则,延缓糖尿病肾病的发展进程,防治其发展为ESRD。本课题组前期研究表明,黄蜀葵花具有明确的抗炎,肾保护作用,进一步探索黄蜀葵花作用于炎症主要效应细胞巨噬细胞的浸润及极化,对糖尿病小鼠肾纤维化的作用。
表4 小鼠肾组织中F4/80免疫组化平均光密度值Table 4 Mean optical density of F4/80 in renal tissues of
注:A~E:db/m对照组、模型组、黄葵素低剂量组、黄葵素中剂量组、黄葵素高剂量组;与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
Note:A~E:Control,Model,TFA-L,TFA-M,TFA-H;Compared with control,*P<0.05,**P<0.01;Compared with model,#P<0.05,##P<0.01.
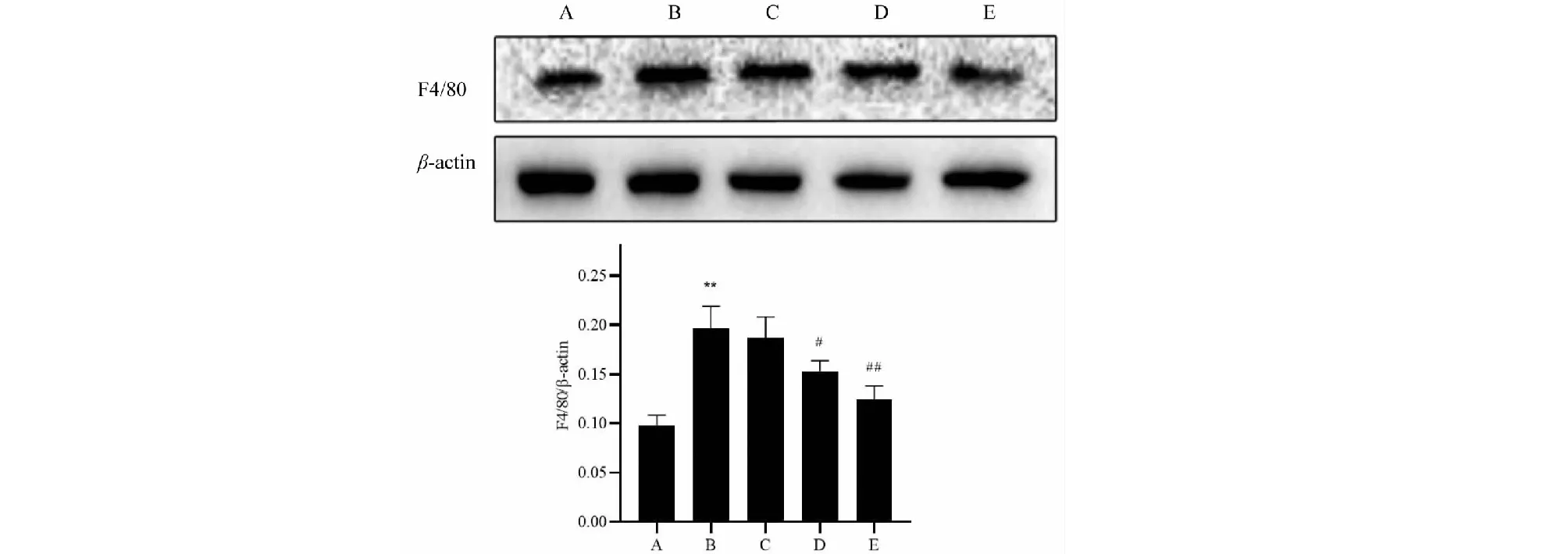
图5 蛋白印迹检测及光密度分析各组小鼠肾组织F4/80蛋白表达Fig.5 Western blot analysis and optical density analysis of mouse tissue F4/80 protein expression in each group 注:A~E:db/m对照组、模型组、黄葵素低剂量组、黄葵素中剂量组、黄葵素高剂量组;与对照组比较,*P <0.05,**P <0.01;与模型组比较,#P <0.05,##P <0.01。Note:A~E:Control,Model,TFA-L,TFA-M,TFA-H;Compared with control,*P <0.05,**P <0.01;Compared with model,#P <0.05,##P <0.01.
C57BLKS/J db /db小鼠是瘦素(Leptin)受体基因缺陷导致的自发型2 型肥胖与糖尿病动物模型,已广泛应用于各种糖尿病及并发症相关实验。研究证实,db/db小鼠在高血糖背景下7~8周时易发生糖尿病肾脏病变,表现为尿白蛋排泄明显增多,系膜细胞增生,基底膜增厚,足细胞数目及结构改变等肾脏结构损害,并随血糖进展,肾脏病变不断进行恶化[14],这与2型糖尿病患者有类似的肾脏病变,很好的模拟了糖尿病性肾病肾损伤的特征。尿ACR常用于临床诊断早期肾病的标准。本研究发现,模型组小鼠的尿ACR水平显著高于对照组,血肌酐及血尿素氮明显上升,肾脏病理提示:肾小球体积明显增大,系膜扩张,肾小管扩张,肾小球基底膜增厚,且大量胶原纤维组织沉积于肾小球,肾纤维化指标:Col III和Vimentin蛋白表达明显上调,这都表明db/db小鼠在糖尿病病程中出现了糖尿病肾病的表现,证明DKD模型成功。黄葵素治疗后,小鼠尿ACR水平呈不同程度控制,肾脏病理损害也呈剂量依赖性的减轻,Col III和Vimentin蛋白表达减轻,充分说明黄葵素具有降低尿蛋白,改善肾纤维化,发挥肾保护作用。
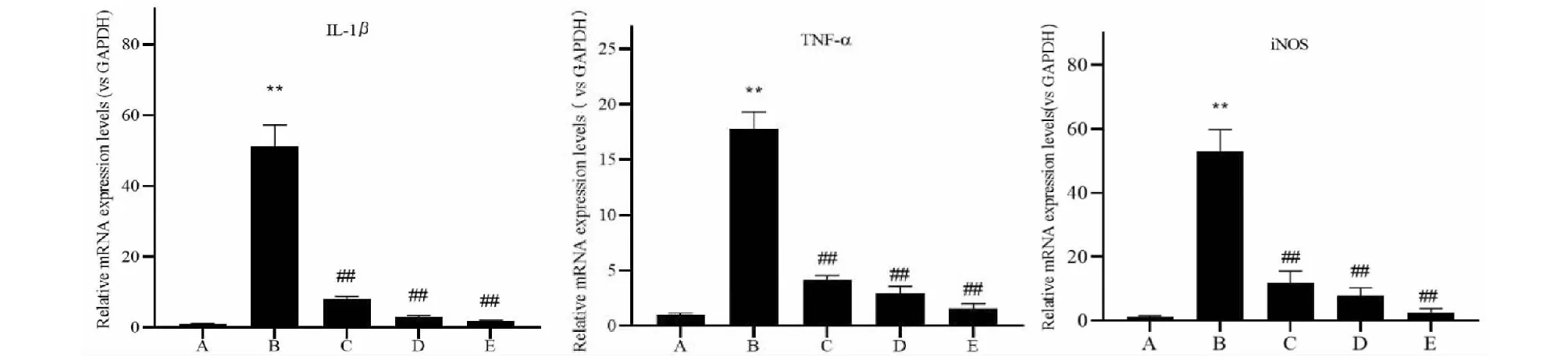
图6 实时定量PCR检测各组小鼠肾组织TNF-α、IL-1β和iNOS的mRNA表达Fig.6 RT-qPCR detection of mRNA expressions of TNF-α,IL-1β and iNOS in renal tissues of mice 注:A~E:db/m对照组、模型组、黄葵素低剂量组、黄葵素中剂量组、黄葵素高剂量组;与对照组比较,*P <0.05,**P <0.01;与模型组比较,#P <0.05,##P <0.01。Note:A~E:Control,Model,TFA-L,TFA-M,TFA-H;Compared with control,*P <0.05,**P <0.01;Compared with model,#P <0.05,##P <0.01.
炎症反应是糖尿病肾病中的重要病理过程,是导致肾损伤、纤维化的重要因素。在肾脏损伤的早期,血管内皮细胞损伤,血管通透性增加,巨噬细胞浸润入肾脏,在没有有效的干预情况下,浸润的巨噬细胞可以分泌不同的炎症因子,趋化因子,促纤维化因子和其他小分子,改变肾脏的局部微环境,破坏正常间质细胞的结构,并激活某些信号如释放蛋白水解酶,活性氧簇等导致肾小球损伤,结构重塑、硬化,小管萎缩,间质炎症及纤维化[15]。本研究采用免疫组化法及WB检测肾组织中巨噬细胞浸润情况,qPCR定量分析炎症因子TNF-α、IL-1β的mRNA表达改变。结果提示,与对照组相比,模型组小鼠巨噬细胞标记F4/80表达明显增加,且炎症因子TNF-α、IL-1β的mRNA表达显著增加,说明糖尿病肾病中有巨噬细胞浸润入肾脏组织,参与了糖尿病肾病的炎症进程。黄葵素治疗后可下调F4/80的表达,及减少肾组织中炎症因子TNF-α和IL-1β的mRNA表达,且呈剂量依赖,证实db/db小鼠发生肾损伤时,过度积累F4/80阳性的巨噬细胞,黄葵素干预减少了浸润巨噬细胞的数量,抑制了炎症因子表达,发挥抗炎,肾保护的作用。
iNOS可由活化的巨噬细胞产生,是巨噬细胞活化为 M1 的标志产物之一,M1型细胞主要介导肾脏炎症和纤维化[16]。在损伤的早期阶段,M1型巨噬细胞可诱导活性氧的产生,促进NO的合成,并释放各种炎症因子,如iNOS、TNF-α和IL-1β,从而导致肾小球受损内在细胞和基底膜,从而引起蛋白尿和肾小球炎症[17]。本研究中观察显示,与对照组小鼠比较,糖尿病小鼠 iNOS 的 mRNA 表达增加明显,提示糖尿病小鼠肾组织存在巨噬细胞浸润同时还存在M1型巨噬细胞活化,黄葵素治疗抑制了M1型巨噬细胞的活化。可见,黄葵素抑制巨噬细胞浸润及极化,减少巨噬细胞活化后炎症因子的释放,有明确的抗炎,免疫调节作用。
综上所述,本研究表明糖尿病小鼠合并肾损伤时,肾脏组织巨噬细胞浸润明显,巨噬细胞标志蛋白F4/80及炎症因子TNF-α、IL-1β的mRNA表达水平显著升高,并与肾脏纤维化Col III蛋白和波形蛋白表达呈正相关;黄葵素治疗可以显著降低db/db小鼠尿ACR,缓解肾脏的病理损害,改善肾纤维化,具有肾脏保护作用,作用机制可能与其抑制巨噬细胞浸润、减少炎症因子表达及抑制M1型巨噬细胞极化有关。但巨噬细胞具有可塑性,功能复杂,根据局部微环境刺激的不同,巨噬细胞可活化为致促炎、组织损伤和致抗炎、防御、组织修复等不同功能的亚型。按表面标记不同可分为经典激活的M1型和替代活化的M2a、M2b、M2c型[18],如:通过暴露于干扰素(IFN)-γ或脂多糖(LPS)诱导为M1型巨噬细胞,释放细胞因子如IL-1、IL-6和TNF-α,具有促炎功能[18]。与此相反,M2型巨噬细胞具有抗炎功能和表达精氨酸酶,甘露糖受体和IL-10等[19]。活化的M2型巨噬细胞可以进一步分为三个亚组:由IL-4和/或IL-13诱导为M2a型巨噬细胞,具有组织修复作用;M2b型巨噬细胞由免疫复合物和M2c型巨噬细胞诱导,具有抗炎作用,并被IL-10、TGF-β或糖皮质激素诱导[20]。研究证实,调节巨噬细胞极化后表型可减轻肾脏炎症反应,改善肾损害[21]。而黄葵素是否进一步通过调节M1/M2巨噬细胞极化状态改善肾纤维化,发挥肾保护有待进一步深入研究。

