基于HPLC指纹图谱技术的地黄块根抗氧化活性谱效关系研究
耿晓桐,王丰青,谢彩侠,,张 苗,陈志红,龚海燕,雷敬卫,张重义
1河南中医药大学药学院,郑州450046;2福建农林大学作物科学学院作物科学学院,福州350000;3河南农业大学农学院,郑州450000
地黄(RehmanniaglutinosaLibosch)是玄参科(Scrophulariaceae)地黄属多年生草本植物,以根茎入药,含有糖类、苯乙醇苷类、环烯醚萜苷类[1]、酚类等物质[2],具有抗衰老、降血糖、抗肿瘤、调节免疫功能等多种药理作用[3],上述药理作用均与其抗氧化活性密切相关[4]。随着自由基和抗氧化理论研究的深入,尤其是一些合成抗氧化剂的毒副作用被发现后,天然抗氧化剂的开发和应用越来越受到人们的重视,因此从中草药及其提取物中寻找低毒、廉价、高效的抗氧化成分引起了学者的广泛关注[5]。地黄对生长环境要求较低,可以大量人工栽培,并将其抗氧化成分进行提取制成天然抗氧化剂具有一定的现实意义[6]。
明朝李时珍曰:“今人惟以怀庆地黄为上,亦各处随时兴废不同尔”,《本草从新》记载:“以怀庆肥大而短,糯体细皮,菊花心者佳”[7,8]。现代研究发现,道地产区的怀地黄横切面有“菊花心”特征。文献研究表明地黄“菊花心”的比例影响梓醇及毛蕊花糖苷的含量[9,10]。课题组前期研究也发现地黄有效成分在“菊花心”与“非菊花心”组织部位的分布并不均匀[11],而且不同种质地黄“菊花心”部位的有效成分及表型性状也存在差异,其中85-5与北京1号地黄块根的“菊花心”质量特征差异较大[12]。抗氧化活性是地黄重要的药理活性之一[4],目前关于地黄抗氧化活性的研究主要侧重于不同地黄饮片、多糖及其他提取物等方面[13-15],而地黄块根中“菊花心”与非菊花心部位抗氧化活性的研究还未见报道。基于此,本实验以85-5、北京1号地黄为研究对象,对其“菊花心”、“非菊花心”及整体块根不同极性部位的抗氧化活性进行测定,并利用Pearson相关系数法对抗氧化活性较强部位的HPLC指纹图谱与其抗氧化活性进行谱效关系分析,为地黄抗氧化活性物质的筛选及地黄菊花心与其道地性关系的研究提供理论依据。
1 仪器与试药
1.1 仪器
1510型酶标仪(赛默飞世尔科技有限公司);ME204E万分之一电子天平(梅特勒-托利多仪器有限公司);DZF-6050真空干燥箱(上海精宏实验设备有限公司);10~100 μL移液枪(艾本德国际贸易有限公司);MS105DU十万分之一电子天平(奥豪斯仪器有限公司)。
1.2 试剂
抗坏血酸(分析纯,天津市恒兴化学试剂制造有限公司,批号:GB/T 15347-1994)、甲醇(分析纯,天津恒兴化学试剂制造有限公司);1,1-二苯基-2-三硝基苯肼( DPPH)(东京化成工业株式会社);石油醚、氯仿、乙酸乙酯、正丁醇(分析纯,天津富宇精细化工有限公司);乙腈(色谱纯,安徽天地高纯溶剂有限公司);溴化钾(天津恒兴试剂制造有限公司);毛蕊花糖苷(四川维克奇有限公司,批号:MUST-17020715,纯度:99.57%);自制蒸馏水。
1.3 实验样品
实验所用的85-5、北京1号种质地黄药材均采集于道地产区河南温县武德镇亢村怀地黄种植基地,分别于9.10~11.10在地黄生育期内采集地黄块根,每次随机选取10株,经河南中医药大学董诚明教授鉴定为玄参科植物地黄RehmanniaglutinosaLibosch的新鲜块根。将采集到的两个种质地黄块根用流水冲洗干净,并用陶瓷刀将其分为菊花心、非菊花心及整体块根三部分。将三个部位的药材烘干、粉碎后过三号筛,保存于干燥器中备用。
2 结果与分析
2.1 地黄块根不同组织及部位的体外抗氧化活性测定方法的建立
2.1.1 供试品溶液的制备[16]
准确称取地黄根、菊花心、非菊花心三个部位的粉末300 g,分别以10、8、6倍蒸馏水为提取液,加热煮沸,保持沸腾1 h,合并提取液,纱布滤过,减压浓缩至浸膏,减压浓缩至粉末,即得总提取物。取适量总提取物用蒸馏水溶解,并转入分液漏斗中,依次用石油醚(极性偏小,萃取量过少,此部位舍弃)、氯仿、乙酸乙酯、正丁醇萃取(1∶1),每级重复3次,依次得到石油醚、氯仿、乙酸乙酯、正丁醇提取液。将提取液至减压干燥中于粉末状,4 ℃储存备用。
2.1.2 DPPH对照品溶液的制备
精密称取DPPH 8 mg,甲醇溶解并定容至100 mL容量瓶中,即得浓度为20 mmol/mL的DPPH溶液,现配现用。
2.1.3 阳性对照液的制备
精密称定抗坏血酸20 mg,用甲醇溶解并定容至10 mL容量瓶中,即得阳性对照液,现配现用,临用前按所需浓度进行稀释。
2.1.4 DPPH抗氧化活性的测定[17]
用甲醇少量多次溶解各部位萃取物,采用超声波使其溶解完全,配制不同浓度梯度的各萃取物溶液,并用抗坏血酸(Vc)溶液作为对照,取样品溶液100 μL,加入100 μL 20 mmol/mL DPPH甲醇溶液。混匀避光放置30 min后,在517 nm处测定样品吸光度A1;空白组A0以等量蒸馏水代替DPPH溶液;对照组A2以等量蒸馏水代替样品溶液。平行测定3次,取平均值。
DPPH自由基清除率计算公式为:
DPPH自由基清除率=[1-(A1-A0)/A2]×100%
式中:A0为空白组吸光值,A1为样品溶液吸光值,A2为对照组吸光值。
2.2 地黄块根DPPH抗氧化活性结果分析
2.2.1 DPPH阳性对照液抗氧化活性
按“2.1.4”项所示测定阳性对照抗坏血酸溶液对DPPH自由基的清除率,以抗坏血酸为阳性对照,在0.006~0.016 mg/mL范围内时,DPPH自由基的清除效果随着抗坏血酸浓度的增加,DPPH自由基的清除效果逐渐增强。
2.2.2 北京1号和85-5地黄菊花心、非菊花心及整体块根氯仿部位抗氧化活性分析
两品种地黄菊花心、非菊花心及整体块根氯仿部位溶液的DPPH自由基清除率结果(见表1、图1)表明,85-5和北京1号地黄菊花心、非菊花心及整体块根氯仿部位样品都对DPPH自由基的清除作用存在剂量依赖效应,当样品浓度范围为0.05~0.70 mg/mL内,随着各萃取物浓度增加,清除率也相应增加。在0.05~0.7 mg/mL浓度范围内,85-5地黄清除率为非菊花心样品>整体块根样品,北京1号地黄非菊花心与整体块根样品清除率相当;在0.30~0.70 mg/mL浓度时北京1号地黄清除率为菊花心>非菊花心,85-5品种在相同浓度条件下清除率为非菊花心>菊花心;而在0.05~0.3 mg/mL浓度范围内,两种质地黄菊花心清除率均低于非菊花心,说明低浓度下两种质地黄氯仿部位的非菊花心清除率高于菊花心部位。整体而言,北京1号地黄菊花心样品在高浓度时的清除率明显高于同浓度其他样品,后期可进一步对北京1号地黄“菊花心”部位的有效成分与抗氧化活性之间的关系进行深入研究。
2.2.3 北京1号和85-5地黄菊花心、非菊花心及整体块根乙酸乙酯部位抗氧化活性分析
两品种地黄菊花心、非菊花心及整体块根乙酸乙酯部位溶液的DPPH自由基的清除率结果(见表2、图2)表明,85-5、北京1号地黄菊花心、非菊花心及整体块根乙酸乙酯部位对DPPH均有一定的清除作用,且表现出良好的剂量效应关系。当样品浓度为0.03~0.50 mg/mL时,两种质地黄清除DPPH自由基能力均为非菊花心、整体块根部位>菊花心部位,在0.03~0.2 mg/mL浓度范围内,85-5地黄在此浓度范围内清除率关系为整体块根>非菊花心,北京1号地黄在此浓度范围内清除率关系为非菊花心>整体块根;而在0.2~0.5 mg/mL浓度范围内,两者的清除率相当。总体而言,两品种地黄菊花心部位的清除率均低于其它部位;当浓度较低时,地黄非菊花心、整体块根的清除率随种质不同而略有差异,浓度较高时两者清除率无明显差异。后期可进一步对其他品种地黄整体块根与非菊花心部位的清除率进行系统分析。

表1 两品种地黄氯仿部位DPPH自由基清除率结果(%)Table 1 DPPH free radical scavenging results of two varieties of Rehmannia glutinosa chloroform(%)
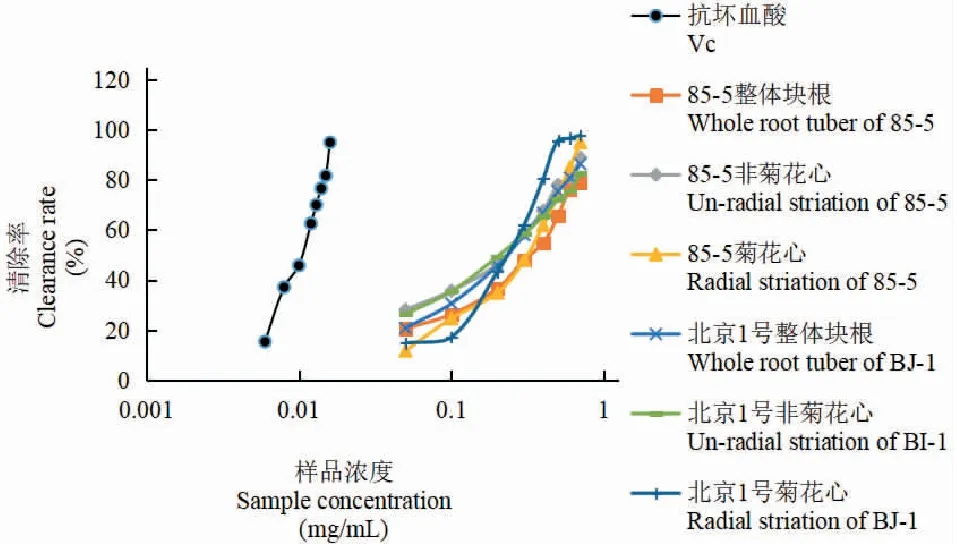
图1 地黄氯仿部位的抗氧化活性Fig.1 Antioxidant activity of chloroform at Rehmannia glutinosa

表2 乙酸乙酯部位DPPH自由基清除率结果(%)Table 2 DPPH free radical scavenging results of ethyl acetate fraction(%)
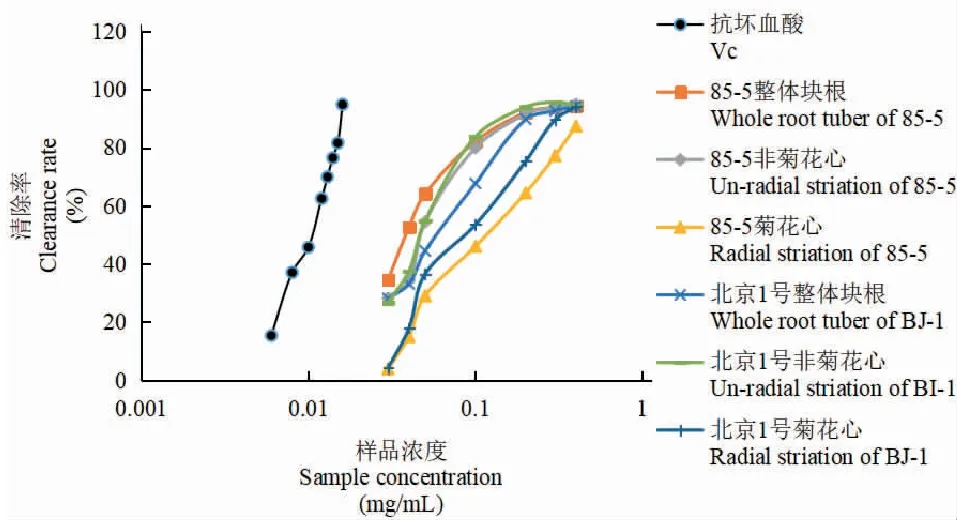
图2 地黄乙酸乙酯部位的抗氧化活性Fig.2 Antioxidant activity of ethyl acetate at Rehmannia glutinosa
2.2.4 北京1号和85-5地黄菊花心、非菊花心及整体块根正丁醇部位抗氧化活性分析
两品种地黄菊花心、非菊花心及整体块根正丁醇部位溶液的DPPH自由基的清除率结果(见表3、图3)表明,在0.05~0.70 mg/mL的样品浓度范围内,85-5、北京1号地黄整体块根及非菊花心的正丁醇部位抗氧化能力无明显差异,均大于两品种地黄菊花心正丁醇部位的抗氧化能力,但在此浓度范围内菊花心、非菊花心及整体块根正丁醇部位抗氧化能力均弱于抗坏血酸。
2.2.5 北京1号和85-5地黄菊花心、非菊花心及整体块根清除DPPH自由基的半数抑制率方差分析
为了进一步比较地黄块根不同极性萃取部位样品抗氧化活性的差异,我们利用SPSS19.0计算不同地黄样品DPPH自由基清除率的IC50值(见图4),并对85-5、北京1号地黄“菊花心”、“非菊花心”及整体块根的氯仿、乙酸乙酯、正丁醇萃取样品清除DPPH自由基IC50值进行单因素方差分析,结果显示,乙酸乙酯部位与氯仿、正丁醇部位样品清除DPPH IC50值具有显著性差异,而氯仿与正丁醇部位样品清除DPPH IC50值并无显著性差异。

表3 正丁醇部位DPPH自由基清除率结果 /%Table 3 DPPH free radical scavenging results of n-Butanol site /%

图3 地黄正丁醇部位的抗氧化活性Fig.3 Antioxidant activity of n-butanol at Rehmannia glutinosa
IC50值,即指抑制率达到50%时样品的浓度,IC50值越小,则说明样品的抑制率越高,即样品清除DPPH自由基的活性越强。图4表明,两种地黄不同极性部位IC50值均为乙酸乙酯部位<氯仿部位<正丁醇部位,即乙酸乙酯部位清除DPPH自由基的活性最强,且单因素方差分析结果显示乙酸乙酯部位样品IC50值与氯仿、正丁醇部位IC50值具有显著性差异,而氯仿与正丁醇部位样品清除DPPH 的IC50值无显著性差异。另外,图4结果显示,两种地黄乙酸乙酯部位非菊花心与整体块根IC50值相对较低,且两品种之间差异较小;两品种地黄菊花心IC50值相对偏高,而且品种之间差异较大,说明两品种地黄菊花心中具有抗氧化性物质的特征可能存在一定差异。
2.3 乙酸乙酯部位HPLC指纹图谱方法的建立
2.3.1 供试品溶液的制备
精密称取“2.4.1”项下所得乙酸乙酯部位萃取物粉末0.1 g,甲醇溶解并定容至10 mL容量瓶中,0.22 μm微孔滤膜过滤即得。

图4 样品清除DPPH自由基的半数抑制率结果Fig.4 Results of half-inhibition rate of sample scavenging DPPH free radicals 注:1,2,3分别为85-5菊花心氯仿部位、乙酸乙酯部位、正丁醇部位;4,5,6分别为85-5非菊花心氯仿部位、乙酸乙酯部位、正丁醇部位;7,8,9分别为85-5整体块根氯仿部位、乙酸乙酯部位、正丁醇部位;10,11,12分别为北京1号菊花心氯仿部位、乙酸乙酯部位、正丁醇部位;13,14,15分别为北京1号非菊花心氯仿部位、乙酸乙酯部位、正丁醇部位;16,17,18分别为北京1号整体块根氯仿部位、乙酸乙酯部位、正丁醇部位;19:抗坏血酸阳性对照。Note:1,2,3 are the chloroform part,ethyl acetate part and n-butanol part of the radial striation of 85-5;4,5,6 are the chloroform part,ethyl acetate part and n-butanol part of the un-radial striation of 85-5;7,8,9 are the chloroform part,ethyl acetate part and n-butanol part of the whole roots of 85-5;10,11,12 are the chloroform part,ethyl acetate part and n-butanol part of the radial striation of BJ-1;13,14,15 are the chloroform part,ethyl acetate part and n-butanol part of the un-radial striation of BJ-1;16,17,18 are the chloroform part,ethyl acetate part and n-butanol part of the whole roots of BJ-1;19 is a positive con- trol for ascorbic acid.
2.3.2 对照品溶液的制备
精密称取毛蕊花糖苷对照品1.08 mg置5 mL容量瓶中,用甲醇溶解并定容,即得浓度为0.216 mg/mL的毛蕊花糖苷对照品溶液。
2.3.3 色谱条件
Athean C18色谱柱(4.6 mm×250 mm,5 μm);检测波长245 nm,流速1.0 mL/min;柱温30 ℃;流动相为乙腈(A)-0.02%醋酸水溶液(B)梯度洗脱(0~10 min,3%~12% A;10~15 min,12% A;15~20 min,12%~15% A;20~25 min, 15% A;25~30 min,15%~18% A;30~46 min,18%~20% A;46~65 min, 20% A)。分别精密吸取供试品与对照品溶液各10 μL,注入高效液相色谱仪,进样测定,记录色谱图,见图5。

图5 乙酸乙酯部位HPLC色谱图 (A:对照品色谱图 B:供试品色谱图 a:毛蕊花糖苷)Fig.5 HPLC chromatogram of ethyl acetate (A:chromatogram of reference substance B:chromatogram of test sample a:acteoside)
2.3.4 精密度试验
取85-5地黄块根乙酸乙酯萃取物样品粉末制备供试品溶液1份,连续进样6次,记录色谱图,以13号峰为参照物峰,计算各主要色谱峰,计算各主要色谱峰的相对保留时间和相对峰面积,其RSD值均小于3%,表明仪器精密度良好。
2.3.5 重复性试验
取85-5非菊花心乙酸乙酯萃取物粉末制备供试品溶液6份,分别进样,记录色谱图,以13号峰为参照物峰,计算各主要色谱峰的相对保留时间和相对峰面积,其RSD 值均小于3%,表明实验重复性良好。
2.3.6 稳定性试验
取北京1号根乙酸乙酯部位萃取物药粉末制备供试品溶液,分别于0、2、4、8、12、24 h进样,记录色谱图,以13号共有峰为参照物峰,计算各主要色谱峰的相对保留时间和相对峰面积,其RSD值均小于3%,表明供试品溶液在24 h内稳定。
2.4 地黄菊花心、非菊花心及整体块根乙酸乙酯部位HPLC指纹图谱叠加图及对照图谱生成
将85-5和北京1号地黄的24份不同部位的样品(s1~s4为85-5菊花心样品,s5~s8为85-5非菊花心样品,s9~s12为85-5整体块根样品,s13~s16为北京1号菊花心样品,s17~s20为北京1号非菊花心样品,s21~s24为北京1号整体块根)按2.2.1项下制备供试品溶液,按2.2.3项下色谱条件分别进样,并记录色谱图,获取24批地黄样品的HPLC指纹图谱叠加图(见图6)。采用国家药典委员会颁布的《中药色谱指纹图谱相似度评价系统》(2004 A版)对24批样品HPLC色谱图进行图谱拟合,设定时间窗宽度为0.3,采用中位数法生成对照图谱(见图7)。
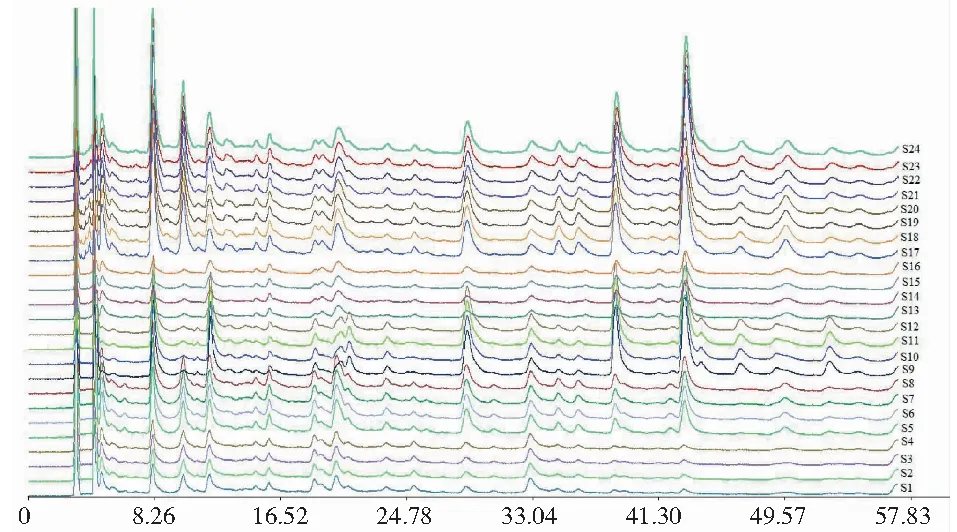
图6 24批样品HPLC指纹图谱叠加图谱Fig.6 HPLC fingerprint overlay map of 24 batch samples

图7 24批样品HPLC指纹图谱对照图谱(13:毛蕊花糖苷)Fig.7 HPLC fingerprint map of 24 batch samples (13:acteoside)
图4结果显示,两品种地黄菊花心、非菊花心及整体块根乙酸乙酯部位HPLC指纹图谱色谱峰的数目基本相同,但色谱峰的面积差异较大,而相同组织的乙酸乙酯部位HPLC指纹图谱特征较为较近,说明地黄块根不同组织乙酸乙酯部位的化学成分种类基本一致,其质量特征的差异主要表现在化学成分含量的高低。图5显示,不同地黄样品乙酸乙酯部位HPLC指纹图谱的共有模式共标定出14个共有峰,均指认出毛蕊花糖苷成分。
2.5 地黄块根乙酸乙酯部位HPLC指纹图谱与DPPH抗氧化活性谱效关系分析
将8批85-5和北京1号地黄块根乙酸乙酯部位HPLC指纹图谱共有模式各峰面积量化值(见表4)分别与所对应的DPPH清除率(表5)进行Pearson相关性分析。由结果可以看出,不同浓度样品与其HPLC指纹图谱峰面积量化值的相关性具有明显差异,当乙酸乙酯部位样品浓度为0.50和0.40 mg/mL时,其DPPH清除率已达到较高平稳状态,不同样品之间差异较小,Pearson分析结果显示并无特定的共有峰与其呈显著相关;当乙酸乙酯部位样品浓度为0.30和0.20 mg/mL时,Pearson分析结果显示共有峰X1与其呈显著负相关;当乙酸乙酯部位样品浓度小于0.10 mg/mL时,Pearson分析结果显示共有峰X2与其呈显著负相关,共有峰X10与其呈显著正相关。以上结果表明地黄乙酸乙酯部位中X1、X2、X10成分对其抗氧化活性具有显著的影响。另外,不同浓度乙酸乙酯部位的谱效关系结果显示毛蕊花糖苷与地黄抗氧化活性均呈明显的正相关关系,说明毛蕊花糖苷具有一定的抗氧化活性,这与文献报道[18,19]相一致。
3 讨论
自由基能够引起脂质过氧化、DNA氧化损坏等重要分子物质损伤,与心血管、肿瘤等疾病的发生有着密切的关系,适当服用抗氧化剂有利于疾病的预防,而合成类抗氧化剂对人体有一定的毒副作用[18],因此从中药中筛选出天然抗氧化活性成分是科研界的热点[19]。

表4 地黄整体块根乙酸乙酯部位HPLC指纹图谱共有峰峰面积量化值Table 4 Quantitative peak area peak value of HPLC fingerprint of ethyl acetate in roots of roots
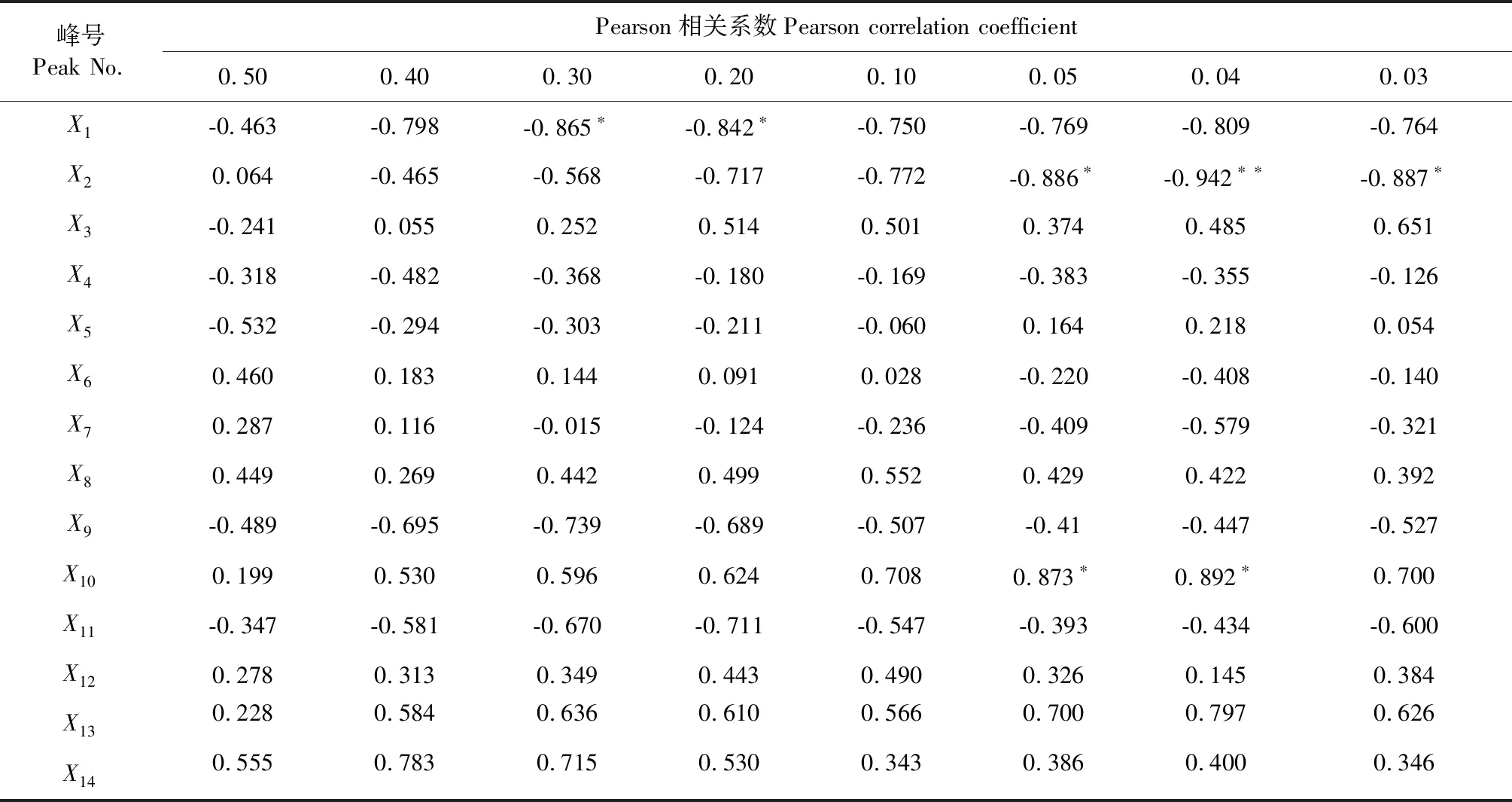
表5 样品HPLC峰面积量化值与不同浓度供试品溶液(mg/mL)对DPPH清除率的相关分析矩阵Table 5 Quantitative analysis of HPLC peak area of sample and correlation analysis matrix of DPPH clearance rate of sample solution (mg/mL)
注:*在P<0.05 水平下显著相关;**在P<0.01 水平下极显著相关。
Note:*Significantly correlated atP< 0.05 level;**extremely significant correlation atP< 0.01 level.
多糖作为中药中一类重要的活性成分,具有多种药理活性。文献报道当归多糖能显著提高D-半乳糖致衰老小鼠血清中抗氧化相关酶的活性,降低自由基对膜脂的过氧化作用;灵芝多糖可降低脂质过氧化产物的增多,增强抗氧化酶的活力,减少氧自由基对机体的损伤。地黄味甘,块根中的多糖具有抗氧化、抗肿瘤、增强免疫、抗焦虑、促进造血等药理作用,而地黄在临床使用过程中多以水煎为主,水煎后味道变甘甜,这可能与煎煮过程中地黄中多糖水解成单糖有关。课题组前期研究发现,地黄块根菊花心中多糖的含量均低于非菊花心部位[16],而本研究结果表明,地黄块根菊花心部位的抗氧化能力均低于非菊花心部位,而且不同品种的菊花心部位抗氧化能力也存在差异,那么这种差异的存在是否与两组织中地黄多糖的含量及煎煮后产生的单糖种类存在着一定的关系,后期可利用衍生化技术对不同地黄品种煎煮前后菊花心、非菊花心及整体块根中单糖的种类、含量及其与地黄抗氧化活性的关系进行深入研究,以揭示地黄菊花心和非菊花心部位抗氧化活性的差异与多糖特征之间的内在联系。
本研究结果表明乙酸乙酯为地黄菊花心、非菊花心、整体块根抗氧化活性最强的部位,该部位中的X1、X2及X10三个成分对其抗氧化活性具有显著影响,毛蕊花糖苷则具有较强的抗氧化活性。这与文献报道中发现地黄中玉叶金花苷酸[20]、海胆苷、焦地黄苯乙醇苷A1/A2、毛蕊花糖苷、异毛蕊花糖苷[21]等成分具有一定的抗氧化能力相一致。中药是一个复杂的体系,地黄抗氧化活性是地黄中多种成分通过多个靶点共同作用所产生的,本研究指认出与抗氧化活性相关的毛蕊花糖苷成分,而关于X1、X2、X10三个共有峰所代表的成分并不清楚,而且本研究结果也发现相同及不同地黄品种菊花心与非菊花心的乙酸乙酯部位中的化学成分含量与抗氧化活性均存在明显差异,说明地黄品种及块根不同组织对地黄的抗氧化活性均有一定影响。后期可利用液相色谱-质谱联用技术对X1、X2、X10三个未知成分及其他成分进行指认,并对其含量进行分析,为地黄抗氧化药效物质的确定、地黄不同品种抗氧化活性的评价及块根菊花心特征与地黄道地性的揭示提供依据。

