集束化用药管理干预联合免疫检查点抑制剂用于转移性结肠癌的疗效观察Δ
王 艳,赵 磊,骆金铠
(1.首都医科大学附属友谊医院肿瘤中心,北京 100050; 2.首都医科大学附属友谊医院护理部,北京 100050)
结肠癌是发病率居第3位的消化道恶性肿瘤,其发病率高,但可用的治疗药物有限;靶向药物仅有贝伐单抗和西妥昔单抗,有效的化疗药种类亦有限[1]。免疫检查点是免疫抑制性共刺激分子,其中程序性死亡受体1(programmed cell death protein 1,PD-1)表达于T细胞上,在T细胞免疫中与肿瘤细胞表面表达的PD-L1结合,抑制T细胞免疫,从而促进了肿瘤的免疫逃逸[2-4]。纳武单抗为PD-1抑制剂,已在我国获批上市,可用于转移性结肠癌的治疗;但治疗前需检测微卫星不稳定(microsatellite instability,MSI),若存在高度MSI(MSI-high,MSI-H),可使用纳武单抗[3]。既往研究结果表明,纳武单抗联合化疗药可以进一步提高治疗的有效率,其可能的机制是化疗致使肿瘤细胞死亡,释放更多抗原,促进免疫反应[5-7]。良好的用药管理可以提高治疗效果,减少不良反应的发生。本研究对应用纳武单抗联合化疗治疗的转移性结肠癌患者进行分析,评价集束化用药管理在其应用中的优势。
1 资料与方法
1.1 资料来源
纳入2017年8月至2018年8月于首都医科大学附属友谊医院肿瘤中心使用纳武单抗联合FORFOX方案(奥沙利铂+亚叶酸钙+氟尿嘧啶)或FORFILI方案(伊立替康+亚叶酸钙+氟尿嘧啶)治疗的68例转移性结肠癌患者,年龄45~64岁,平均(55.0±9.5)岁。临床纳入标准:经病理确诊为结肠恶性肿瘤,影像学检查提示有远处转移病灶并可测量,病灶无手术治疗机会;经检测存在MSI-H;一线或二线治疗选择纳武单抗联合FORFOX方案或FORFILI方案。排除标准:合并其他原发肿瘤者;经过外科切除无可测量病灶者;存在纳武单抗联合FORFOX方案或FORFILI治疗禁忌证者。采用随机分组方法分为观察组和对照组,每组34例。观察组患者中,男性16例(占47.06%),女性18例(占52.94%);年龄45~63岁,平均(54.11±1.22)岁。对照组患者中,男性17例(占50.00%),女性17例(占50.00%);年龄46~64岁,平均(56.14±1.26)岁。两组患者一般资料相似,具有可比性。
1.2 方法
1.2.1 治疗方案:本研究入组患者均接受纳武单抗联合FORFOX方案或FORFILI方案化疗,纳武单抗剂量为3 mg/kg,奥沙利铂为100 mg/m2,伊立替康为100 mg/m2,亚叶酸钙为400 mg/m2,氟尿嘧啶为400和3 000 mg/m2,每个疗程用药1 d,用药顺序为纳武单抗/伊立替康→奥沙利铂→亚叶酸钙→氟尿嘧啶,每14 d重复1次。纳武单抗药液配好后,由于其为外源性蛋白,为观察是否存在过敏反应,输注的前5~10 min缓慢滴注,后在第1组30 min内静脉滴注完毕;奥沙利铂或伊立替康药液配制完后,输注前30 min予以激素静脉注射以预防过敏反应,于第2组避光输注2 h;亚叶酸钙药液配制完后,第3组静脉滴注2 h;第4组,氟尿嘧啶400 mg/m2+0.9%氯化钠注射液100 ml,静脉滴注,形成血药浓度峰度,由于氟尿嘧啶半衰期短,静脉滴注后继续予以3 000 mg/m2氟尿嘧啶,以5 ml/h持续微量静脉泵入,以维持有效血药浓度。化疗过程中定期复查尿常规、血常规、心电图、甲状腺功能及血生化,每3个疗程后评价用药效果。若患者出现不能耐受治疗的不良反应或病情进展,则停止用药。治疗结束后,对患者随访4个月。
1.2.2 管理方案:(1)观察组采用集束化管理+基础护理。①根据药物特性、溶解度存储和配置药物,根据药动学特性设置输注时间。其中,纳武单抗贮存条件为避光2~8 ℃,输注时间需>60 min。②预防过敏反应。纳武单抗为外源性蛋白,患者使用过程可能出现过敏反应,但由于其治疗机制为增强机体免疫功能,若使用激素预防性抗过敏,可减弱药物作用,故纳武单抗使用前不使用激素预防过敏,可使用苯海拉明预防过敏[8],输注纳武单抗前几分钟,观察过敏反应是护理的重点;并且,用药前详细询问患者过敏史及用药史。③预防胃肠道反应。用药前后,予以止吐处理,对饮食结构进行指导,嘱患者少食多餐,清淡饮食,有助于减轻胃肠道不适;若出现腹泻等胃肠道反应,应及时处理,注意预防电解质紊乱。④预防骨髓抑制。向患者进行宣教;化疗间期,每周2次监测血常规,避免出现红细胞计数、白细胞计数和血小板计数均降低,预防发热性中性粒细胞减少症、贫血及出血;化疗期间,患者白细胞计数较低,免疫功能较差,嘱其尽量少去人群密集的地方,有助于降低感染风险。⑤预防自身免疫损伤。治疗前及治疗期间,动态监测甲状腺功能、肝肾功能、心功能、心电图及血气分析等检查,监测生命体征,警惕免疫治疗引起的自身免疫相关甲状腺炎、肝炎、心肌炎及肺炎等并发症;向患者宣教,若治疗期间出现新发症状,应及时就诊。⑥治疗期间做好心理护理。护理人员进行心理知识培训,掌握化疗前患者出现的负性情绪疏导方法并具体实施,同时对患者提出的问题做出解答。(2)对照组根据治疗流程给予患者免疫+化疗管理方案,治疗期间,严密监测患者生命体征变化,根据患者化疗前后出现的不良状况及时处理,同时按流程做好标准的基础护理工作。
1.3 疗效评定标准
治疗每3个周期进行复查评估,根据实体瘤疗效评价标准RECIST 1.1进行疗效评价。完全缓解:所有目标病灶消失,任何病理性淋巴结(无论是否为目标病灶)的短轴值<10 mm;部分缓解:以临界半径的总和为参照,所有目标病灶半径的总和至少减小30%;稳定:以所研究(目标病灶半径)的总和最小值为参照,既达不到缓减标准、也达不到恶化标准者;进展:以所研究(目标病灶半径)的总和最小值为参照(包括最小值等于临界值的情况),所有目标病灶半径的总和至少增加20%,半径总和增加的绝对值必须>5 mm,或出现新的病灶。客观缓解率=(完全缓解病例数+部分缓解病例数)/总病例数×100%;疾病控制率=(完全缓解病例数+部分缓解病例数+稳定病例数)/总病例数×100%。
1.4 不良反应判断指标
1.4.1 胃肠道不良反应:根据相关的化疗诱发恶心呕吐和(或)腹泻等胃肠道反应分级法进行评价,每日呕吐次数为0次判定为无呕吐,每日呕吐和(或)腹泻1~4次判定为轻度胃肠道反应,每日呕吐和(或)腹泻5~9次判定为中度胃肠道反应,每日呕吐和(或)腹泻≥10次判定为重度胃肠道反应。
1.4.2 骨髓抑制以及自身免疫相关不良反应:化疗间期,每周复查2次血常规,将骨髓抑制程度分为4度,见表1。根据治疗期间出现自身免疫相关肺炎、甲状腺炎、肝炎及心肌炎等并发症患者数统计自身免疫相关不良反应发生率。

表1 骨髓抑制分度Tab 1 Grade of myelosuppression
1.5 护理满意度评价
采用模拟评分法评价护理质量,包括护士健康教育、服务态度、护理问题发现与解决、症状控制与并发症预防以及环境管理。2分为非常不满意,4分为不满意,6分为一般,8分为满意,10分为非常满意。
1.6 统计学方法
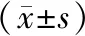
2 结果
2.1 两组患者临床疗效比较
两组患者均可耐受上述治疗方案,顺利完成8~12个疗程的治疗。观察组患者的客观缓解率高于对照组,但差异无统计学意义(χ2=0.856,P=0.35);观察组患者的疾病控制率明显高于对照组,差异有统计学意义(χ2=5.397,P=0.02),见表2。

表2 两组患者临床疗效比较[例(%)]Tab 2 Comparison of clinical efficacy between two groups[cases(%)]
2.2 两组患者不良反应发生率比较
2.2.1 胃肠道不良反应发生率:观察组患者胃肠道不良反应发生率低于对照组,但差异无统计学意义(χ2=0.545,P=0.76),见表3。

表3 两组患者胃肠道反应发生情况比较[例(%)]Tab 3 Comparison of incidences of gastrointestinal reaction between two groups[cases(%)]
2.2.2 骨髓抑制不良反应发生率:观察组患者骨髓抑制不良反应发生率低于对照组,但差异无统计学意义(χ2=1.466,P=0.83),见表4。

表4 两组患者骨髓抑制发生情况比较[例(%)]Tab 4 Comparison of incidences of myelosuppression between two groups[cases(%)]
2.2.3 自身免疫相关不良反应发生率:观察组自身免疫相关不良反应发生率为0%(0/34),低于对照组的5.88%(2/34),但差异无统计学意义(χ2=2.061,P=0.15)。
2.3 两组患者护理满意度比较
与对照组比较,观察组患者的护理满意度全面提高,对服务态度、问题发现与解决、健康教育、症状控制与并发症预防以及环境管理等方面的满意度均明显高于对照组,差异均有统计学意义(P<0.05),见表5。
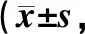
表5 两组患者护理满意度比较分)Tab 5 Comparison of nursing satisfaction between
3 讨论
目前,肿瘤的治疗方法包括手术切除、化疗、放疗、肿瘤靶向药物、免疫治疗及肿瘤疫苗等,传统肿瘤治疗的效果已经显示出“天花板效应”。免疫治疗是肿瘤治疗的热点,也是目前临床治疗的方向。肿瘤免疫治疗是通过主动或被动方式激活机体免疫系统,产生机体肿瘤特异性免疫应答,充分发挥其抑制和杀伤肿瘤功能。肿瘤免疫治疗主要包括免疫检测点阻断、过继性细胞输注和肿瘤疫苗等[9-10]。肿瘤免疫治疗有着特异、高效并使机体免于伤害性治疗等优点,随着肿瘤免疫学理论的深入研究和相关技术的不断进步,肿瘤免疫治疗有望实现根治肿瘤的新突破,成为肿瘤治疗的主流方法,并覆盖大部分肿瘤种类,逐步成为抗肿瘤常规治疗。为进一步配合肿瘤免疫治疗,可采用集束化用药管理,增强疗效。集束化干预是指一组干预措施,1个集束应该包含3~6个元素,每个元素都应该是具体的、可操作的并被广泛认可的,其共同实施比单独执行更能提高患者结局,但在临床中却没有被完全贯彻执行[11]。为了提高实施的完整性,这些措施可被捆绑成1个集束,并在相关时间、同一环境内被实施[12]。其中,整体集束或每项措施的完成应有非常具体的标准,可以明确地用“是”或“否”回答达标情况。同时,这些措施的实施过程应具有明确的时间性、目标性和序贯性,时间点的确定应根据集束内容及目的而异[13]。
本研究结果显示,在纳武单抗联合FORFOX方案或FORFILI方案治疗过程中,集束化用药管理可以提高治疗效果、用药安全性,同时提高患者对护理的满意度。集束化用药管理的要点包括:严格按规范配置药液,根据药动学调整药液输注时间和速度[14-16];用药前予以抗过敏处理,密切观察患者的生命体征;用药前后积极处理胃肠道反应,预防电解质紊乱,同时做好基础护理;监测血常规,预防骨髓抑制;监测肝肾功能、甲状腺功能及心功能等,预防自身免疫疾病。其中,护士用药前及用药过程中进行宣教,为患者及家属提供心理支持,也是整个集束化用药管理中重要的一环。
总之,化疗联合免疫治疗是未来肿瘤治疗的趋势,集束化用药管理是在原有化疗管理工作基础上,重点关注免疫治疗的相关使用特点,关注其特有的自身免疫相关不良反应,以取得最好的抗肿瘤疗效。

