肝动脉栓塞化疗及射频消融治疗肝细胞癌的疗效及肝储备功能观察
杨怀龙
射频消融(RFA)是治疗肝细胞癌的重要手段,已有研究证实这种方式在肝癌治疗中有效,能使患者生存期延长[1]。然而,也有研究发现单一治疗方式效果欠佳,复发率高,临床仍需寻求更好的综合治疗方法[2]。近年来,有研究提出肝动脉栓塞化疗(TACE)能使肿瘤血供减少,下调RFA治疗过程中的热量丢失量,增强疗效[3]。本研究针对肝细胞癌患者采用TACE联合RFA的方案治疗,分析该方案对患者疗效及肝储备功能的影响,现报道如下。
资料与方法
一、一般资料
纳入我院2013年10月—2016年10月收治的肝细胞癌患者124例,根据随机数字表法分成对照组、观察组各62例。对照组男34例,女28例,年龄30~75岁,平均(51.38±14.64)岁;Child-Pugh肝功能分级:A级13例、B级49例;肿瘤直径2~8 cm,平均(4.52±2.13)cm;临床分期:Ⅱ期25例、Ⅲ期37例。观察组男36例,女26例,年龄33~78岁,平均(53.61±13.99)岁;Child-Pugh肝功能分级:A级15例、B级47例;肿瘤直径2~8 cm,平均(4.48±2.17)cm;临床分期:Ⅱ期28例、Ⅲ期34例。研究方案经本院伦理委员会通过,两组基线资料比较无统计学意义(P>0.05)。
二、纳入与排除标准
(一)纳入标准 ①经病理穿刺证实为肝细胞癌,临床诊断明确;②入院前无根治性手术或其他相关治疗史;③无RFA、TACE禁忌;④Child-Pugh分级为A级、B级;⑤病例资料齐全;⑥知情同意。
(二)排除标准 ①非肝细胞癌;②肿瘤数目≥3个;③出现肝外脏器、淋巴结转移;④合并腹水、肝性脑病等并发症。
三、治疗方法
①对照组单纯给予RFA治疗:术前行常规检查,包括胸片、电解质、凝血功能、肝功能、血常规、肾功能、心电图等。实施局麻,经超声引导对病灶进行穿刺,将消融治疗仪(Celon ENT System)连接,功率为40~80 w,多点消融,当阻抗增高至HIGH时,停止治疗。经彩超对肿瘤血流信号进行观察,若未见血流信号,则将子针收回,经烧灼模式将穿刺针拔除,给予加压止血。
②观察组采用TACE联合RFA治疗:首先行TACE治疗,术前6 h、2 h禁食、禁水。选取仰卧位,常规铺巾、消毒,行局部麻醉。经seldinger技术对右股动脉进行穿刺,待穿刺成功后,将5 F RH导管插入肝动脉,将5 F导管鞘插入腹腔干动脉行造影。若仍无法明确肿瘤血供情况,则行膈动脉或肠系膜动脉造影。按照肿瘤血供、病灶大小等具体病情给药,取5~20 mL碘化油(国药准字H37022398,烟台鲁银药业)+20~40 mg吡柔比星(国药准字H10930105,深圳万乐药业)+60~100 mg顺铂(国药准字H20040813,江苏豪森药业),制作为混悬液,经靶动脉灌注。待碘油彻底沉积,则用明胶海绵条加强栓塞。当未见实质期肿瘤染色,或大部分染色消失时,则将导管撤除,加压止血。于术后1周进行肝功能、肾功能等复查,术后第2周行RFA治疗,方法同上。
③术后处理:两组术后均卧床,常规给予保肝、抗生素、胃黏膜保护剂等治疗,密切监测生命体征,观察穿刺处是否出现血肿、颜色改变等症状,若发现上述症状,及时给予对症处理。
四、观察指标
①临床疗效:患者治疗后6个月入院复查,参考《肝癌局部消融治疗规范的专家共识》[4]评估疗效。完全缓解:瘤体彻底消失;部分缓解:瘤体较治疗前缩小≥50%;稳定:瘤体较治疗前缩小30%~49%;进展:瘤体较治疗前缩小不足30%,或增加20%,有新病灶形成。总缓解率(完全缓解+部分缓解)/总例数100%。②肝功能检测:分别于治疗前、治疗后6个月采集3 mL血样,离心30 min,转速为3 000 r/min,分离血清。经全自动生化分析仪(CS-600B,迪瑞医疗)测定血清谷丙转氨酶(ALT)、总胆红素(TBil)、天冬氨酸氨基转移酶(AST)、前白蛋白(PA)、白蛋白(Alb)水平。③肝储备能力检测:受检前至少保持6 h空腹,经灭菌注射水将吲哚菁绿稀释为5 mg/mL,经肘静脉推注(0.5 mg/kg),行ICG排泄试验,记录吲哚菁绿试验15 min留滞率(ICGR-15)。经超声波仪(DW-T6 江苏大为医疗)测定肝脏硬度。④:电话随访24个月,记录该期间的生存率。
五、统计学方法

结 果
一、两组临床疗效比较
观察组(69.35%)总缓解率高于对照组(51.61%),组间比较有显著差异(P<0.05),见表1。
二、两组治疗前、后肝功能指标比较
在治疗前,两组各指标比较未见显著差异(P>0.05),在治疗后,两组ALT、TBil、AST低于治疗前,PA、Alb高于治疗前,且观察组ALT、TBil、AST显著低于对照组,PA、Alb显著高于对照组(P<0.05),见表2。
三、两组肝储备能力比较
在治疗前,两组各指标比较未见明显差异(P>0.05),在治疗后,两组各指标较治疗前显著下降,且观察组显著低于对照组(P<0.05),见表3。
四、两组12、24个月的生存率比较
两组随访12个月的生存率比较无显著差异(P>0.05),观察组随访24个月的生存率显著高于对照组(P<0.05),见表4。

表1 两组临床疗效比较[n(%)]
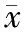
表2 两组治疗前、后肝功能指标比较(±s)
注:与治疗前比较,△P<0.05。
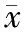
表3 两组肝储备能力比较(±s)
注:与治疗前比较,△P<0.05。

表4 两组12、24个月的生存率比较[n(%)]
讨 论
本研究发现观察组治疗后的总缓解率较对照组明显提升,且各肝功能指标改善效果优于对照组,提示TACE联合RFA能取得更显著的效果。TACE在有手术禁忌或不愿接受手术治疗的肝癌病例中非常适用,在肝肾功能可承受的情况下,患者便可接受该治疗方式。它需将化疗药物、碘化油制为乳剂,经导管技术注于供瘤动脉中,将肿瘤血供途径阻断,从而杀灭肿瘤细胞,对其生长进行抑制[5]。RFA在骨肿瘤、肺肿瘤等多种恶性肿瘤中适用,它需要在CT或超声引导下进行,按照肿瘤大小明确消融针位点、针数,达到肿瘤消融的目的[6]。研究表明单纯采用TACE治疗,仅能将肿瘤大部分血供阻断,难以完全阻断,治疗存在局限[7]。另有研究提示单用RFA治疗,部分患者效果不够理想[8]。在本研究中,观察组首先给予TACE治疗,可先阻断肿瘤的大部分血供,促进其坏死,然后采用RFA治疗,能进一步促进肿瘤吸收、坏死,缩小瘤体,从而改善肝功能,提高临床疗效。
肝损害可导致肝脏弹性发生变化,而肝脏弹性与肝病进展存在密切关联[9]。ICG排泄试验是评价肝储备功能的重要手段,研究表明肝病患者ICGR15不超过10%时,肝储备能力处于正常状态,一旦超过10%,则往往表现为肝储备能力不足[10]。本研究通过观察两组术后肝储备能力,发现观察组治疗后肝脏硬度、ICGR-15均低于对照组,提示TACE联合RFA治疗能改善患者的肝储备能力。其机制可能在于首先通过TACE促进瘤体坏死,然后利用RFA使局部温度增高,待温度为42~50℃间时,可促进细胞膜崩解,促使蛋白质性质发生变化,达60℃便可促使组织碳化,对新生血管形成有抑制作用,从而改善肝储备功能。
笔者随访24个月,发现两组治疗后12个月的生存率比较未见显著差异,这可能是因随访时间较短,未体现出差异性。然而,观察组治疗后24个月的生存率高于对照组,表明TACE联合RFA能通过改善患者的肝功能与肝储备能力,提高中期生存率。值得注意的是,在RFA治疗过程中,需适度扩大消融范围,约扩至肿瘤区域外0.5 cm,便于彻底消融肿瘤,降低复发、转移风险。
综上,与单用RFA治疗相比,采用TACE联合RFA治疗,能进一步改善患者的肝功能,提高肝储备能力,从而提升临床疗效,提高中期生存率,改善预后。此外,本研究也有不足,如纳入样本量少,随访时间短,未分析远期生存情况。笔者未来将增加病例数,延长随访时间,分析该方案对远期疗效的影响。

