微泡介导超声空化联合自然杀伤细胞对兔肝VX2肿瘤热消融的增效作用
韩 璐,郭 凯,郑 瑜,赵 洁,王晓武,郑 静,刘红岗
(1.西安市中心医院超声诊断科,西安 710003;2.陕西省人民医院胸外科,西安 710068;3.空军军医大学唐都医院胸腔外科,西安 710038;4.空军军医大学西京医院心脏外科,西安 710032)
近年来,超声引导热消融技术在肝肿瘤的治疗中取得了良好的效果。它使肿瘤组织通过热效应产生凝固性坏死[1]。但由于非均匀温场的出现,使局部治疗温度降低,造成局部肿瘤细胞存活[2]。残留肿瘤细胞可在肿瘤内新生血管及炎性微环境的共同支持下重新增殖,成为热消融术后肝肿瘤复发的一个重要原因。因此,抑制热消融术后肿瘤炎性微环境及阻断肿瘤新生血管,对减少术后肿瘤细胞残余,降低肿瘤复发具有重要意义。
肿瘤组织的新生血管具有管壁薄弱等特点,对微泡介导的超声空化效应尤为敏感。空化效应不仅可以阻断微血管血供,而且可以减少肿瘤血管对热消融造成的“热沉降效应”[3]。与此同时,NK细胞在抑制肿瘤炎性微环境中发挥着积极作用,同时可诱导肿瘤细胞的凋亡。而在原发性肝癌的发生、发展过程中普遍存在NK 细胞数量减低、功能缺陷,亚型变化等改变[4-5]。因此,本研究建立兔肝VX2肿瘤模型,旨在通过微波热消融、微泡介导超声空化联合NK细胞,提高热效应的同时,抑制肿瘤炎性微环境,达到减少肿瘤残余的目的。
1 材料和方法
1.1 实验动物
普通级2~4月龄健康的新西兰大白兔40只,普通级3月龄VX2肿瘤的荷瘤兔1只(肿瘤已种植于兔腿部),均购自空军军医大学实验动物中心[SCXK (军)2017-0022],体重1.5~2.5 kg,雄性。实验兔饲养于空军军医大学验动物中心普通环境[SYXK (陕)2017-0043],温度为20℃~25℃,相对湿度为60%~70%。本实验经过西安交通大学附属市中心医院医学伦理委员会的批准,批准号为2019XAKY-013。并根据3R原则对实验动物的使用和饲养给予人道关怀。将实验兔随机分为:微波热辐照消融组(MW),超声空化辐照组(CA),NK细胞注射组(NK),微波消融联合超声空化及NK细胞注射组(MW+CA+NK)和无辐照无注射空白对照组(BL),每组8只。
1.2 主要试剂与仪器
CZ-960 A型高声压超声无创治疗仪(四川绵阳索尼克电子有限责任公司),治疗探头频率831KH,平均声强1.5 W/cm2,峰值负压4.6 MPa,占空比0.22%,采取交替治疗模式:工作6 s、间歇6 s。微波治疗仪ECO-100C(南京亿高微波系统工程有限公司),工作频率为2430~2470 MHz,输出功率0~150 W可调节,采用A型治疗针头,针头长度为3 mm。超声成像仪器采用Mylab90(ESAOTE, Italy),L522探头,频率5~12 MHz。
超声造影剂采用SonVue(Bracco, Italy)微泡平均直径为2.5 μm。T75、T175细胞培养瓶,离心管,巴氏滴管及CO2细胞培养箱、离心机均为美国赛默飞公司产品;倒置显微镜及Cell Counter model R1自动细胞计数仪均为日本Olympus 公司产品;兔原代NK细胞、原代NK细胞基础培养基及原代NK细胞培养添加剂均购自上海通蔚生物科技有限公司。胎牛血清(FBS)购自美国Gibco公司,青霉素/链霉素购自美国Hyclone公司。
戊巴比妥钠(长春军需畜牧研究所),注射用青霉素钾(山东鲁抗医药股份有限公司),吸收性明胶海绵(金陵药业股份有限公司南京金陵制药厂)。
1.3 实验方法
1.3.1 兔VX2肝肿瘤模型建立
在超声引导下,将2~3块3~5 mm3来自荷瘤兔的VX2肿瘤组织通过16G穿刺针种入兔肝内[6]。采用二维超声于14 d后进行检测,兔肝内出现类圆形稍低回声区,为种植成功。
1.3.2 NK细胞扩增培养及细胞计数
兔原代NK细胞使用含10%胎牛血清,NK细胞培养添加剂及青霉素/链霉素双抗的完全培养基,常规培养于37℃,5% CO2细胞培养箱。培养过程中每天对NK 细胞观察,当细胞密度在80%~90%时进行传代,传代次数不超过5代。将细胞培养产物1000 r/min离心5 min去上清并用PBS重悬,使用Cell Counter model R1自动细胞计数,调整终浓度为2.5×106个/mL。
1.3.3 各组动物VX2肿瘤干预方法
将荷瘤兔经耳缘静脉注射3%戊巴比妥钠(1 mL/kg)麻醉固定后:MW 组:超声引导下将微波针穿刺入肿瘤内实质区,治疗功率30 W,采取治疗1 min,间歇1 min,同时使用超声治疗探头无空化辐照治疗10 min;CA组:经兔耳缘持续泵入8 mL,SonVue 0.8 ml/min,同时使用超声治疗探头进行空化辐照治疗10 min(Flash模式,功率100%);NK组:经兔耳缘持续泵入8 mL,NK细胞悬液 0.8 mL/min,同时使用超声治疗探头无空化辐照治疗10 min;MW+CA+NK组:超声引导下将微波针穿刺入肿瘤实质区,治疗功率30 W,采取治疗1 min,间歇1 min;经兔耳缘持续泵入8 mL,SonVue 0.8 ml/min,同时使用超声治疗探头进行空化辐照治疗10 min(Flash模式,功率100%);生理盐水冲管后,经兔耳缘持续泵入8 mL,NK细胞 0.8 mL/min,同时使用超声治疗探头假空化辐照治疗10 min。空白组:不予任何处理。各实验组治疗后均肌注青霉素2 mL。分别于术后10 d处死动物。
1.3.4 疗效评价
(1)二维灰阶超声:治疗前后,观察肿瘤形态、位置,分别测量左右径、上下径、前后径,计算肿瘤体积=π/6×左右径×上下径×前后径。
(2)彩色多普勒血流成像(Color Doppler Flow Imaging, CDFI)和超声造影(Contrast Enhanced Ultrasonography, CEUS):治疗前后,采用CDFI评价肿瘤内部血流分布,分级:0级:未见明显血流信号;I级:可见点状血流信号;II级:短棒状血流信号;III级:环状血流信号。CEUS成像:选取肿瘤最大切面,固定探头,经兔耳缘静脉以团注法注射SonVue(0.2 mL/kg),随之注射2 mL生理盐水冲管,同时储存动态造影图像。采用CEUS评价治疗前后各组肿瘤内血流分布,分级:0级:无血流灌注;I级:内部点状血流灌注;II级:内部条状血流灌注;III级:内部片状血流灌注。观察各组术后造影图像,截取肿瘤最大平面,测量肿瘤最大径。
1.4 统计学方法

2 结果
2.1 兔肝VX2肿瘤生长变化
2.1.1 二维灰阶超声观察结果
术前,兔VX2肝癌表现为低回声结节(图2 A)。术前各组肿瘤体积无明显统计学差异(P>0.05),10 d后MW+CA+NK组与其他组相比较,肿瘤体积明显缩小(P<0.05,图1A)。MW组、NK组术后肿瘤体积均小于BL组(P<0.05,图1A)。CA组与BL组术后体积无统计学差异(P>0.05)。
2.1.2 CEUS测量结果
各组术前最大径分别为MW+CA+NK组(1.29±0.34)cm,MW组(1.41±0.54)cm;NK组(1.54±0.38)cm,CA 组(1.55±0.33)cm,BL组(1.31±0.25)cm。术前各组最大径无统计学差异(P>0.05);术后最大径分别为MW+CA+NK组(1.35±0.41)cm,MW组(2.49±0.36)cm,NK 组(2.53±0.76)cm,CA组(2.63±0.58)cm,BL组(2.84±0.56)cm。MW+CA+NK组术后最大径小于其他各组(P<0.05,图1B)。
2.2 CDFI评价治疗后肿瘤血流
兔肝VX2肿瘤治疗超声图像如图2所示。采用CDFI观测治疗前各组肿瘤血流灌注,均可见丰富的血流信号(图2C),治疗前CDFI评估各组肿瘤血流灌注差异无统计学意义(P>0.05)。治疗后,MW+CA+NK组6例肿瘤治疗区未见明显彩色血流信号,2例肿瘤在治疗区边缘发现点状残存血流(图2D);经统计分析可见MW+CA+NK组术后血流明显减低,具有显著统计学意义(P<0.05,表1)。
2.3 CEUS评价治疗后肿瘤血流灌注
治疗前CEUS示各组兔肝肿瘤,血流信号丰富,成高灌注状态,并且表现为肝肿瘤典型的“快进快出”征象。治疗前CEUS评估5组肿瘤血流灌注无统计学差异(P>0.05)。治疗后,各组造影所示血流灌注分布(表1,图3),经统计分析可见MW+CA+NK组术后血流明显减低,具有显著统计学意义(P<0.05)。

注:A:肿瘤体积;B:肿瘤最大径。
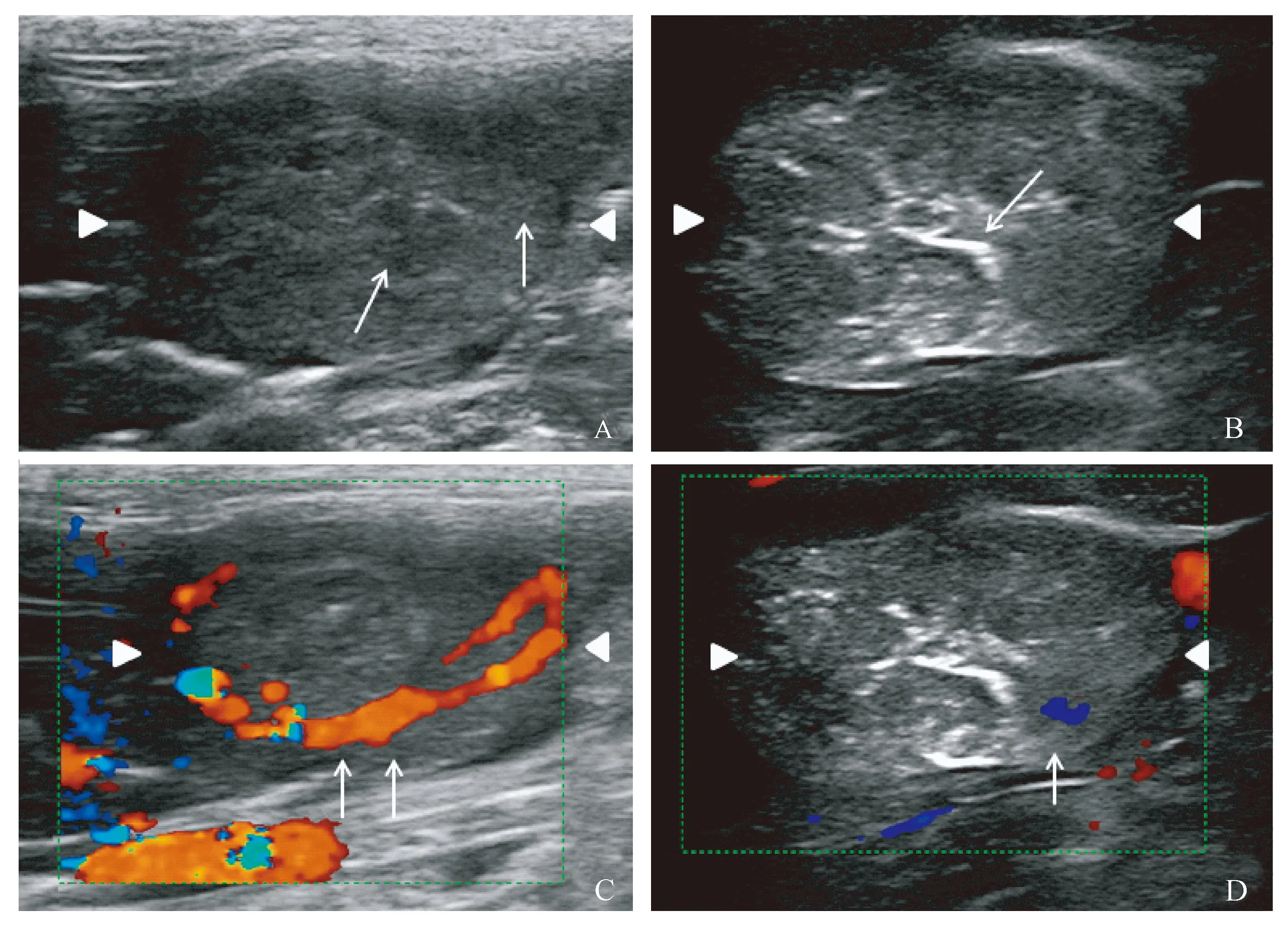
注:A:治疗前,灰阶超声示肿瘤呈不均质低回声(箭头);B:治疗后,灰阶超声示消融区内片状分布粗大点状强回声(箭头);C:治疗前,CDFI示肿瘤内环状血流信号(箭头);D:治疗后,CDFI示消融区内血流信号消失,边缘可见残留点状血流信号(箭头)。

注:A:MW+CA+NK组治疗区域无明显血流灌注;B:MW组治疗区域周边可见少许“点状”血流灌注(箭头);C:NK组治疗区域可见肿瘤中心部位有“条状”血流灌注(箭头);D:BL组治疗区域可见肿瘤内部位有“片状”血流灌注(箭头)。
表1CDFI及CEUS观察各组治疗后VX2肝肿瘤内血流分布特征
Table1Distribution of blood flow in VX2 liver tumors after treatment as assessed by CDFI and CEUS

组别GroupsCDFICEUS0级Grade 0I级Grade III级Grade IIIII级Grade III0级Grade 0I级Grade III级Grade IIIII级Grade IIIMW+CA+NK62007100MW∗01430152NK∗01250035CA∗00440053BL∗00170008
注:结果以肿瘤个数表示。与同一时间段MW+CA+NK组相比,*P<0.05。
Note.Results are expressed as the number of tumors.Compared with the MW+CA+NK group in the same time period,*P<0.05.
3 讨论
目前超声引导下热消融治疗已被临床广泛认可,但受肿瘤大小、位置等因素影响,常导致消融不彻底、肿瘤易复发等不良后果。残留肿瘤细胞必须在其赖以生存的“土壤”-肿瘤微环境支持下生长发展。其中,由炎性细胞和促炎因子网络组成的炎性微环境发挥着重要作用。肿瘤微环境是一个由多种异形细胞相互作用而形成的复杂综合系统,对肿瘤发生发展起到了诱导,转化,支持和促进作用。巨噬细胞广泛参与机体炎症反应,与炎性微环境和肿瘤发生发展都有密切关系,通过分泌表皮生长因子(epidermal growth factor,EGF)、血小板衍生因子和TGF-β等细胞因子促进肿瘤细胞增殖和存活,并能提供促血管生成微环境[7]。Granot 研究证实[8]:肿瘤微环境活化的NK 细胞能刺激巨噬细胞的MHC-Ⅱ(major histocompatibility complex classⅡ)表达,促使肿瘤相关巨噬细胞M2 型向M1 型转化,增加抗肿瘤相关巨噬细胞M1 型的数量。同时,活化的NK 细胞分泌IFN-γ(inerferon-γ),IFN-γ进一步诱导巨噬细胞MHC-Ⅱ表达,逆转肿瘤微环境的免疫抑制情况[9-10]。在原发性肝癌疾病中NK细胞的数量减少,亚型也发生变化,提示NK 细胞的功能缺陷与肝癌的进展密切相关[11-12]。超声造影剂进入血液后在超声脉冲作用下可成为有效的空化核,诱导超声空化,引起邻近细胞及组织的损伤,同时微泡爆破能够使局部毛细血管和细胞膜通透性增高[13]。本研究通过建立兔VX2肝肿瘤模型,微波消融肝肿瘤同时通过超声靶向辐照微泡爆破增加血管内皮系统通透性,并阻断肿瘤组织的新生血管[14]。将NK细胞输送至肝,提高肝组织局部NK细胞数量,改善NK细胞亚型的比例失衡;并采用局部超声空化,使NK细胞能够更快进入癌巢中心,通过调节肝内炎性微环境,逆转肿瘤微环境的免疫抑制,最终减少消融后残留。国内研究发现,微波消融可增强原发性肝癌患者的细胞免疫功能,促使患者外周血NK细胞,IFN-γ、TNF-α等水平较治疗前显著提高[15]。黄庆生等提出NK 细胞在抗病毒、抗肿瘤上扮演着重要的角色,因其作用不需初次免疫活化,因而在过继免疫治疗(adoptive cellular immunotherapy,ACI)上有其独特的应用前景。但由于不能获得数量大、纯度高的NK细胞,使NK细胞在免疫治疗中的应用受到了限制[16-17]。本研究结果发现治疗后NK组体积较BL组减小1.9倍,CA组体积较BL组减小1.3倍,MW+CA+NK组体积较BL组明显减小7.2倍。说明通过ACI疗法增加NK细胞数量及纯度可抑制肿瘤增长;而单纯的微泡介导的空化效应可以阻断肿瘤新生血管,局部形成微血栓等功效限制肿瘤的生长;而将微波消融联合微泡介导的空化效,同时给予NK细胞ACI治疗后,达到了热效应、生物效应与免疫效应多重治疗方法联合作用于肝肿瘤,发挥各自优势,有效抑制肿瘤生长。
本研究采用CEUS测量的肿瘤最大径与灰阶超声测量肿瘤体积结果相同,MW+CA+NK组体积及最大径较其他各组减低。超声造影剂走形于血管腔内,不进入组织细胞间隙[18-19],可对坏死组织与正常组织明显分界,使结果更为精确,两种评估模式均证实MW+CA+NK组可有效抑制肿瘤生长。
通过CEUS评价治疗后各组血流灌注结果,可见MW+CA+NK组较各实验组血流明显减低。其余各组在治疗后均出现了3例以上的“条状”、“片状”血流灌注;MW+CA+NK组在治疗后仅出现1例“点状”血流灌注,其余7例均无明显血流灌注。说明MW+CA+NK组可有效减少了肿瘤的残余。在显示血流灌注方面,CDFI和CEUS均可显示残余肿瘤内部的血流状况,但热消融治疗后存在气化现象,并且受肿瘤位置及血流速的影响,CDFI对检测术后残余肿瘤组织的血流灌注敏感性较低[20]。CEUS对血流灌注较为敏感,可显示热消融治疗后残余肿瘤组织中血流灌注程度及位置,因此CEUS对于术后评估残余肿瘤更为准确。
综上所述,本研究建立兔肝VX2肿瘤模型,采用微波消融、微泡介导超声空化联合NK细胞的治疗方式,有效抑制兔VX2肿瘤生长,减少肿瘤残余。并对肿瘤生长微环境实施干预,为减少热消融后肿瘤残留提供新策略,为提高热消融疗效寻找新思路。

