货架陈列期间光照处理对鲜切青椒品质的影响
张婷婷,时 月,和朝军,马 越,王宇滨,赵晓燕,张 超*
(1.北京市农林科学院蔬菜研究中心,北京 100097;2.洛阳师范学院食品与药品学院,河南 洛阳 471934;3.果蔬农产品保鲜与加工北京市重点实验室,北京 100097;4.农业农村部蔬菜产后处理重点实验室,北京 100097;5.农业农村部华北地区园艺作物生物学与种质创制重点实验室,北京 100097)
鲜切青椒是将新鲜青椒(Capsicum annuumL.)经过拣选、清洗、去籽、切分、消毒和包装等步骤生产的即食或即用类产品,目前多用于供应大型餐饮企业或大中型食堂的配餐[1]。随着人们生活习惯和饮食习惯的改变,普通家庭消费者做饭的时间越来越短,对新鲜食材的追求越来越高,鲜切蔬菜具有新鲜的突出特点,且省去了消费者清洗和切分的时间,将有望成为未来家庭配餐的主要原料[2-4]。
目前,鲜切青椒的零售方式主要是陈列于商场或超市的4 ℃冷藏柜中,陈列过程中采用白色日光灯管照明,一般货架期为3~5 d。但是,在冷藏柜陈列期间,鲜切青椒会出现失水萎蔫和水渍化损伤等现象[3,5-7]。光照处理是采用特定波长的光源对产品进行照射。目前,该领域的大部分研究集中于紫外光或荧光辐照,研究显示紫外光照射可以降低鲜切蔬菜中的菌落总数、褐变度,维持产品原有的新鲜品质[8-11];荧光照射可以延缓鲜切西兰花的衰老过程,使其内源葡萄糖含量显著上升,黄化指数显著下降[12]。但是,紫外光和荧光会对人体产生一定伤害[13],无法应用于销售期间的商品照明。可见光在这个方面具有明显的优势,而且已有的研究显示可见光光照处理对维持果蔬货架期期间的品质具有积极作用,包括在降低鲜切木瓜中微生物数量[14]、提高鲜切西兰花的品质[15]、降低果蔬的褐变和水渍化损伤[16]、维持豇豆的水分和可溶性固形物含量[17]等方面效果显著。因此,本研究以新鲜青椒为原料,在货架期期间使用红色、绿色和蓝色光代替现有的白色光进行照明,并设置避光处理进行对比,评价果实在货架期期间质量损失率、颜色和风味等品质特征的变化规律,以建立适用于鲜切青椒的冷藏柜陈列环境,为延长鲜切青椒货架期提供理论依据。
1 材料与方法
1.1 材料与试剂
青椒(Capsicum annuumL.)购自北京果香四溢水果超市。
磷酸二氢钾、磷酸氢二钾等化学试剂均为分析纯。
1.2 仪器与设备
商用陈列柜 北京二商福岛机电;红、绿、蓝、白T8分体型LED灯管(长度1.2 m、功率18 W) 中山市蓝鲨照明有限公司;TA.XT Plus质构分析仪 英国Stable Micro Systems公司;PEN3电子鼻 德国Airsense分析仪器有限公司;CM-3700台式分光测色仪、D500照度计 日本Konica Minolta公司;UV-1800紫外分光光度仪 日本岛津公司;EOS600D型数码相机 日本佳能公司;ME204分析天平 瑞士梅特勒-托利多仪器有限公司;HR1861手持式搅拌机 飞利浦(香港)电子有限公司;TES-1339R光通量计 中国台北德生电器有限公司;PAL-α糖度计 日本ATAGO有限公司。
1.3 方法
1.3.1 鲜切青椒的制备
将新鲜青椒进行分拣,去除破损和萎蔫的青椒,用流动自来水冲洗表面泥土。然后将青椒按照1∶5的料液比浸泡于100 mg/L pH 6.5的次氯酸钠溶液中2 min,使用青椒质量3 倍的纯水漂洗,使用离水机100 r/min离心5 min,然后手工去除青椒果柄和青椒籽,将青椒沿纵向切割成大约2 cm宽的青椒条,使用聚乙烯袋(30 cm×25 cm,厚10 μm,未打孔)进行包装,装载量为50 g/袋。上述生产过程在环境温度为10 ℃的洁净空间进行。
将包装好的鲜切青椒水平放置于4 ℃的双开门冷藏柜中,冷藏柜共有5 层,从上到下分别设置白色、红色、蓝色、绿色LED灯和无灯光(避光处理组),层与层之间放置隔板避免光污染,冷藏柜外面维持30 lx的基础照明。其中,避光处理组将包装好的样品进一步包裹于黑色塑料袋中。每12 h将样品翻面一次,在贮藏的第5天测定样品的性质。
将密封于安瓿瓶中叶绿素提取物按照上述光照处理在冷藏柜中放置24 h,每小时测定安瓿瓶中叶绿素含量。
1.3.2 叶绿素提取及其含量测定
随机取鲜切青椒样品50 g,用手持打浆机匀浆,准确称取0.5 g匀浆,于25 mL具塞比色管中,加入25 mL丙酮,取一张滤纸,折叠后置于漏斗中,用丙酮润湿,将提取液使用丙酮在50 mL棕色容量瓶定容,将定容后的溶液使用分光光度计分别于645 nm和663 nm波长处测定吸光度,以丙酮作空白对照实验,叶绿素含量计算参考公式(1)。

式中:V表示提取叶绿素所用丙酮的体积/mL;m表示鲜切青椒的质量/g。
1.3.3 光源特性测定
使用照度计对光源特性进行测定,将照度计探头置于聚乙烯包装袋内,与鲜切青椒样品贮藏环境保持一致时测定光源特性。光源的色度使用Yxy色空间表示,x和y是从三刺激值XYZ中计算出来的色度值,见计算公式(2)。光源色度的纯度为赫姆霍兹坐标中白点(x=0.333,y=0.333)和样品的距离除以白点和光谱点之间的距离。

式中:X、Y和Z分别为样品在CIE-RGB系统的中光谱三刺激值。
使用光通量计对光源强度进行测定,将光通量计探头置于聚乙烯包装袋内部,与样品贮藏环境保持一致时进行测定。
1.3.4 质量损失率、色泽和可溶性固形物质量分数的测定
样品质量损失率为样品贮藏前后的质量差与贮藏前质量之比。
每批次随机取样6 袋,从每袋中随机抽取青椒6 条测定颜色,颜色采用分光测色仪以SEC反射模式进行测定,每个青椒样品正反面共测6 次,取平均值。样品与新鲜样品的色差ΔE按式(3)计算。

每批次将6 袋均匀混合,随机称取200 g样品进行破碎、均质和离心,取上清液3~5 滴,用糖度计测定可溶性固形物质量分数。
1.3.5 水渍化损伤比例的测定
每批次随机取样6 袋,将所有样品均匀混合,使用Canon EOS600D数码相机拍照,保持所有照片的曝光参数一致,使用Image-Pro Plus软件处理照片。水渍化损伤位点用将RGB色系中绿色序号100~150的像素点(红色)标注。水渍化损伤比例为红色像素点的数量与果实像素点数量之比。
1.3.6 相对电导率的测定
每批次随机取样6 袋,将所有样品均匀混合,随机称取200 g样品进行破碎,将0.60 g破碎的样品置于三角瓶中,加150 mL蒸馏水搅拌均匀,并测定电导率(P0/(μS/cm)),放置20 min后测电导率(P1/(μS/cm)),然后煮沸10 min,冷却至室温,加水至原始刻度,静置10 min后,测其电导率(P2/(μS/cm)),重复3 次取平均值。相对电导率的计算见公式(4)。

1.3.7 丙二醛含量的测定
每批次随机取样6 袋,将所有样品均匀混合,随机称取200 g样品进行破碎,准确称取10 g破碎的样品与20 mL 50 mmol/L的磷酸缓冲液(pH 6.8)均匀混合,4 ℃、13 000 r/min离心20 min,取上清液。取1.5 mL上清液,加入2.5 mL 5 g/100 mL三氯乙酸溶液(含5 g/L硫代巴比妥酸),沸水浴15 min,冷却,过滤。取上清液分别在532 nm和600 nm波长处测吸光度。丙二醛(malondialdehyde,MDA)含量计算见公式(5)。

1.3.8 电子鼻测定鲜切青椒的风味变化
每批次随机取样6 袋,随机从6 袋样品中取样3 份,每份10 g左右,从每份中再准确称取5 g置于顶空进样瓶中,室温25 ℃下,平衡5 min后直接将进样针头插入样品瓶,采用顶空吸气法进行电子鼻分析实验。测定条件:传感器清洗时间100 s、传感器归零时间5 s、样品准备时间5 s、进样流量300 mL/min,检测时间200 s。完成1 次检测后系统进行清零和标准化,然后再进行第2次顶空采样。采用主成分分析表征样品之间的差别。
1.4 数据处理与分析
实验重复3 次,结果以平均值±标准差表示,使用DPS 7.05软件进行Duncan’s差异显著性分析,以P<0.05表示差异显著。采用Origin 8.0软件作图。
2 结果与分析
2.1 光源特性

图 1 光源光谱分布图(A)和赫姆霍兹图(B)Fig. 1 Spectral distribution (A) and Helmholtz map (B) of light source
由图1A可知,红光、绿光和蓝光处理中光源80%的能量分别集中于620~650、510~530 nm和450~470 nm,无重合部位,而白光80%的能量与红光、绿光和蓝光均有重合部位,证明4 种光源的特征性明显,差别明显。由图1B可知,赫姆霍兹图显示出红光和蓝光均位于638 nm和442 nm的主波长轨迹上,纯度接近100%,进一步验证了上述光谱能量分布无重合的结论,而绿光的补充波长位于520 nm,纯度为86.4%;与红光、绿光和蓝光不同,白光位于黑体轨迹上,显示出日光光谱特征;白光、红光、绿光和蓝光的光照强度分别为(2 939.7±155.6)、(1 104.7±55.7)、(2 977±181.5)lx和(155.1±15.3)lx,与王虹等[18]使用的光源相似。因此,红光、绿光和蓝光处理的光谱特征差别显著,具有对产品照明的功能;白光处理的光源接近于普通的日光照射,强度高于目前商场和超市冷藏柜的照明强度。
2.2 光照处理对鲜切青椒质量损失率的影响

图 2 光照处理对鲜切青椒质量损失率的影响Fig. 2 Effect of illumination on percentage mass loss of fresh-cut pepper
研究显示青椒的成熟度对鲜切产品的货架期有明显影响[19-21],成熟青椒有26%的水分通过花萼损失,在水分损失后果实的硬度、失水率和渗透性随果实水分损失的增加而降低[7],而鲜切青椒果肉等部位均暴露于环境,水分损失会更快。由图2可知,光照处理对质量损失率的影响显著,其中避光处理组的质量损失率显著低于其他各光照处理组,约为白光处理组质量损失率的54%;在光照处理组中,蓝光、绿光和红光处理组鲜切青椒之间的质量损失率无显著差异,但均显著低于白光处理组。可能是因为白光的光照强度较高,促进了果实表面水分的蒸发。所有鲜切青椒处理组的质量损失率范围为2.5%~4.5%,在可接受商品范围(质量损失率低于5%)[22]之内。因此,采用蓝光、绿光或红光处理有利于降低鲜切青椒的质量损失率。
2.3 光照处理对鲜切青椒叶绿素含量的影响

图 3 光照处理对鲜切青椒中叶绿素含量(A)和体外叶绿素含量(B)的影响Fig. 3 Effect of illumination on chlorophyll content in fresh-cut pepper (A)and chlorophyll content in vitro (B)
由图3A可知,与新鲜样品组相比,各处理组的叶绿素含量均显著下降,其中,绿光、红光、白光和避光处理组的叶绿素含量没有显著性差异,而蓝光处理组的叶绿素含量最低。因此,蓝光处理能显著性降低鲜切青椒中的叶绿素含量。与本研究结论相似,詹丽娟等[15]研究发现白光光照处理(2 000 lx)能显著减缓鲜切西兰花贮藏期间叶绿素降解和黄化发生;王丽颖等[23]在聚乙烯薄膜中添加转光剂后,鲜切西兰花的叶绿素含量保留率增加。
本研究进一步将青椒中叶绿素提取出来,置于安瓿瓶中,考察光照处理对叶绿素含量的影响。如图3B所示,24 h光照处理后,避光处理组的叶绿素含量降低得不明显,为初始值的85.6%,与Sgroppo等[24]的研究结果类似,而蓝光、绿光、红光和白光处理组的叶绿素含量分别降低至初始的16.6%、19.6%、8.05%和4.00%。因此,不同的光照处理对叶绿素含量均有较大的影响,而避光处理能明显延缓叶绿素降解。对比鲜切青椒中叶绿素含量的变化规律,可以推测青椒的细胞壁、液泡以及细胞液等均对叶绿素起到保护作用。
2.4 光照处理对鲜切青椒颜色的影响

表 1 光照处理对青椒颜色的影响Table 1 Effect of illumination on color of fresh-cut pepper
颜色是影响鲜切青椒可接受性的主要评价指标[25]。由表1可知,光照处理对鲜切青椒的外观颜色具有显著影响,一般认为当ΔE小于3.0时,人眼难以分辨两个样品的区别。避光处理组的ΔE最小,为1.65,且避光处理组的叶绿素含量与新鲜样品最为接近,而叶绿素含量可表征鲜切青椒的绿色度;因此避光处理有利于维持样品原有的颜色。而蓝光、绿光、红光和白光处理组的ΔE均高于3.0,其中,白光处理组的ΔE显著高于蓝光、绿光和红光处理组。因此,避光处理可以维持鲜切青椒原有的颜色,而与白光处理相比,绿光和红光处理均有助于减少样品颜色的变化。
图4显示了光照处理对鲜切青椒外观形态和水渍化损伤的影响。贮藏5 d后,各处理组的鲜切青椒均发生水渍化损伤(在图中用红色进行标示)。新鲜样品、蓝光、绿光、红光、白光和避光处理组的水渍化损伤程度分别为1.3%、24.5%、8.6%、13.8%、4.6%和3.1%。除新鲜样品外,避光处理组水渍化程度最低,而蓝光和红光的损伤程度最高。因此,蓝光和红光不利于鲜切青椒的贮藏。
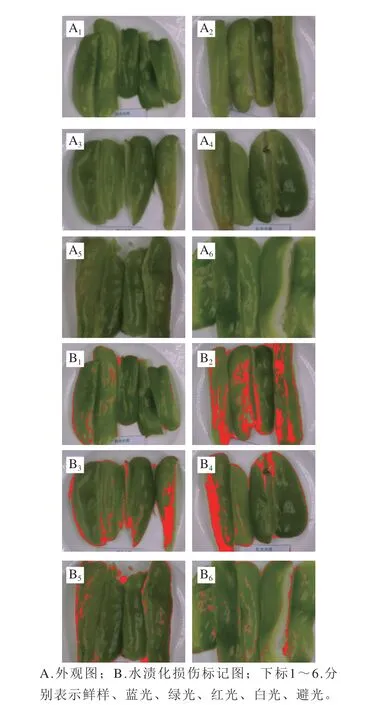
图 4 光照处理对鲜切青椒外观以及水渍化损伤的影响Fig. 4 Effect of illumination on appearance and water-soaking symptom of fresh-cut pepper
2.5 光照处理对鲜切青椒相对电导率、MDA含量和可溶性固形物质量分数的影响

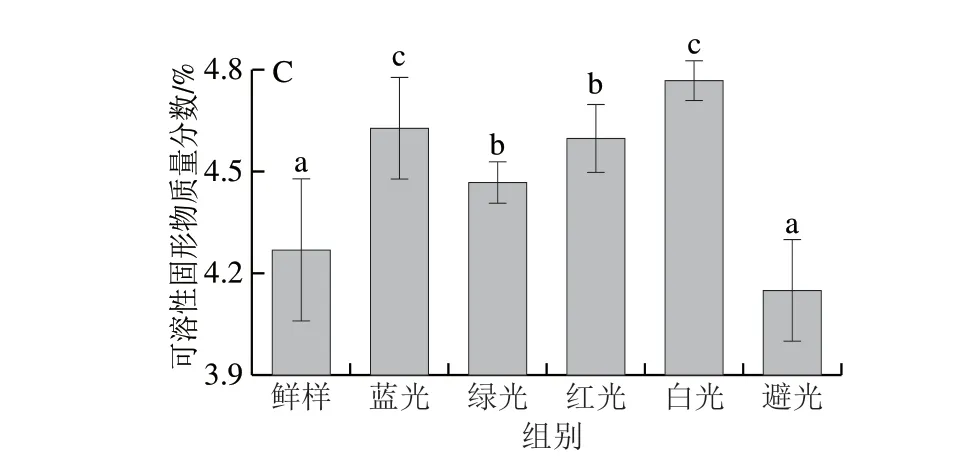
图 5 光照处理对鲜切青椒相对电导率(A)、MDA含量(B)和可溶性固形物质量分数(C)的影响Fig. 5 Effect of illumination on relative conductivity (A), MDA content (B)and soluble solid content (C) of fresh-cut pepper
相对电导率可表征样品细胞内部电解质泄露情况,从而反映样品细胞壁破裂情况;MDA是膜脂过氧化作用的主要产物之一,其含量可反映样品细胞膜衰老和破裂的程度[26];因此,相对电导率和MDA含量的提高均表示样品的细胞壁破裂程度提高,说明了细胞的衰老。与新鲜样品相比,各处理组相对电导率显著提高,该结论与Gómez等[21]的结论一致。在光照处理组中,蓝光和白光处理组相对电导率显著高于其他处理组(图5A)。与相对电导率的变化规律相似,各光照处理组MDA含量均显著高于新鲜样品,蓝光和白光处理组的MDA含量显著高于其他处理组;与相对电导率变化规律不同的是,避光处理组MDA含量显著高于新鲜样品组,但是显著低于其他处理组(图5B)。由此可以推断白光和蓝光处理最易导致鲜切青椒细胞衰老,而绿光、红光和避光处理均有助于延缓细胞的衰老过程。
由图5C可知,与新鲜样品相比,避光处理组的可溶性固形物质量分数没有显著性变化,而其他各处理组的可溶性固形物质量分数均显著提高,其中蓝光和白光处理组的可溶性固形物质量分数显著高于其他各处理组。因此,蓝光和白光促进了鲜切青椒的生理代谢,积累了更多的可溶性固形物。该结论与相对电导率和MDA含量的结果一致,进一步证实了蓝光和白光处理具有促进鲜切青椒代谢的作用,而绿光和红光处理延缓了青椒的代谢进程。周任佳等[27]研究进一步发现,在避光环境中,保鲜膜包装可以进一步降低鲜切哈密瓜可溶性固形物和VC的损失,维持较好的硬度和色泽,对延缓果实细胞衰老有一定作用。
2.6 光照处理对鲜切青椒风味的影响
电子鼻常用来辨别样品风味之间的区别,有研究使用该仪器对青椒的新鲜度进行区分,并取得了较好的区分度[21,28]。由图6可知,主成分1和主成分2的方差积累贡献率分别为98.02%和1.96%,因此,主成分1和2对鲜切青椒风味的总贡献率达到99.98%,可以表征鲜切青椒的香气特征。各处理组在主成分1的投影具有一定区分度,其中新鲜样品和避光处理组与其他各处理组均有明显的差别,而蓝光、绿光、红光和白光处理组之间未有效区分。与蓝光、绿光、红光和白光处理组相比,避光处理样品的香气更加接近于新鲜样品。在主成分2的维度上,各个处理组互相之间均未得到有效区分。因此,光照处理会引起鲜切青椒香气的变化,而避光处理有利于维持青椒原有的香气。

图 6 光照处理对鲜切青椒风味的影响Fig. 6 Effect of illumination on aroma of fresh-cut pepper
3 结 论
红光和绿光处理能减少果实的颜色改变,降低可溶性固形物质量分数、丙二醛含量和相对电导率的变化;绿光和白光处理组水渍化损伤程度较低;绿光、红光、蓝光和白光处理组样品中的风味没有明显差别;此外,绿光处理有利于降低鲜切青椒的质量损失率,延缓果实的果肉损伤。因此,绿光处理有助于维持货架期间鲜切青椒的品质。
——青椒

