3 种大米淀粉脱支前后结构及流变特性
曹 川,申明玉,许 莉,韦冬梅,周裔彬,*
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230001;2.安徽粮食工程职业学院粮食工程系,安徽 合肥 230011)
淀粉作为能量储存物质,广泛来源于种子、水果及植物根系中,不同植物来源淀粉的形态和结晶结构各不相同,直链淀粉、支链淀粉组成有所差异,理化性质以及对普鲁兰酶水解的灵敏性也不同[1-2]。普鲁兰酶是一种脱支酶,作为外切酶,能够专一性地切割葡萄糖α-1,6-糖苷键,应用于淀粉的脱支[3]。不同脱支程度淀粉产物的聚合度(degree of polymerization,DP)不同,淀粉完全脱支产生具有一定链长的线性糊精,DP范围一般在6~100之间,Klaochanpong[4]和Precha-Atsawanan[5]等比较脱支蜡质淀粉与天然蜡质淀粉的胶凝性能发现,脱支淀粉(debranched starches,DBS)产生的凝胶较为混浊,具有光泽的外观和较低的黏度,而天然淀粉产生的凝胶均匀、透明且黏度较高。Liu Guodong等[6]应用普鲁兰酶对4 种不同来源DBS的水解特性和凝胶特性进行研究,结果表明:所有DBS均为V型淀粉,具有中空、单螺旋结构;脱支处理对淀粉黏度影响较大,使淀粉黏度下降,DBS能够捕获水以形成水凝胶;脱支有效地改善了淀粉的溶解度和持水能力,有助于其凝胶的形成。DBS的特殊功能特性逐渐受到研究者的青睐,特别在回生特性、凝胶性能等方面[7-8]。
本实验选择糯米、粳米和籼米3 种大米淀粉,研究普鲁兰酶处理前后3 种大米淀粉脱支衍生物的晶体结构、分子质量分布、溶解度、黏度和流变学特性,为淀粉基包埋产物的缓慢释放提供参考依据。
1 材料与方法
1.1 材料与试剂
糯米、粳米和籼米由安徽省惠丰粮食储备库提供。
普鲁兰酶(EC 3.2.1.41) 美国Sigma公司;氢氧化钠、乙酸钠、无水乙醇、乙酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
RVA-4500快速黏度分析仪 瑞典波通仪器公司;TTR-III X射线衍射(X-ray diffraction,XRD)仪日本理学电机公司;Nicolet iS50 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪、ICS5000高效阴离子交换色谱(high-performance anionexchange chromatography,HPAEC)仪、Dionex™CarboPac™ PA200离子交换柱(250 mm×1 mm,5.5 μm) 美国Thermo Fisher Scientific公司;DHR系列流变仪 美国TA公司。
1.3 方法
1.3.1 DBS的制备
通过稀碱浸泡分离法制得糯米、粳米和籼米3 种大米淀粉,3 种大米原淀粉中直链淀粉质量分数分别为糯米1.97%、籼米25.65%、粳米17.23%。
DBS制备:参考刘国栋[9]和Cai Liming[10]等的方法,并做适当修改。将淀粉和乙酸缓冲液(0.01 mol/L,pH 5.5)按料液比1∶20加入500 mL带塞锥形瓶中,置于集热式磁力搅拌器上于105 ℃下恒温搅拌30 min,然后转移到灭菌锅中,121 ℃下加热1 h彻底糊化,再将淀粉糊冷却至50 ℃,加普鲁兰酶,50 ℃反应12 h,将酶解液浓缩至200 mL后缓慢加入无水乙醇中,容量瓶定容至1 000 mL,放置室温过夜,再以5 000 r/min离心15 min,收集沉淀物,沉淀用无水乙醇洗涤3 次,最后冷冻干燥、研磨和筛分,待用。
1.3.2 XRD分析
采用XRD仪测定天然淀粉和DBS冷冻干燥粉末的结晶度。仪器条件:管压40 kV、管流80 mA、衍射角(2θ)扫描区域为0°~50°、扫描速率2°/min。参考Lopez-Rubio等[11]的方法使用PeakFit 4.12软件对淀粉颗粒结晶峰面积和非晶区域进行分析。平均链长(以DP表示)按式(1)计算。

1.3.3 HPAEC分析
参考Liu Guodong等[1]的方法,采用HPAEC仪(配备电化学检测器)测定天然淀粉和DBS冷冻干燥粉末的链长分布。分析条件:进样量50 μL;柱温25 ℃;流动相A为ddH2O;流动相B为100 mmol/L NaOH;流动相C为100 mmol/L NaOH/500 mmol/L NaAc;流速0.5 mL/min。
1.3.4 FT-IR分析
称取一定质量的天然淀粉和DBS冷冻干燥粉末,分别添加100 倍质量的无水KBr研磨混合,将所得样品粉末压缩成薄圆盘状。扫描范围为4 000~400 cm-1,分辨率为4 cm-1。
1.3.5 黏度分析
采用快速黏度测定仪对天然淀粉和DBS的黏度进行测定。测试程序参考美国谷物化学家协会的方法[12]进行,水分质量分数设定为14%,称取样品冷冻干燥粉末3.00 g,加入蒸馏水25 mL。温度设定程序:50 ℃保持1 min,以12 ℃/min上升到95 ℃,保持2.5 min,再以12 ℃/min下降到50 ℃,保持1.4 min。待天然淀粉完成黏度测定后取出糊化桶,将普鲁兰酶加入混合物中,重新设定程序使温度在50 ℃保持60 min,测定DBS黏度。
1.3.6 流变学性质分析
淀粉糊糊化完全后冷却至50 ℃,添加普鲁兰酶,继续在集热氏磁力搅拌器中105 ℃恒温搅拌1 h,采用流变仪对天然淀粉和DBS流变学性质进行测定。选择40 mm平板,间隙值设定为1 050,擦去多余样品,重新设间隙值为1 000。动态流变设定程序为:振荡频率0.1~10,应变2%,9 个点。静态流变设定程序为:流动扫描,剪切速率0.1~100 s-1,6 个点。
1.3.7 水解特性分析
1.3.7.1 持水力测定根据Liu Guodong等[1]的方法对淀粉持水力进行测定。
1.3.7.2 膨胀能力测定
用蒸馏水配制质量浓度为5 g/100 mL的淀粉乳,置于集热式磁力搅拌器上,于105 ℃下恒温搅拌,待完全糊化后,取10 mL乳液于离心试管中,3 000 r/min离心30 min,收集上清液,所得沉淀即为膨胀淀粉。将上清液置于表面皿中于105 ℃烘至恒质量,得到水溶淀粉,称质量并记录[13]。按式(2)、(3)计算淀粉的溶解度和膨胀能力。

式中:S为溶解度/%;m1为上清液蒸干至恒质量后的质量/g;m0为称取淀粉质量/g;m2为沉淀质量/g。
1.4 数据处理与分析
实验数据采用Origin 8.0和SPSS 19.0软件对数据进行相关性分析和逐步回归分析。
2 结果与分析
2.1 XRD分析结果

图 1 3 种大米淀粉(A)及其DBS(B)的XRD图谱Fig. 1 XRD patterns of native rice starch (A) and DBS (B)
由图1可知,3 种大米天然淀粉(IS、JS、WS)XRD峰的位置主要集中在10°~27°,在衍射角2θ为15°、17°、18°和23°时出现较强的特征衍射峰,这属于典型的A型淀粉[14],而DBS衍射峰的位置出现变化,DBIS、DBJS和DBWS衍射峰的位置主要集中在7.9°、13.5°、15°、17°、18°、21°和23°,表明DBS的结晶度明显低于天然淀粉,无定形区增加,表明经过普鲁兰酶水解后形成的晶体结构向无定形和无序的淀粉链发展,进入无序凝胶网络[15-16]。DBWS在7.9°、13.5°、15°、17°、18°、21°特征衍射峰强度高于DBIS和DBJS,表明DBWS中直链含量明显增多。
2.2 链长分布分析结果

图 2 3 种大米淀粉的链长分布Fig. 2 Distribution of chain lengths of native and debranched rice starch
根据分支链长淀粉可分为4 种类型:A链:DP为6~12;B1链:DP为13~24;B2链:DP为25~36;B3链:DP大于37[17]。HPAEC-脉冲电流检测器可以确定DP范围为6~60[18-19]。采用支链淀粉酶选择性水解α-1,6-糖苷键,将支链切下,得到线性短链淀粉。本实验选择3 种大米淀粉经过支链淀粉酶彻底脱支,研究支链淀粉酶对水解淀粉分支结构和性质的影响。由图2可知,3 种DBS的精细结构相似。DBIS含有较多长链淀粉分支(B2和B3链:27.47%),而DBWS与其他两种大米淀粉相比,A链的相对含量为32.61%,所占比例较高,B2和B3链为22.08%,所占比例最低。DBWS的平均链长最短(DP为19.27),DBIS的平均链长最长(DP为21.34);普鲁兰酶可以选择性地水解α-1,6-D-糖苷键。以上结果表明,普鲁兰酶水解反应对较短的支链更有效,链长越短越容易被切割,反之亦然[20]。
2.3 FT-IR分析结果
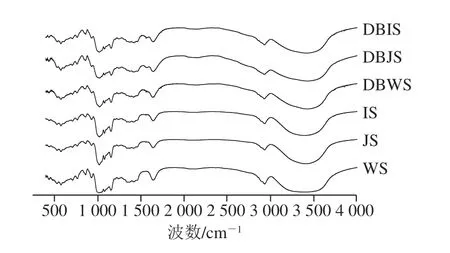
图 3 3 种大米淀粉及其DBS的FT-IR图谱Fig. 3 Fourier transform infrared spectra of raw and debranched rice starch
由图3可知,在天然淀粉中,通常情况下在3 385 cm-1处的宽带归因于—OH伸缩振动,在1 250 cm-1处的波段对应于—OH弯曲振动[21]。3 种大米淀粉及其DBS的FT-IR光谱之间峰形没有明显差别,但DBS的峰强度有所增强。天然淀粉在脱支过程中α-1,6-糖苷键不断被水解断裂,—OH数量随之增加,导致在3 000~4 000 cm-1处的吸收峰变得狭长,3 410 cm-1处的—OH伸缩振动吸收峰相对增强。
2.4 黏度分析结果
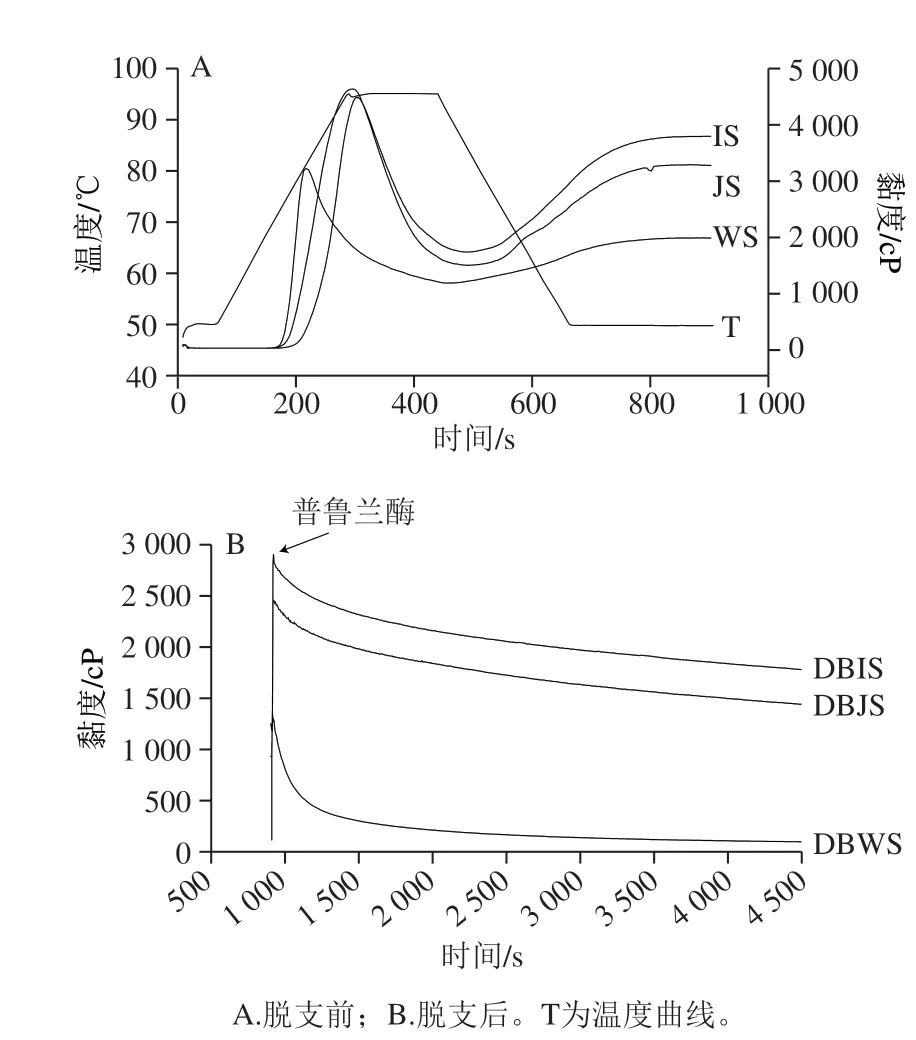
图 4 3 种大米淀粉脱支前后的黏度变化趋势Fig. 4 Trend of viscosity in raw and debranched rice starch
由图4和表2可知,不同来源淀粉脱支前后的黏度不同。在糊化过程中,3 种大米的天然淀粉显示出典型的布拉本德黏度曲线。WS的糊化曲线与IS和JS有较大差异;WS短时间内达峰值黏度,之后迅速下降,在冷却过程中谱线平缓,而IS和JS达到峰值黏度的时间略长,冷却过程中黏度回升明显,最终黏度高于WS。IS峰值黏度、最终黏度较高说明IS颗粒分子间缔合、交联程度较大,排列紧密,抗剪切力较强。崩解值反映了淀粉颗粒结构在加热过程中的稳定性,崩解值越大淀粉颗粒越不稳定。本实验中JS崩解值最大,说明其淀粉颗粒热稳定性差,而WS呈现较低的峰值黏度,表明其有较高的抵抗膨胀和破裂能力[22]。WS的回生值仅为726 mPa·s,表明WS与其他两种淀粉相比不易退化和发生分子聚集[15]。当将普鲁兰酶添加到系统中时,淀粉糊黏度急剧下降。由表2可知,DBWS、DBJS和DBIS的最终黏度较其天然淀粉分别降低了94.99%、56.15%和52.84%。DBWS黏度较DBJS和DBIS下降快,表明WS对普鲁兰酶更为敏感,容易被水解。支链淀粉以及支链淀粉链长所占的比例,可能对淀粉糊的最终黏度具有重要影响。IS的糊化温度最高,说明其在自然水分下加热时晶体崩解所需热量最低,凝胶稠度最小。WS的糊化温度最低,说明其在自然水分下加热时晶体崩解所需热量最高,凝胶稠度最大,究其原因可能是直链淀粉含量的差异性[23-24]。为保持酶活力,淀粉糊化后加入普鲁兰酶,测定DBS黏度,温度设定为50 ℃,温度过高会导致酶活力丧失,因此DBS糊化温度未测定。

表 2 3 种大米淀粉脱支前后的黏度变化Table 2 Viscosity change before and after debranching of rice starch
2.5 流变学特性分析结果
2.5.1 动态流变学特性分析结果


图 5 3 种大米淀粉脱支前后的动态流变变化趋势Fig. 5 Trend of dynamic rheology in raw and debranched rice starch
由图5可知,3 种大米淀粉储能模量(G’)和损耗模量(G’’)均随着频率的增加而上升,表现为典型的弱凝胶动态流变学特征,IS的黏性和弹性均为最高,WS均为最低,这可能是由直链淀粉含量差异导致的。脱支后DBS的G’和G’’整体随频率增加而上升,但G’最终值差异较小,而DBIS的G’’最高,DBWS最低,这与黏度分析结果相同,3 种DBS的G’和G’’都较其天然淀粉降低,说明脱支处理使凝胶强度降低,凝胶表现出液体特性。经过脱支处理,淀粉分子内部结构重组,分子链被切割,直链淀粉含量增多,分子链段缠绕变少,黏度降低,凝胶强度降低[25]。
2.5.2 静态流变学特性分析结果

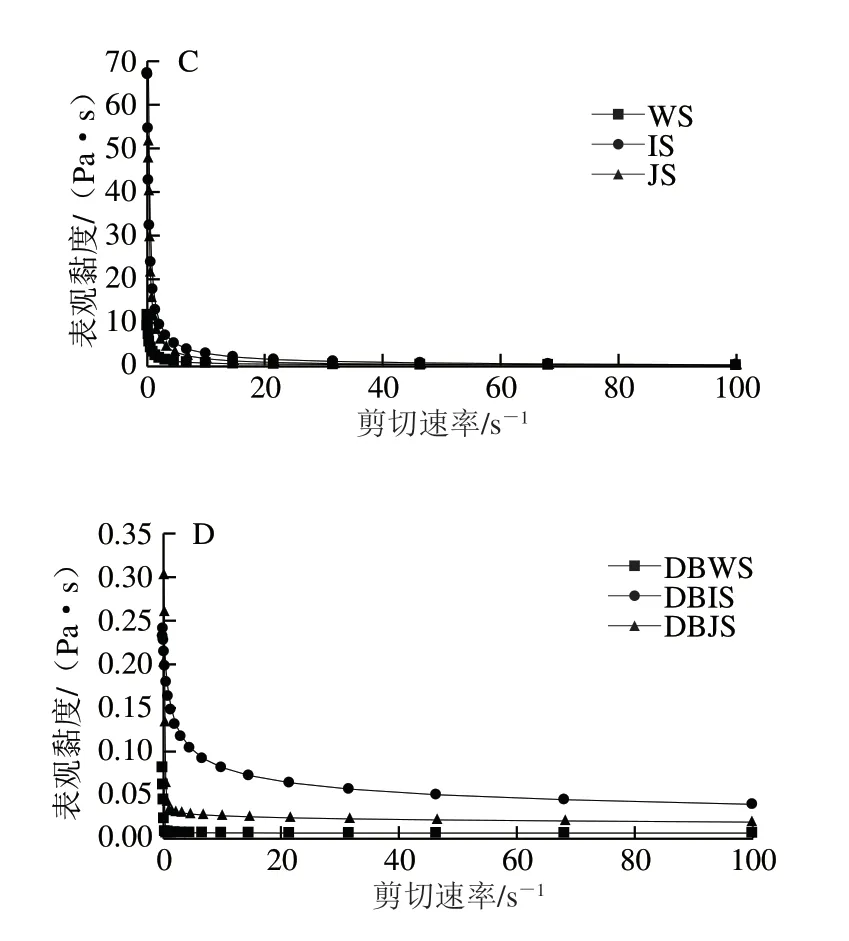
图 6 3 种大米淀粉脱支前后的静态流变变化趋势Fig. 6 Trend of static rheology in raw and debranched rice starch
由图6可知,3 种大米天然淀粉及其DBS的剪切应力均随剪切速率的增加而增大,具有假塑性流体特征;曲线均不同程度地屈向剪切应力轴,可以判断出其均属于非牛顿流体;3 种大米天然淀粉的表观黏度均在剪切速率为0~10 s-1时急剧下降,表现出更强的剪切稀化现象,经过普鲁兰酶处理后的3 种DBS的剪切应力和表观黏度均比天然淀粉低,这可能是由于脱支处理后分子链断裂,使分子链更利于流动[26-27]。2.6 水解特性分析结果
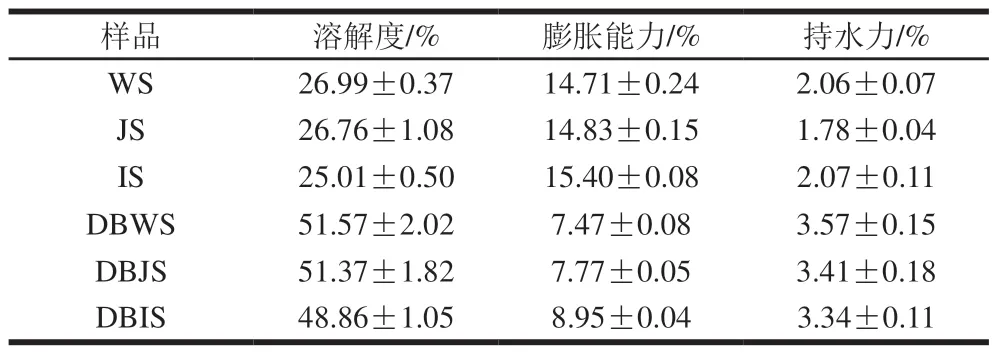
表 3 3 种大米淀粉及其DBS的水解特性Table 3 Hydrolysis characteristics of raw and debranched rice starch
由表3可知,3 种大米天然淀粉的溶解度较低,膨胀能力较高,经普鲁兰酶脱支后溶解度增加,膨胀能力减小,究其原因可能是脱支使得直链淀粉含量增加,直链淀粉的双螺旋结构在淀粉糊化过程中很难破坏,因此能抑制淀粉分子的膨胀,增加其溶解度[28]。链长会影响持水力,链长越长越易凝结成块,从而容纳更多的水分。IS的持水力高于WS和JS,直链淀粉含量和支链长度是造成这种差异的主要原因。直链淀粉倾向于形成不溶性凝胶网络,持水力差,而较长的链可以捕获更多的水分形成水凝胶。相反,高度分枝支链淀粉不太容易重新结合[29]。因此,由于短链数量增加,DBS持水力提高。
3 结 论
本实验研究结果表明,经普鲁兰酶水解后,DBS短链葡聚糖链比例增加。与籼米和粳米淀粉相比,糯米淀粉对普鲁兰酶更为敏感,链长分布结果表明糯米淀粉的A链相对含量为32.61%,平均链长最短(DP为19.27),倾向于形成更短的链,淀粉糊黏度急剧减少,普鲁兰酶水解后形成的晶体结构向无定形和无序的淀粉链发展,进入无序凝胶网络。脱支前后3 种大米淀粉FT-IR曲线没有明显差异,脱支后淀粉黏度、G’和G’’都有所降低,淀粉颗粒分子间缔合、交联程度变弱,排列松散。天然淀粉的溶解度较低,膨胀能力较高,经过普鲁兰酶脱支后溶解度增加,膨胀能力减小,推测链长会影响持水力。基于以上结果,发现DBS亲水性强,低相对分子质量线性短链淀粉相对含量增加,分子运动性增强,重新组合形成更加致密的凝胶结构。糯米淀粉对普鲁兰酶处理较其他两种大米淀粉更为敏感。经过普鲁兰酶脱支后的大米淀粉增强了分子聚集和缔结,在亲水介质中,DBS能快速形成凝胶结构,抑制酶液降解,使淀粉的抗酶解能力增加,增强淀粉的流动性和压实性能。DBS可以作为胶凝剂、混浊剂、脂肪替代品以及谷物类早餐食品的包衣等[9,30],也可用于包埋运载药物及活性物质等。
——中核工程创新驱动改革,奋力打造核工程产业链“链长”

