红耳龟睾丸氧化应激损伤及酵母多糖的干预效应
黄小珍,熊 顺,傅丽容,史海涛
( 海南师范大学 生命科学学院,热带岛屿生态学教育部重点实验室,海南 海口 571158 )
近年来龟鳖养殖业蓬勃发展,已逐渐成为我国淡水养殖业的重要支柱产业[1]。在规模化、集约化龟鳖养殖过程中,极易受到环境、饲料营养组成、饲养管理等方面影响而导致应激的产生,如胁迫应激、温度应激和抓捕应激等[2]。任何较强应激都会伴随氧化应激的发生[3],氧化应激严重影响水产动物繁殖、生产性能和健康,降低经济效益。
已有的研究表明氧化应激导致活性氧在细胞内积聚,机体氧化和抗氧化能力失衡,自由基在体内积累引发机体许多脏器的损伤[4]。睾丸作为生殖系统的重要器官,其内部生殖细胞对细胞内外的氧化状态高度敏感,极易受到自由基的伤害,内源性和外源性物质均可影响其发育和功能[5-6]。因此养殖龟鳖繁殖能力下降、性比失调等问题已引起广泛的关注。
应用营养性体内抗氧化剂最大程度降低动物生产中的氧化应激损害,是目前公认绿色、环保有效的生产方法。酵母多糖是酵母细胞壁的重要组成部分,是促进动物生长、调节动物肠道、增强免疫功能的新型水产饲料添加剂[7-8]。有研究表明,饲料中添加1200 mg/kg的酵母多糖可明显提升中华条颈龟(Mauremyssinensis)幼龟的非特异性免疫机能[9]。孙翠慈[10]研究了酵母多糖对凡纳滨对虾(Litopenaeusvannamei)抗氧化作用。而酵母多糖在龟鳖养殖中的抗氧化作用却鲜见研究,本研究拟开展氧化应激对雄性红耳龟(Trachemysscriptaelegans)生殖器官的影响,分析氧化损伤的作用机制,并探讨饲料添加酵母多糖抗应激效应,为龟鳖养殖探寻更为有效的抗氧化应激方式。
1 材料与方法
1.1 试验龟、药品及饲养条件
试验用32只健康成体雄性红耳龟,体质量为(387.4±49.5) g,购自海口市鸿旺水产养殖有限公司。置海南师范大学龟养殖中心驯养,养殖池规格为190 cm×65 cm×32 cm,水深没过背甲,光照度100 lx,温度(30±2) ℃,每池饲养8只。所用饲料为佛山市顺德区全兴水产饲料有限公司生产的龟鳖配合饲料(粗蛋白≥43.0%,粗纤维≤3.0%,钙1.0%~3.5%,总磷0.8%~3.0%,氯化钠1.2%~3.5%,赖氨酸≥2.0%,水分≤12.0%),试验过程中每2 d投喂1次,投饲量以使其达到饱食并略有剩余为准,投喂2 h后清理剩余饲料。
酵母多糖为购自湖北安琪酵母有限公司的福邦牌免疫多糖(酵母细胞壁多糖),各成分含量:β-葡聚糖30%~40%、甘露寡糖≥20%、几丁质≥2.5%、蛋白质≤35%、水分≤6.0%、溶解率45%~60%、30% H2O2(广州化学试剂厂500 mL,加无菌双蒸水配制为10% H2O2)。
1.2 氧化应激模型制备
为了更准确地掌握氧化应激对雄性红耳龟睾丸的损伤作用,预试验分5个剂量梯度(按体质量腹腔注射0.5、1.0、1.5、2.0、2.5 mL/kg的10% H2O2溶液)[11],每组6只,于后肢基部靠近睾丸部位腹腔注射,每只保持注射深度、方向一致,次日睾丸取样制作组织切片。镜检结果显示,自注射剂量1.5 mL/kg开始,红耳龟睾丸曲细精管生精上皮出现明显的氧化损伤。因此,本试验按1.5 mL/kg注射10% H2O2制备睾丸氧化应激模型。
1.3 试验设计
试验红耳龟随机分为4组,每组2个平行,每个平行4只龟,各组间试验龟体质量均一。试验第1 d对其中3组红耳龟按照1.5 mL/kg进行腹腔一次性注射10%H2O2,剩余1组(对照组)注射等量无菌生理盐水。对照组(生理盐水非应激处理)、试验组1(应激处理组),腹腔注射10%H2O21 d后取样。试验组2(基础日粮投喂组)、试验组3(酵母多糖添加组)第1 d同样注射10% H2O2,饲喂30 d后取样;基础日粮投喂组仅投喂基础日粮,酵母多糖添加组以基础日粮按体质量1200 mg/kg添加酵母多糖投喂[9]。试验过程中监控个体行为是否异常或死亡。
1.4 各指标的测定方法
1.4.1 血清性激素
10%H2O2处理后第2 d,取对照组、应激处理组试验龟共计16只,称量质量,-20 ℃冷冻麻痹60~80 min后,无应激反应,断颈取血,取血6~8 mL于肝素钠抗凝管中,静置30 min后,以1500~2000 r/min离心15~20 min,冷藏待检。使用放射免疫分析试剂盒(RIA法),参考文献[12]的方法,测定血清睾酮、卵泡刺激素、黄体生成素水平。试验第30 d,基础日粮投喂组、酵母多糖添加组个体同样操作取血检测性激素。
1.4.2 抗氧化物酶活性的测定
上述试验龟断颈取血时另取10 mL,4 ℃下 3500 r/min离心10 min,使用南京建成生物工程研究所生产的试剂盒,按说明测定血清中过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶活性和丙二醛含量。
1.4.3 睾丸脏器系数
4组试验龟在预设的时间取血结束,解剖摘取两侧睾丸,剔除附着的结缔组织,用4 ℃预冷的0.65%生理盐水冲洗后,滤纸吸干睾丸表面水分,称量质量。计算睾丸质量占体质量的百分比,即为睾丸脏器系数。
1.4.4 睾丸组织病理学观察
睾丸脏器系数测试完毕,置睾丸于波恩氏液固定,24 h后换70%酒精保存。采用苏木精—伊红染色法制作石蜡组织切片,镜检(MOTIC BA310-T)、显微摄影。每侧睾丸采用Motic Images Advanced 3.2软件随机测量15个曲细精管管径、生精上皮厚度、曲细精管管腔直径,计算均值(以平均值±标准差表示)。
1.5 数据分析
采用F检验或Levene检验各组方差齐性,进行单因素方差分析,如果方差分析结果显示各组数据间存在显著差异,应进一步采用Duncan′s检验来进行比较,从而确定与对照组有统计学差异的试验组,以LSD法进行多重比较。上述数据分析应用Excel 2010和SPSS 19.0进行统计,差异显著临界值α=0.05,差异极显著临界值为α=0.01。
2 结果与分析
2.1 不同处理对红耳龟睾丸形态及脏器系数的影响
注射处理结束跟踪观察,对照组无明显变化,其余3组试验龟除在注射处有微红肿现象外,其他方面与对照组无异样,行动自如、反应敏捷、摄食正常,2 d后注射处消肿恢复原样,无个体死亡。解剖观察睾丸形态结构,试验龟睾丸外观圆润光滑且饱满,富有弹性,色泽为米白色,无充血现象,与对照组相比外部形态无明显变化。同一个体两侧睾丸重量及大小相近,无明显差异。
不同组间试验龟睾丸系数差异显著,应激处理组睾丸明显小于对照组(P<0.05),说明H2O2对睾丸可能有一定的损伤;基础日粮投喂组睾丸系数与应激处理组相比差异不显著(P>0.05)。酵母多糖添加组睾丸系数明显大于其他3组,近乎其2倍,差异极显著(P<0.01),说明酵母多糖对睾丸氧化损伤具有一定的修复作用,可促进睾丸的生长发育。
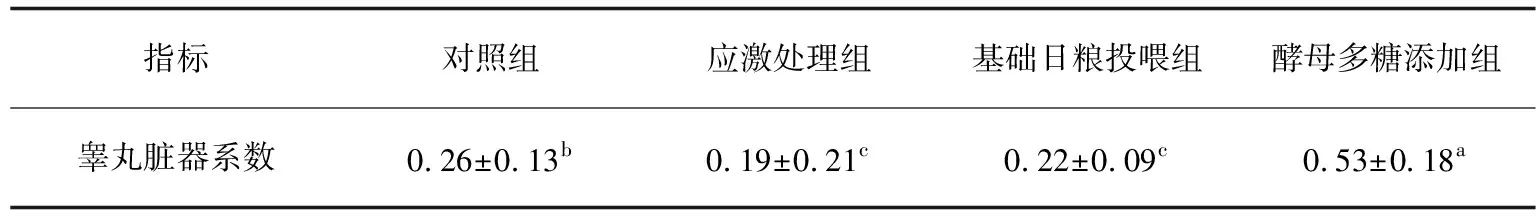
表1 不同处理组雄性红耳龟睾丸脏器系数比较(平均值±标准差,n=8)
注:同行上标相同字母表示平均值间差异不显著(P>0.05),相邻字母表示平均值间差异显著(P<0.05),相间字母表示平均值间差异极显著(P<0.01),下同.
2.2 红耳龟睾丸的组织病理学观察
各组红耳龟睾丸组织氧化损伤状况及饲料中添加酵母多糖后的氧化损伤修复效应见图1,各组红耳龟曲细精管管径、生精上皮厚度、曲细精管管腔直径见表2。对照组曲细精管管壁完整,由基底膜向管腔依次可见精原细胞、初级精母细胞、次级精母细胞充满曲细精管,各级生精细胞排列有序、发育良好,管径达(179.10±60.53) μm,生精上皮高度为(56.35±21.39) μm,管腔较小,管腔直径为(74.32±31.97) μm(图1a);应激处理组曲细精管生精上皮排列松散,次级精母细胞及精子细胞脱落进入管腔,生精上皮厚度减小为(47.84±12.48) μm,管腔增大为(103.08±40.62) μm,与对照组相比差异显著(P<0.05)(图1b),说明氧化应激损伤了睾丸。基础日粮投喂组睾丸曲细精管中各期生精细胞的形态没有明显的变化,生精上皮厚度减小为(39.92±13.39) μm,管腔直径增大为(188.01±40.71) μm,与对照组相比差异极显著(P<0.01)(图1c),说明试验个体睾丸氧化损伤自行修复能力有限。酵母多糖添加组睾丸曲细精管中初级精母细胞增多,各期生精细胞排列整齐,未见细胞损伤脱落,生精上皮厚度增大为(45.19±11.38) μm,管腔直径减至(130.72±33.62) μm(图1d),差异显著(P<0.05)。说明酵母多糖有助于睾丸生精上皮组织的修复再生,缓解氧化应激损伤。

图1 不同处理红耳龟睾丸曲细精管组织结构a:对照组;b:应激处理组;c:基础日粮投喂组;d:酵母多糖添加组.400×.
2.3 红耳龟血液性激素含量的变化
3个试验组红耳龟血清中黄体生成素水平均略低于对照组,睾酮水平高于对照组,但均差异不显著(P>0.05);应激处理组与对照组相比,3种性激素水平差异不显著(P>0.05),酵母多糖添加组与基础日粮投喂组相比结果类似(表3)。说明氧化应激损伤没有干扰红耳龟下丘脑—垂体—性腺作用轴。

表2 不同组红耳龟睾丸曲细精管测量值(平均值±标准差,n=8) μm

表3 不同处理组雄性红耳龟血清性激素水平变化(平均值±标准差,n=8)
2.4 红耳龟血清抗氧化物酶活性及丙二醛含量的变化
应激处理组红耳龟血清中过氧化氢酶活性、超氧化物歧化酶活性、谷胱甘肽过氧化物酶活性与对照组相比显著降低(P<0.05),丙二醛含量明显升高2倍(P<0.01);基础日粮投喂组过氧化氢酶、超氧化物歧化酶、谷光甘肽过氧化物酶活性略高于应激处理组,差异不显著(P>0.05),但仍低于对照组,丙二醛含量继续升高,几乎是对照组的4倍(表4)。与基础日粮投喂组相比,酵母多糖添加组3种抗氧化酶活性均明显升高(P<0.05),丙二醛含量显著下降(P<0.05)。说明氧化应激可抑制抗氧化酶活性,酵母多糖干预效应明显,可缓解氧化应激。

表4 各组红耳龟血清抗氧化酶活性及丙二醛含量变化(平均值±标准差, n=8) U/mL
3 讨 论
3.1 氧化应激对红耳龟睾丸的氧化损伤
在试验条件下制备龟鳖动物生殖系统氧化应激模型是研究氧化应激对龟鳖动物繁殖功能影响的基础。目前许多氧化应激模型是全身性的氧化应激,对生殖器官的针对性不强,在不影响其正常生理功能的情况下,建立生殖腺的氧化应激模型实属不易。H2O2是常用的氧化剂,性质稳定,是研究氧化损伤的重要工具[13]。研究表明,进入体内的H2O2极易透过细胞膜,与细胞内铁离子形成高活性的自由基,在体内亚铁离子环境存在下能通过Fenton反应生成高活性的·OH(H2O2+Fe2++H+→·OH+Fe3++ H2O),更强烈的损伤组织[14]。本试验采用10%H2O2作为应激源,按1.5 mL/kg体质量腹腔注射(睾丸附近)诱导红耳龟睾丸氧化应激,未见异常行为和死亡,睾丸脏器系数和睾丸病理学观察发现,睾丸生精上皮各期生精细胞有不同程度的损伤,因为睾丸含有丰富的多不饱和脂肪酸(尤其是C20:4及C22:6),以及潜在的活性氧生成系统,极易遭受氧化应激的影响[15]。推断注射腹腔内过氧化氢可产生大量自由基引起氧化抗氧化失衡发生损伤,过量的活性氧导致生精细胞脂质过氧化、蛋白变性失活、受损[16]。这说明这种生殖腺氧化应激造模具有针对性,为研究氧化应激对生殖系统的氧化损伤提供良好的模型。
3.2 氧化应激对雄性红耳龟血清性激素的影响
龟类性激素分泌调控与哺乳动物相似,睾丸是合成雄激素和精子发生的器官,通过下丘脑—垂体—性腺作用轴启动控制间质细胞合成雄激素,雄激素的分泌促进了精子的发生、成熟,促发求偶行为[17]。应激对繁殖有负面影响[18],在抓捕、囚禁应激中均得到证实[19-20]。应激可激活龟类下丘脑—垂体—肾上腺轴,肾上腺酮激素含量增加,抑制了睾丸功能,减少了雄激素分泌[20]。本试验中,红耳龟氧化应激后血清性激素含量未出现明显的变化,与上述研究结果不一致。同样的结果在绿海龟(Cheloniamydas)的应激研究中也发现,绿海龟如争夺巢域、热应激以及雌海龟筑巢过程中遭遇紧张性应激,肾上腺素、去甲肾上腺素和皮质酮含量均未发生显著变化,性激素水平仍保持原有水平,继续保持繁殖活力[21]。推测雄性红耳龟可能与海龟一样在长期进化过程中产生了适应机制,以应对繁殖需求。另外,性激素的分泌水平与龟类的繁殖周期密切相关,雄性红耳龟求偶行为一般常发生在春季和秋季[22]。夏季下丘脑—垂体—性腺作用轴功能不活跃,应激反应敏感性下降,所以在夏季开展氧化应激试验血清性激素未发生明显的改变,可能与此时的生理机能状态有一定的关系。
3.3 氧化应激对红耳龟血清中抗氧化物酶活性的影响和酵母多糖干预效应
机体处于不良环境或病理状态下,会产生大量的自由基,使机体处于氧化应激状态中,抗氧化系统对于抵抗氧化损伤、维持氧化还原平衡具有关键性作用,组织中抗氧化酶活性的高低间接反映机体清除氧自由基的能力[16]。应激处理组产生氧化应激,血清中过氧化氢酶活性、超氧化物歧化酶活性和谷胱甘肽过氧化物酶活性显著降低,说明腹注过氧化氢使机体产生氧化应激,抑制抗氧化酶系统,使机体清除活性氧自由基、羟自由基能力有所下降,当生物体内累积过量的活性氧自由基,导致脂质过氧化,丙二醛含量升高。
酵母多糖的免疫增强作用在水产养殖、家禽养殖中得到广泛的应用[23],抗氧化作用也引起关注。孙正博[24]系统地研究了啤酒酵母多糖对小鼠抗氧化活性的影响,表明酵母多糖能显著提高小鼠肝脏和血清中超氧化物歧化酶活性,并显著降低丙二醛含量,清除过氧化脂质降解产物,抑制氧自由基自氧化。本试验在红耳龟氧化应激后日粮中添加酵母多糖饲喂30 d,显著提高血清中过氧化氢酶活性、超氧化物歧化酶活性、谷胱甘肽过氧化物酶活性,丙二醛含量下降显著。与在凡纳滨对虾[10]饲料中添加酵母多糖可以显著提高凡纳对虾血清酚氧化酶、超氧化物歧化酶、超氧阴离子含量试验结果一致。说明酵母多糖作为抗氧化剂应用于龟鳖养殖可以增加清除自由基的能力,是提高抗氧化作用的有效途径。
综上所述,过氧化氢可以使红耳龟的生殖器官睾丸产生氧化应激,降低抗氧化酶活性和提高脂质过氧化程度,造成睾丸的生精上皮氧化损伤,酵母多糖可作为饲料添加剂缓解氧化应激损伤。

