基于耳石微结构的南海鸢乌贼日龄和生长研究
刘玉, 王雪辉, 杜飞雁, 刘必林, 张鹏, 刘梦娜,, 邱永松
海洋生物学
基于耳石微结构的南海鸢乌贼日龄和生长研究
刘玉1,2,3, 王雪辉1,3,4, 杜飞雁1,3, 刘必林2, 张鹏1,4, 刘梦娜1,2, 邱永松1
1. 中国水产科学研究院南海水产研究所, 广东 广州 510300; 2. 上海海洋大学海洋科学学院, 上海 201306; 3. 广东省渔业生态环境重点实验室, 广东 广州 510300; 4. 农业农村部外海渔业开发重点实验室,广东 广州 510300
年龄和生长速度等参数是渔业资源评估和管理的基础。鸢乌贼生命周期短、生长速度快。为研究鸢乌贼的日龄和生长, 利用2016年10月—2017年9月灯光罩网作业方式采集的南海鸢乌贼样本, 通过耳石微结构研究南海鸢乌贼不同种群、性别间的日龄组成和生长的差异, 结果表明: 1) 鸢乌贼中型群日龄范围48~125d, 优势日龄61~80d, 雌雄个体日龄组成差异显著; 微型群日龄范围44~95d, 优势日龄51~70d, 雌雄个体日龄组成差异极显著。2) 鸢乌贼中型群孵化时间为2016年7月—2017年7月, 1月和7—8月为孵化高峰期; 微型群孵化时间为2016年6—10月和12月至翌年2月, 1月和8月为孵化高峰期。3) 中型群雌雄胴长、体质量与日龄分别符合对数和线性关系; 微型群雌雄胴长与日龄分别符合对数和Logistic关系, 而体质量与日龄符合Logistic关系。4) 南海鸢乌贼微型群生长速度大于中型群, 微型群雄性个体生长速度大于雌性, 而中型群雄性个体生长速度小于雌性。通过对耳石生长纹的分析, 了解鸢乌贼的日龄组成、推算孵化时间、选出合适的生长方程及估算生长速度, 为渔业生物学提供基础资料。
鸢乌贼; 耳石; 日龄; 生长; 南海
鸢乌贼 ()隶属头足纲(Cephalopoda), 柔鱼科(Ommastrephidae), 鸢乌贼属(), 是广泛分布于印度洋、太平洋热带和亚热带海域的经济种类(董正之, 1991)。由于南海近海渔业资源的衰退, 人们纷纷寻求新的作业对象和渔场, 鸢乌贼作为其中最具典型的代表成为目前南海外海最具开发潜力的大洋性渔业资源之一。晏磊等(2004)对春季南海中南部海域的罩网渔获物进行分析, 发现鸢乌贼作为单一优势种占总渔获量的96%。李斌等(2016)通过声学方法并结合夏季调查的灯光罩网采样数据评估其南海资源量为2.36×106吨。
目前, 关于鸢乌贼的种群结构(陈新军等, 2007; 刘必林等, 2009; 张鹏等, 2015; 朱凯等, 2017)、摄食生态(Parry, 2006; 陆化杰等, 2014; 龚玉艳等, 2016)、繁殖特性(陆化杰等, 2014; Chembian et al, 2016)、资源评估(余景等, 2017; Wang et al, 2017)和渔场分布(田思泉等, 2006; 徐红云等, 2016)等方面已经有了较多的报道, 而有关年龄和生长的研究则主要集中在印度洋和太平洋海域(刘必林等, 2009; Liu et al, 2017)。年龄和生长的研究是渔业生物学的基本内容之一, 可为南海鸢乌贼资源的持续利用提供基础资料。耳石具有稳定的外部形态、清晰规则的生长纹等特点被应用于头足类年龄组成、生长及生活史等方面的研究中, 是头足类良好的生态信息载体(肖述等, 2003)。刘必林等(2009)基于印度洋西北部海域鸢乌贼的耳石微结构成功推测出其日龄。
已有的研究结果表明南海海域存在两个鸢乌贼种群, 即中型群和微型群(张鹏等, 2015), 且两种群之间的遗传差异达到了种间分化的水平(李敏等, 2019)。但目前有关南海鸢乌贼中型群和微型群日龄和生长等方面的研究较少, 仅有招春旭等(2017)和江艳娥等(2019)分别对春季南沙海域和南海北部海域、秋季南海海域鸢乌贼的相关研究。本文通过对全年灯光罩网采集的南海鸢乌贼样本进行生物学测定, 利用耳石微结构分别对其中型群和微型群的日龄和生长进行研究, 并分析不同种群、不同性别间的生长差异, 推断其孵化时间, 选择适合的生长方程描述不同群体的生长模式, 为今后深入了解南海鸢乌贼的生活史、估算种群数量和资源变动状况提供基础数据, 并为渔业管理积累基础资料。
1 材料与方法
1.1 材料来源
样品采集时间为2016年10~11月、2017年1~5月和2017年8~9月, 采集地点为中国南海海域110°—120°E、9°30′—22°30′N (图1)。样品通过灯光罩网捕获, 在各站位随机抽取100~200尾鸢乌贼, 冷冻保存后运至实验室进行生物学测定和相关实验分析, 同时记录各取样站位的地理坐标和捕捞时间。
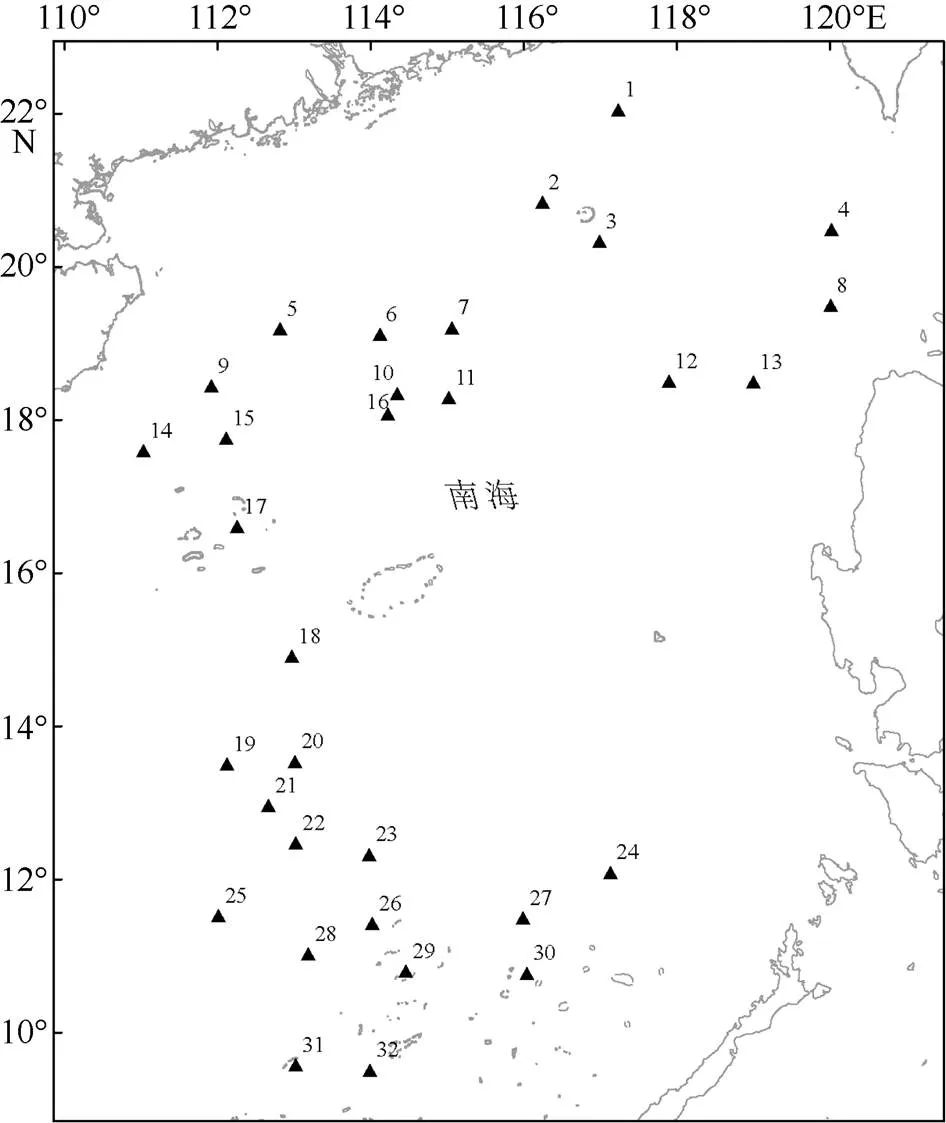
图1 样品采集站位示意图
1.2 研究方法
1.2.1 生物学测定
主要测定胴长(单位: mm)、体质量(单位: g)、性别、性腺成熟度等参数。长度精确至1mm, 体质量精确至0.01g(仪器: Y型精密电子天平; 分辨率=0.01g)。将鸢乌贼性腺成熟度划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ五期, 其中Ⅰ、Ⅱ为未成熟期, Ⅲ、Ⅳ、Ⅴ为成熟期(董正之, 1991)。中型群鸢乌贼背部具有发光器, 微型群鸢乌贼背部无发光器, 结合性腺发育的快慢, 将鸢乌贼分成中型和微型2个种群(张鹏等, 2015)。
1.2.2 耳石提取和研磨
耳石位于头足类头部后方的平衡囊内, 用镊子将耳石轻轻的从平衡囊内取出, 置于盛有95%酒精的1.5mL离心管中, 然后进行编号冷冻保存。将用于年龄鉴定的耳石放入长方形磨具中, 加入固化剂和压克力粉混匀后的冷凝树脂进行包埋, 并置于阴凉处待其硬化后进行研磨。在研磨机上先后以P120、P600、P1200、P2500等不同规格的防水耐磨砂纸进行研磨。研磨方向为耳石纵切面, 不断研磨至耳石核心。在完成耳石一面的研磨后, 重复以上过程完成另一面的研磨。将两面都研磨至核心的耳石切片用0.3µm氧化铝绒布进行抛光, 然后放入已标记的鳞片袋中(刘必林等, 2011)。
1.2.3 日龄读取
将研磨好的耳石切片置于Olympus光学显微镜(×400)下连续拍照, 然后采用PhotoShop5.0软件对图像进行后期处理。由耳石核心开始, 沿研磨平面方向读取日龄, 止于耳石边缘。耳石边缘轮纹数则根据最后一条清晰的轮纹宽度进行估算。每个耳石的日龄分别计数2次, 每次计数与均值的差值应低于5%, 否则再计数两次, 求平均值(Chen et al, 2011)。
1.3 数据分析
1.3.1 孵化时间推算
通过读取样本耳石的轮纹数, 结合捕捞时间, 推算孵化时间。
孵化时间估测(Liu et al, 2016): Hdate= Age− Cdate, (其中: Hdate为第个鸢乌贼个体的孵化时间, Age为第个鸢乌贼个体的生长日龄, Cdate为第个鸢乌贼个体的捕捞时间)。
1.3.2 生长模型
分别采用线性模型(刘必林等, 2009)、指数模型、幂函数模型(招春旭等, 2017)、对数模型(江艳娥等, 2019)和Logistic模型(Arkhipkin et al, 2000)拟合鸢乌贼的生长方程, 并根据AIC(Akaike’s Information Criterion)准则选择最佳模型(陈新军等, 2011)。
线性方程:=+(1)
指数方程:=e(2)
幂函数方程:=at(3)
对数方程:=ln()+(4)
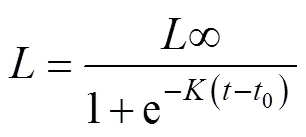
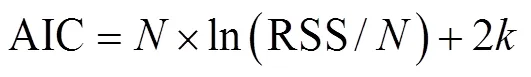
式中为胴长(或体重), 单位为mm(或g);为日龄, 单位为d;为常数;为样本数; RSS为残差平方和;为模型中参数个数,、、0为公式中的估算参数; e为自然常数。
1.3.3 生长率
采用瞬时相对生长率(instantaneous relative growth rate, IRGR)和绝对生长率(absolute growth rate, AGR)(陈新军等, 2011)来估算鸢乌贼的生长率。计算公式如下:
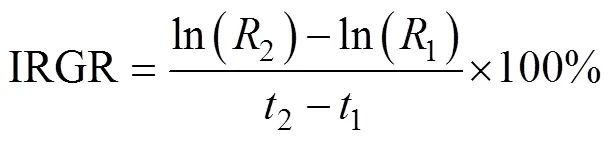
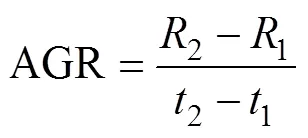
式中:1为1龄时的胴长或体质量, 单位为mm(或g);2为2龄时的胴长或体质量, 单位为mm(或g); AGR单位为mm×d-1(或g×d-1)。时间间隔D=2–1, 取值为10d。
1.4 统计分析
利用双因素方差分析不同种群和性别间的日龄组成差异, 利用协方差分析不同性别间的生长曲线差异, 分析软件采用SPSS 21.0。
2 结果
2.1 耳石微结构
鸢乌贼耳石生长纹是明暗相间的环形纹路, 起始于耳石核心(图2a), 终止于外围区(图2c)。耳石研磨平面似“耳蜗”状, 上半部轮纹疏散, 下半部轮纹紧密(图2d)。根据耳石生长纹间的宽度和亮度将研磨平面分为核心、后核心区、暗区、外围区四个部分。其中, 零轮以内的为核心, 亮度稍暗、形似“水滴”; 后核心区颜色较明亮, 轮纹间的宽度由窄变宽、轮纹纤细; 暗区颜色较深、不透明、轮纹间宽度不一; 外围区颜色明亮、略透明、轮纹排列紧密。四个区域间没有明显的分界线(图2)。
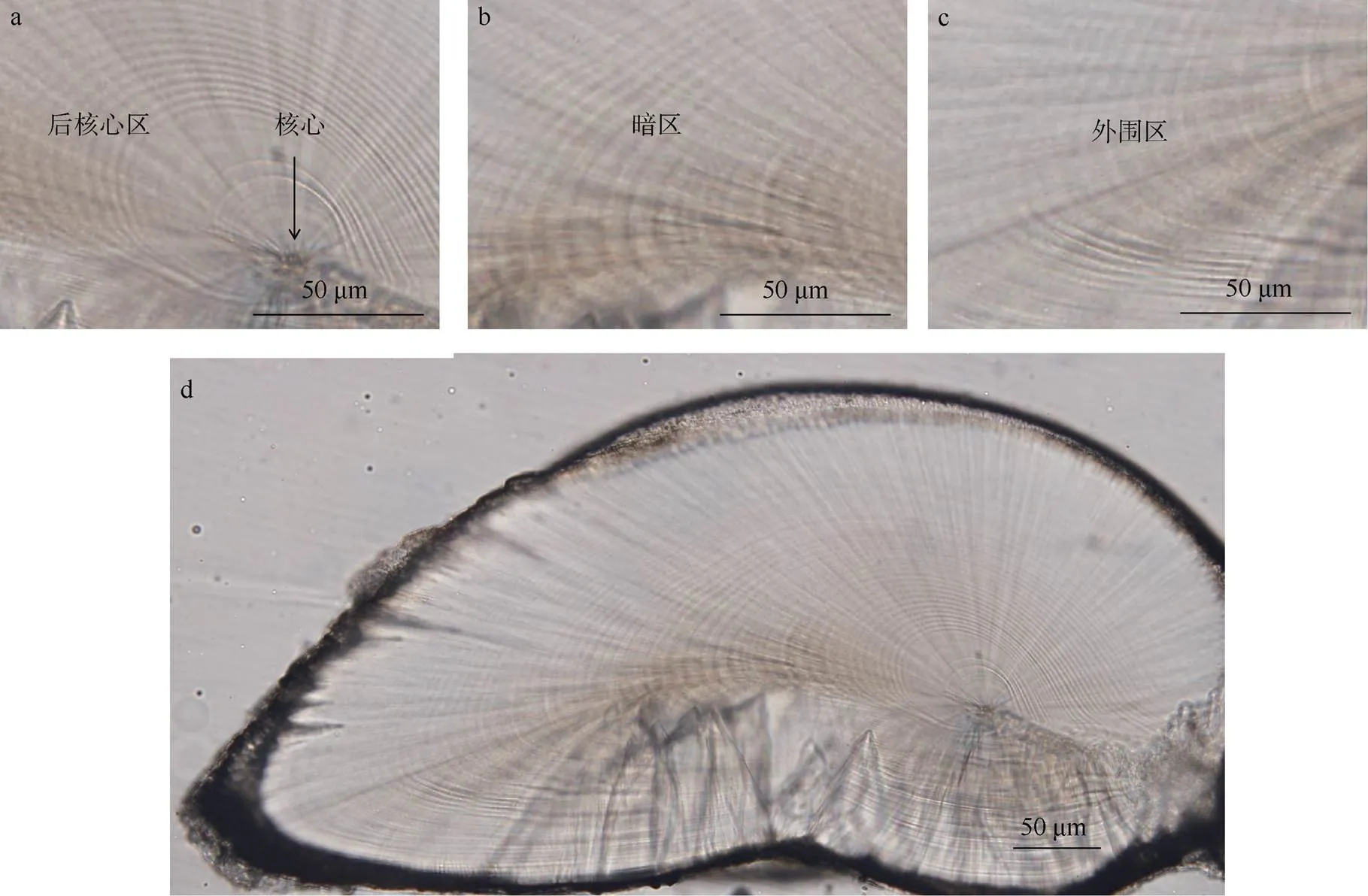
图2 南海鸢乌贼耳石微结构
a: 核心及后核心区; b: 暗区; c: 外围区; d: 拼接图: 雄性, 胴长132mm, 体重78.02g, 日龄78d
Fig. 2 Statolith microstructure of. a. Nucleus and post nuclear; b. dark zone; c. peripheral zone; d. a grinded and polished side statolith of immature male, mantle length 132 mm, body weight 78.02 g, age 78 days
2.2 日龄组成
鸢乌贼中型群获取耳石196枚(雌性113枚, 雄性83枚), 微型群获取耳石79枚(雌性46枚, 雄性33枚)。鸢乌贼中型群样本的日龄范围48~125d, 平均日龄76±12d, 优势日龄61~80d, 占其总体的61.20%(图3)。最小日龄个体胴长68mm、体质量9.07g; 最大日龄个体胴长189mm、体质量344.47g。鸢乌贼微型群样本的日龄范围44~95d, 平均日龄64±9d, 优势日龄51~70d, 占其总体的72.20%(图3)。最小日龄个体胴长57mm、体质量11.20g; 最大日龄个体胴长142mm、体质量132.03g。
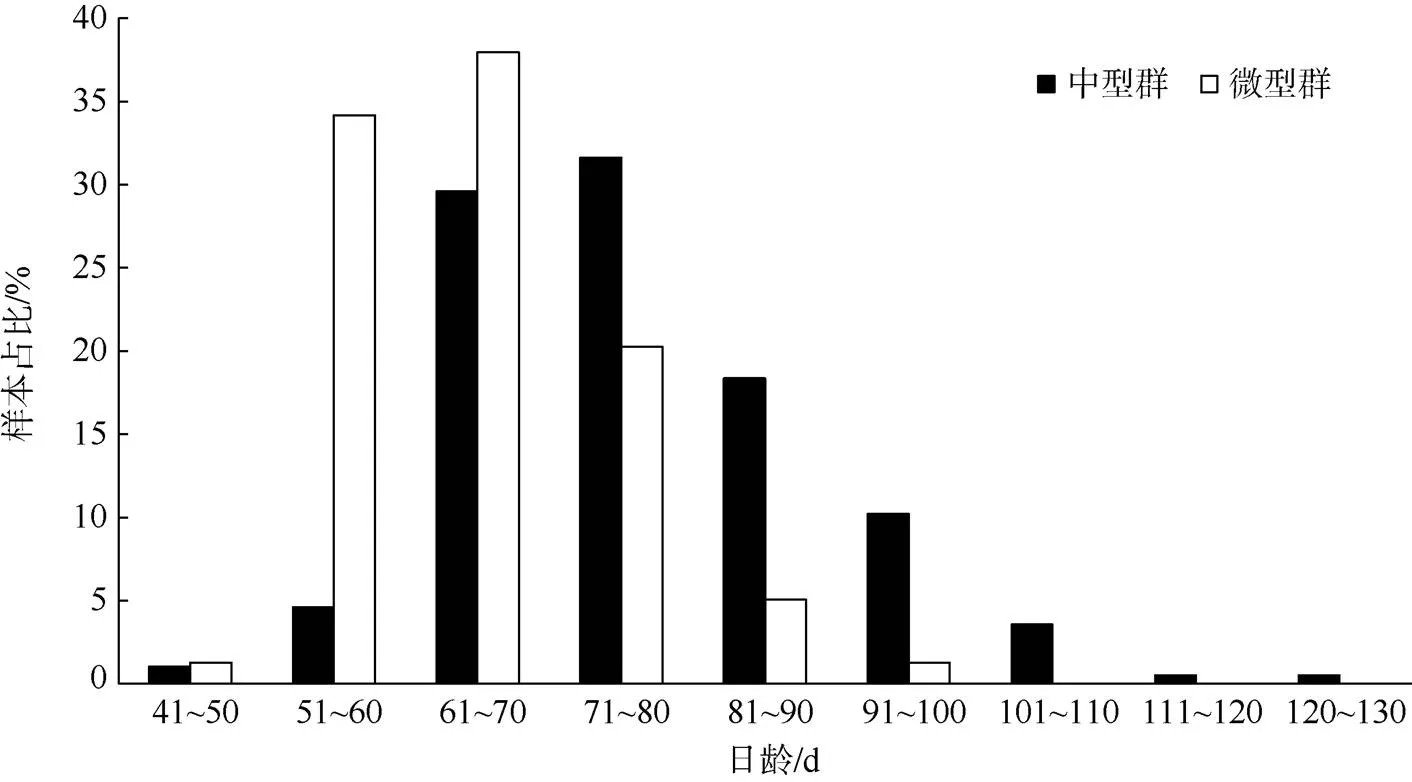
图3 南海鸢乌贼中型群和微型群日龄分布
方差分析显示, 鸢乌贼中型群雌、雄日龄组成差异显著(=0.04), 微型群雌、雄日龄组成差异极显著(<0.01)。中型群雌性日龄范围48~125d, 优势日龄61~80d, 占其总数的58.40%(图4); 雄性日龄范围48~119d, 优势日龄61~80d, 占其总数的65.10%(图4)。微型群雌性日龄范围52~95d, 优势日龄61~70d, 占其总数的45.70%; 雄性日龄范围44~84d, 优势日龄51~70d, 占其总数的84.80%(图5)。
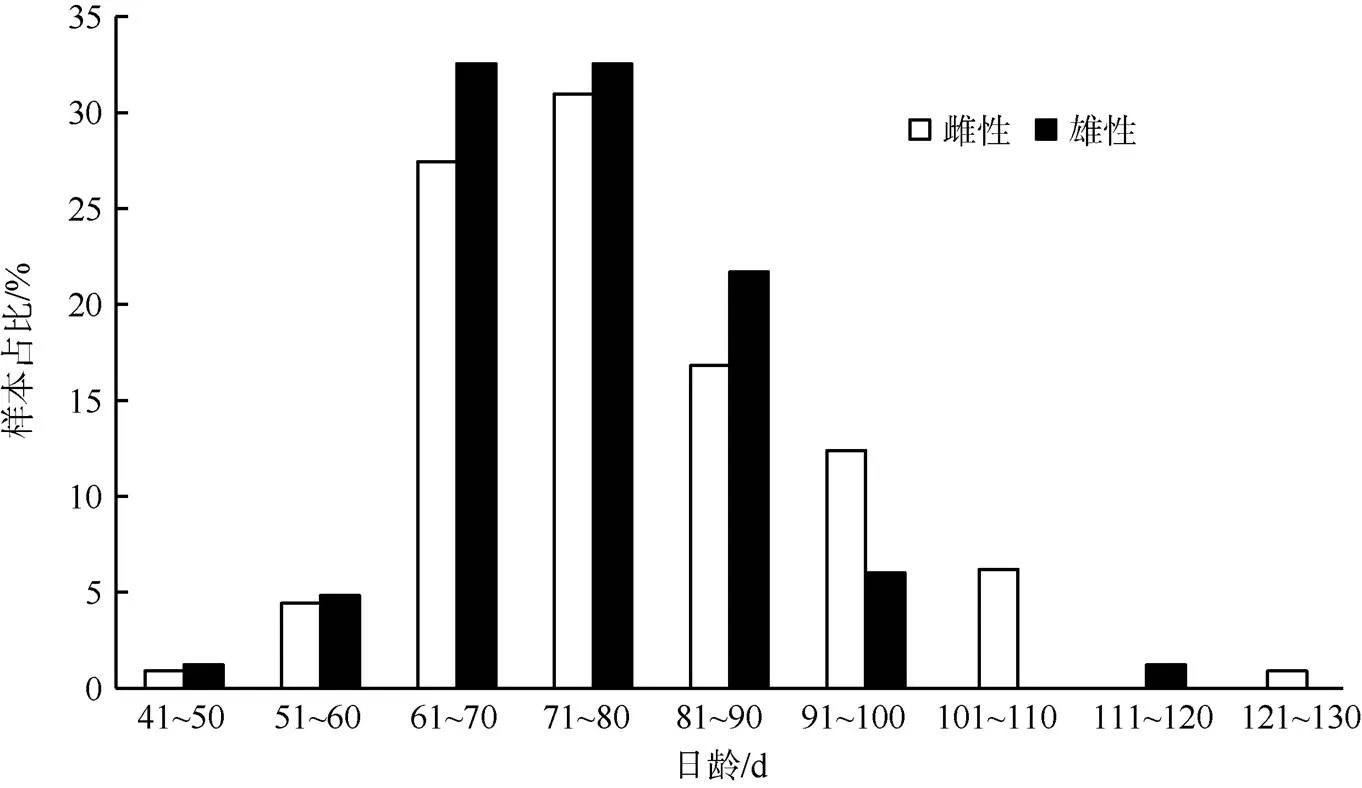
图4 鸢乌贼中型群雌雄个体日龄分布
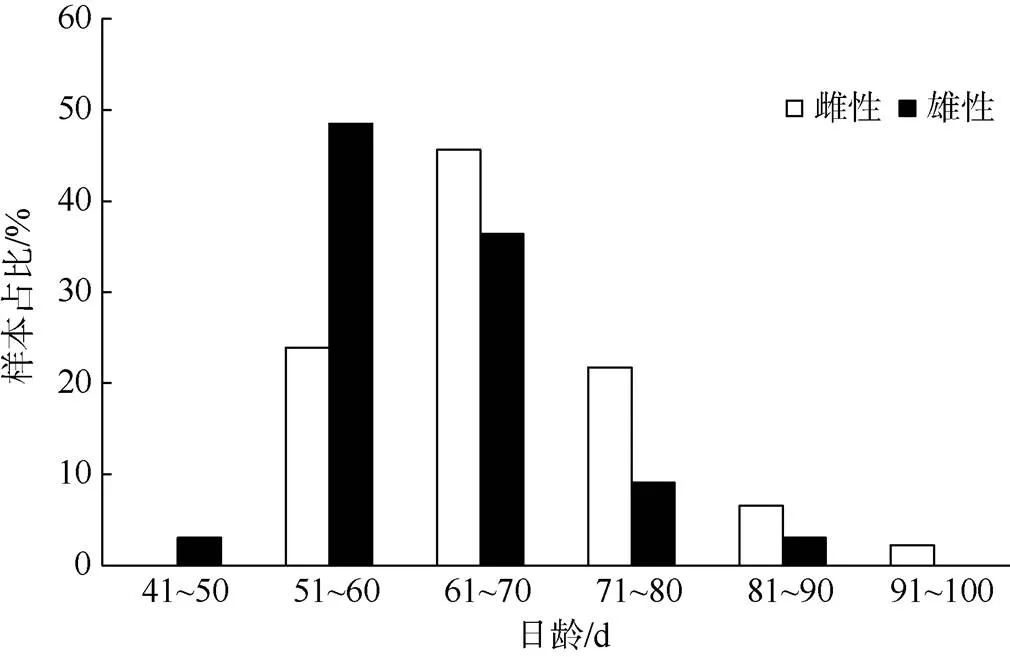
图5 鸢乌贼微型群雌雄个体日龄分布
根据采样时间将主要捕捞月份分为春季(3—5月)和秋季(9—11月)。
1) 中型群。3月渔获样本日龄范围56~101d, 优势日龄71~80d, 日龄范围最大, 存在日龄大于100d的个体。4月渔获样本日龄范围63~96d, 5月为60~97d, 优势日龄61~70d, 日龄大于100d的个体消失。9月渔获样本日龄范围61~98d, 优势日龄61~70d。10月渔获样本日龄范围63~108d、优势日龄为91~100d, 出现日龄大于100d的个体(图6)。
2) 微型群。3月渔获样本日龄范围55~84d, 优势日龄61~70d。4月为57~86d, 优势日龄71~80d。9月渔获样本日龄范围52~95d, 优势日龄61~70d。10月渔获样本日龄范围44~72d, 优势日龄51~60d。11月渔获样本日龄范围52~76d, 优势日龄51~60d(图7)。
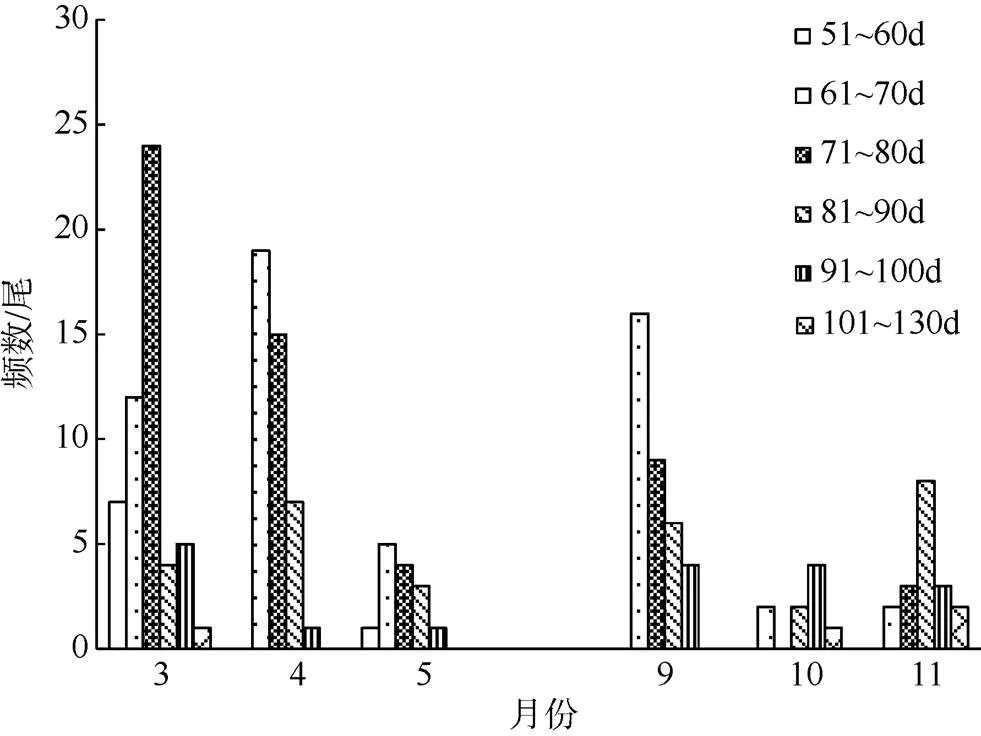
图6 春季和秋季鸢乌贼中型群个体日龄分布
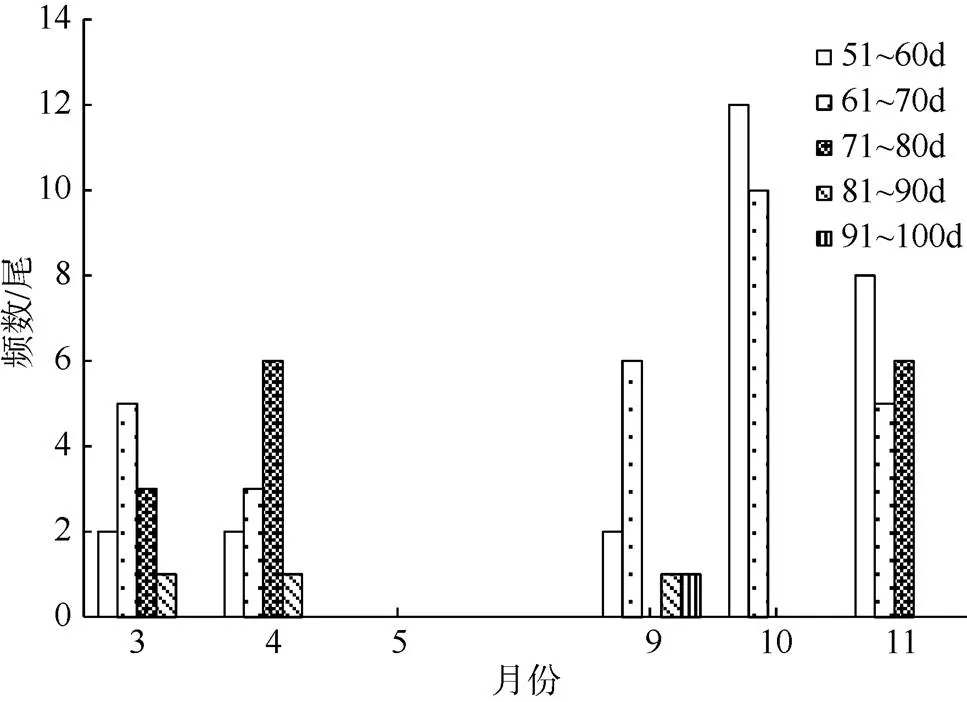
图7 春季和秋季鸢乌贼微型群个体日龄分布
2.3 孵化时间
鸢乌贼中型群样本的孵化时间为2016年7月—2017年7月, 除5月无孵化个体外, 几乎为全年性产卵。微型群样本的孵化时间为6—10月和12—2月。中型群的孵化高峰期为7—8月和1月, 分别占其总体的25.50%和34.20%; 微型群的孵化高峰期为8月和1月, 分别占其总体的39.20%和25.30% (图8)。
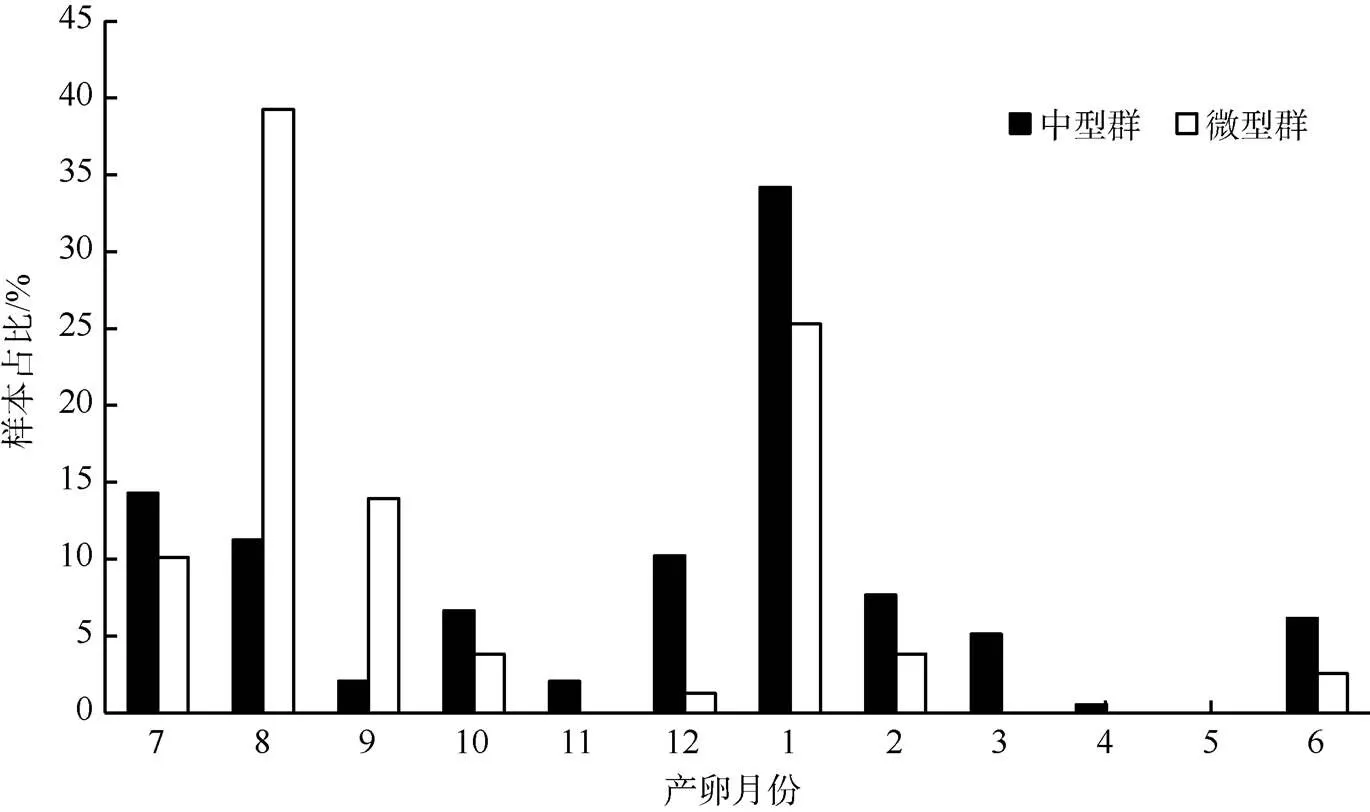
图8 南海鸢乌贼孵化时间分布图
2.4 生长模型
中型群雌、雄群体的胴长—日龄生长方程以对数模型最佳, 体质量—日龄生长方程以线性模型最佳(图9; 表1、2)。微型群雌、雄群体的胴长—日龄生长方程分别以对数模型和Logistic模型最佳, 体质量—日龄生长方程以Logistic模型最佳(图10; 表1、2)。经协方差分析检验, 雌、雄群体的生长曲线差异显著(<0.05)。
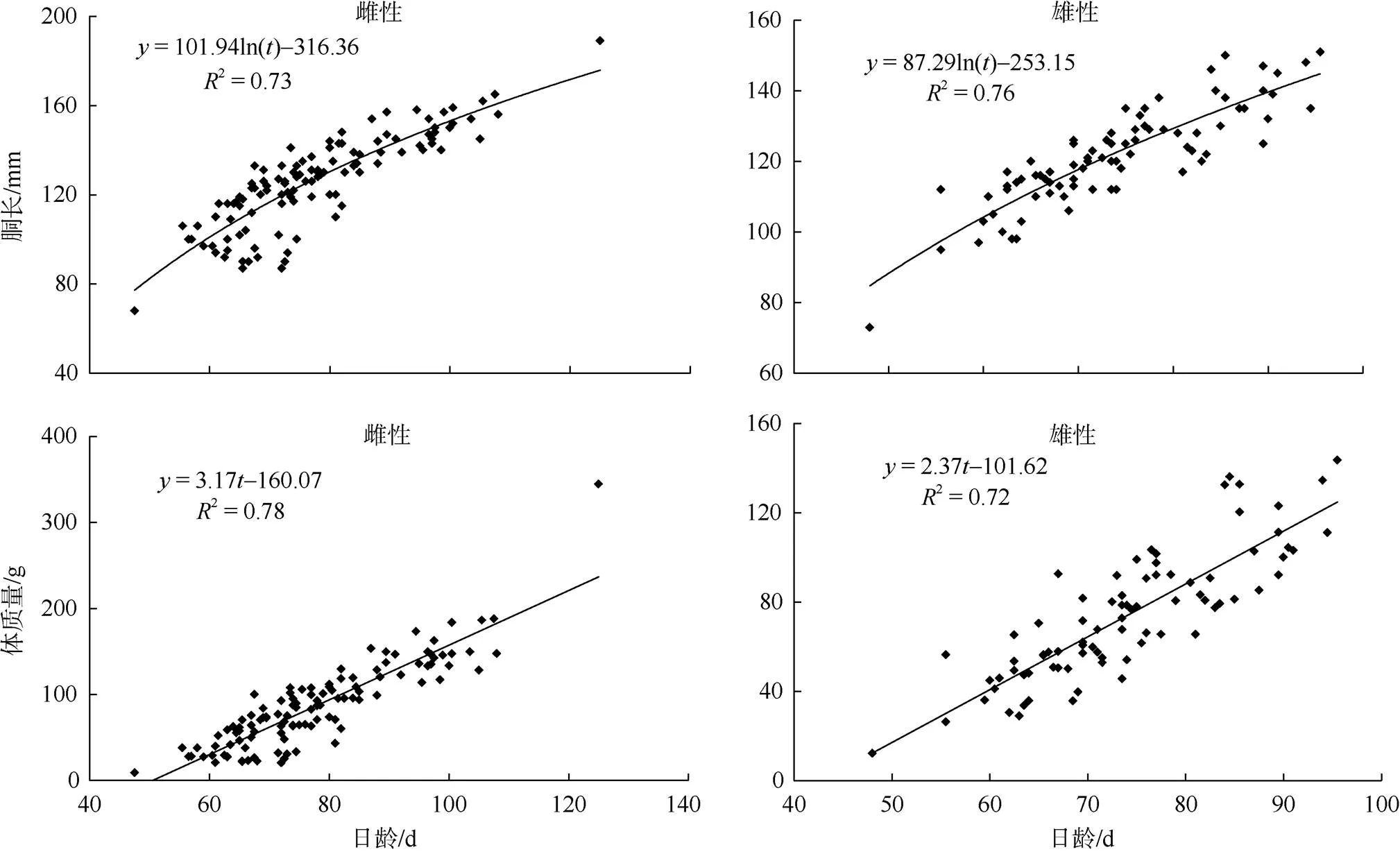
图9 南海鸢乌贼中型群胴长—日龄和体质量—日龄关系
式中表示时间, 单位为d;表示胴长或体质量, 单位为mm或g
Fig. 9 Changes of mantle length and body weight along with age of medium cohort
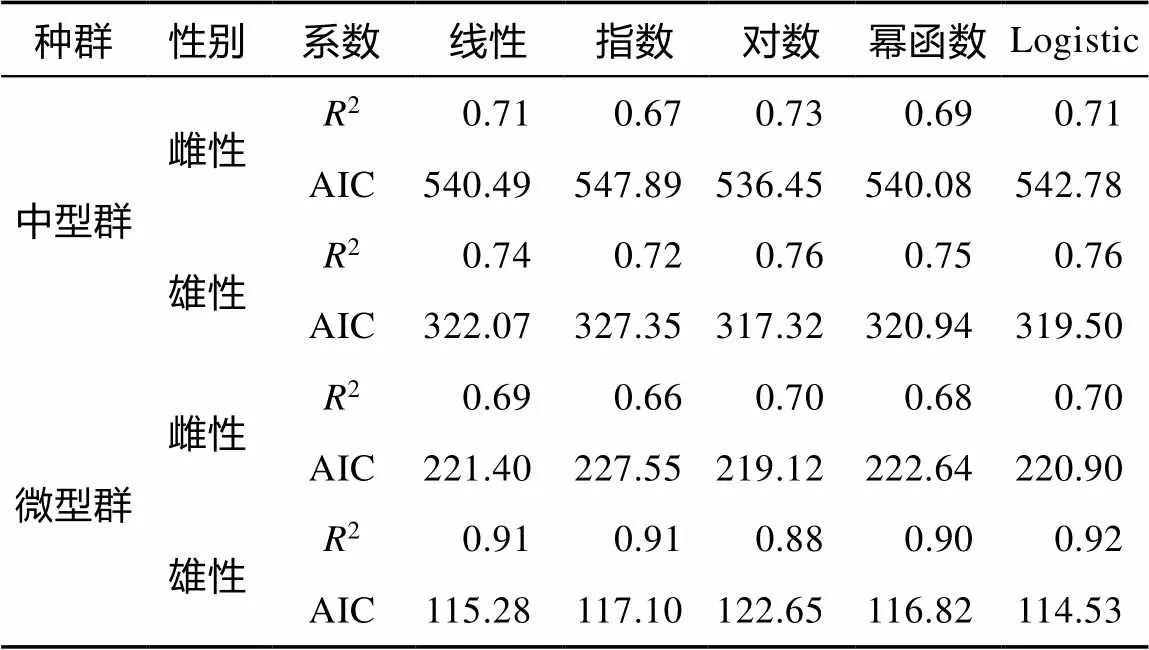
表1 鸢乌贼胴长生长方程的相关系数
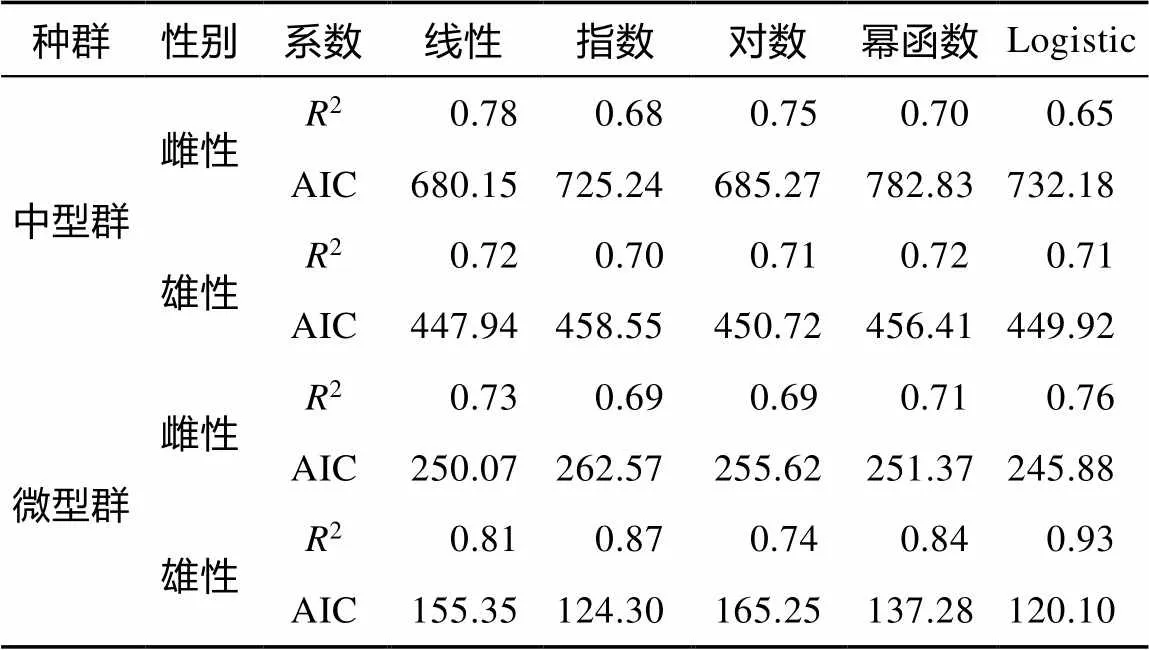
表2 鸢乌贼体质量生长方程的相关系数
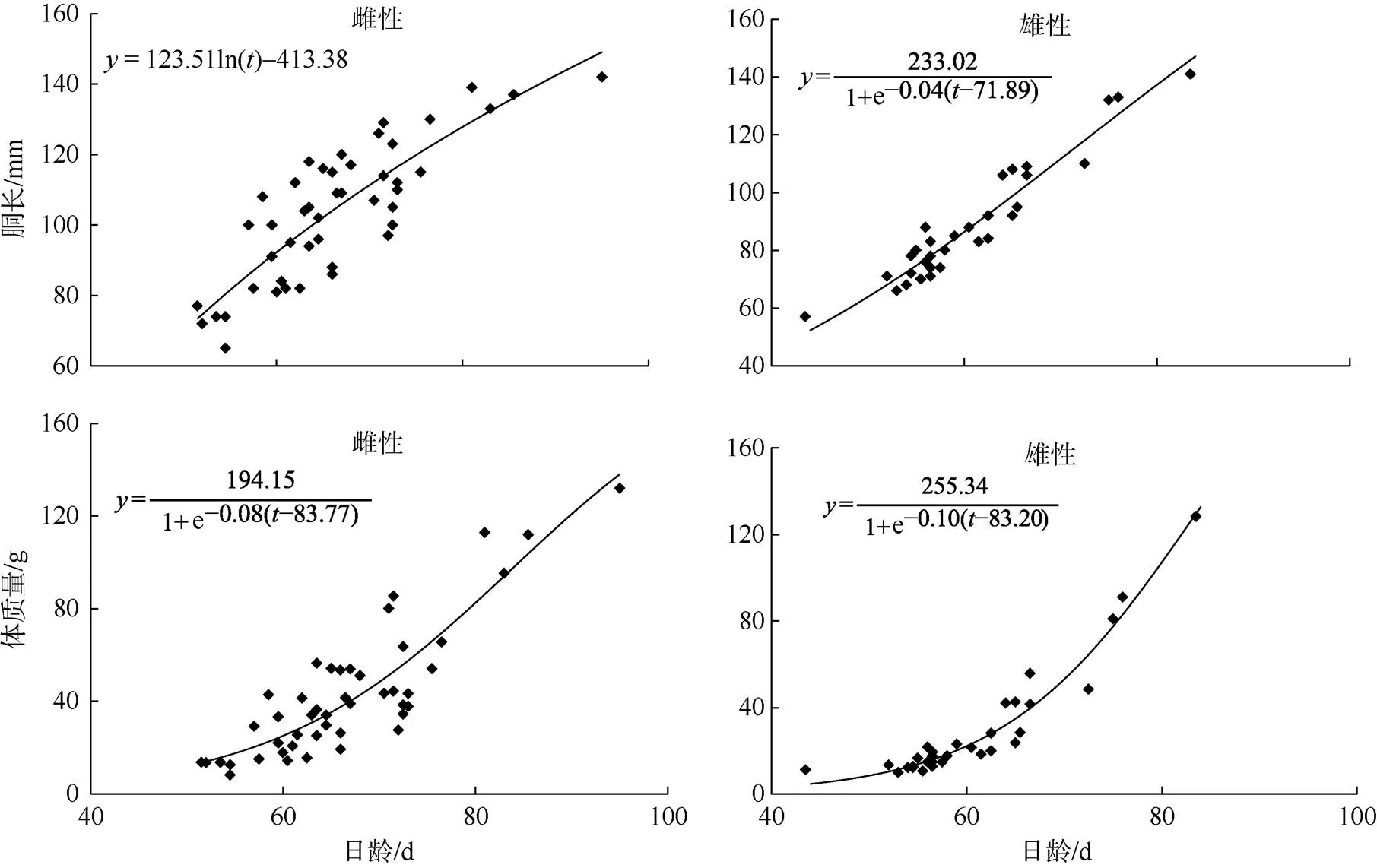
图10 南海鸢乌贼微型群胴长—日龄和体质量—日龄关系
2.5 生长速度
2.5.1 中型群生长率
南海鸢乌贼中型群雌性胴长IRGR范围0.59%~ 1.12%, AGR为0.80~1.30mm×d-1。体质量IRGR范围1.44%~4.52%, AGR为1.83~3.32g×d-1。雄性胴长IRGR范围0.54%~1.10%, AGR为0.70~1.30mm×d-1; 体质量IRGR范围1.86%~3.60%, AGR为1.21~ 2.32g×d-1。
雌、雄胴长AGR的变化趋势与IRGR较为一致, 雌性胴长生长速度整体上大于雄性(图11)。雌性体质量IRGR随着日龄增加整体呈减小趋势, 雄性体质量IRGR随时间变化先增加后减小, 雌、雄体质量AGR先增大后变小, 雌性体质量生长速度整体上大于雄性(图12)。
2.5.2 微型群生长率
南海鸢乌贼微型群的雌性胴长IRGR范围0.51%~1.94%, AGR为0.70~2.10mm×d-1; 体质量IRGR范围2.13%~7.28%, AGR为1.52~5.52g×d-1。雄性胴长IRGR范围1.70%~2.88%, AGR为1.90~ 2.30mm×d-1; 体质量IRGR范围3.11%~7.24%, AGR为0.41~6.45g×d-1。
雄性胴长IRGR的变化趋势与胴长AGR一致, 先增大后减小。雌性胴长IGRG整体呈减小的趋势, 胴长AGR先增加后减少。雄性胴长的生长速度整体大于雌性(图13)。雄性体质量IRGR与AGR呈现先减小后增加在减小的趋势。雌性体质量IRGR先增大后减小, 体质量AGR呈指数增加的趋势。雄性体质量的生长速度整体大于雌性(图14)。
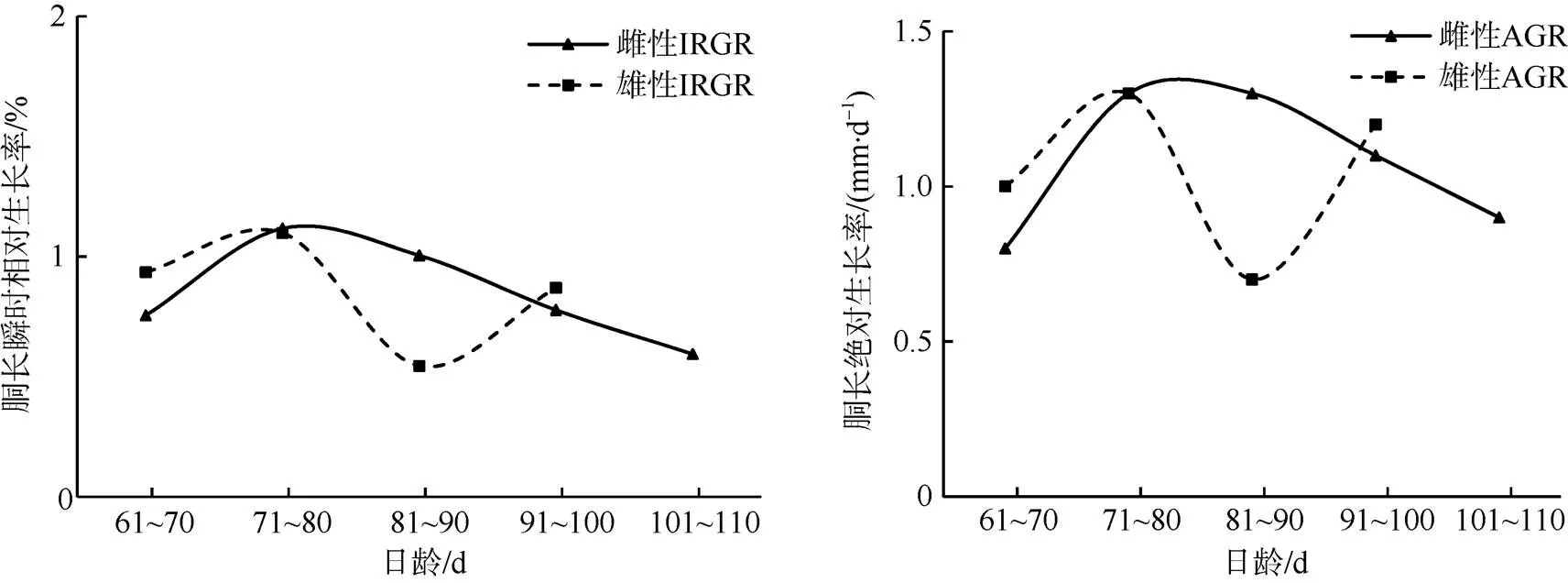
图11 南海鸢乌贼中型群雌雄个体胴长生长率
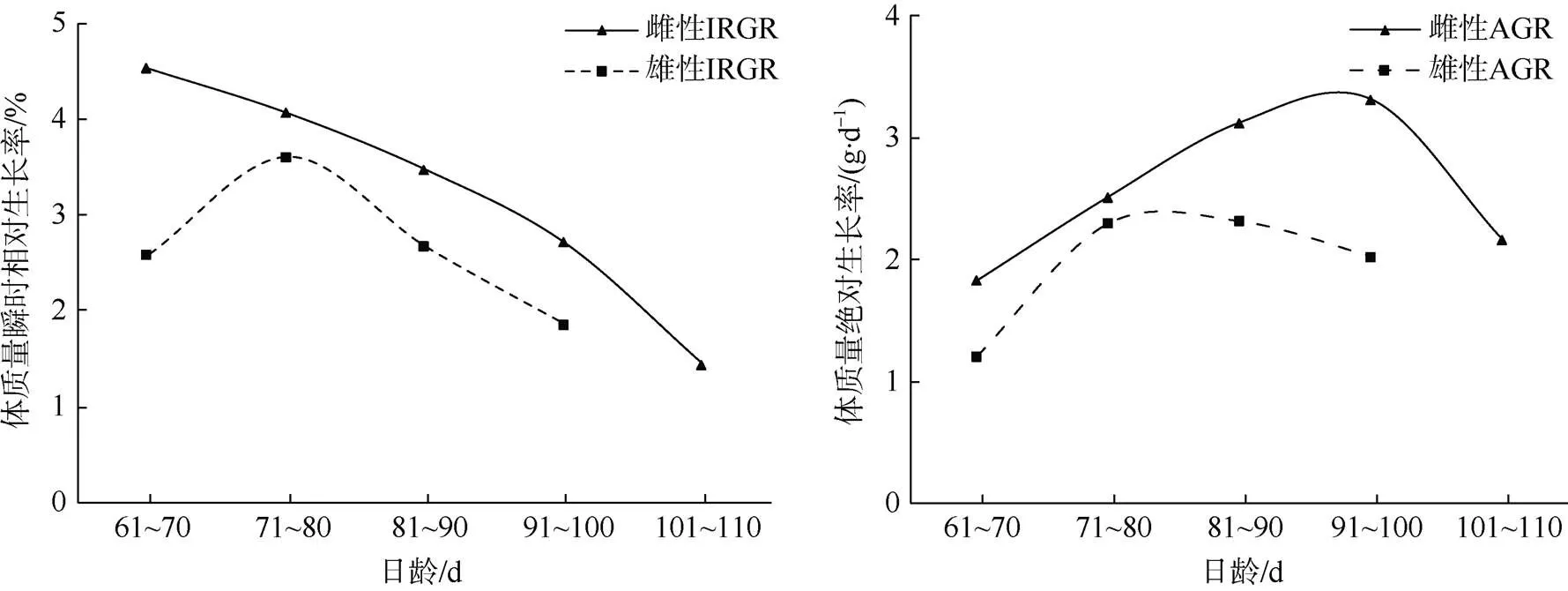
图12 南海鸢乌贼中型群雌雄个体体质量生长率
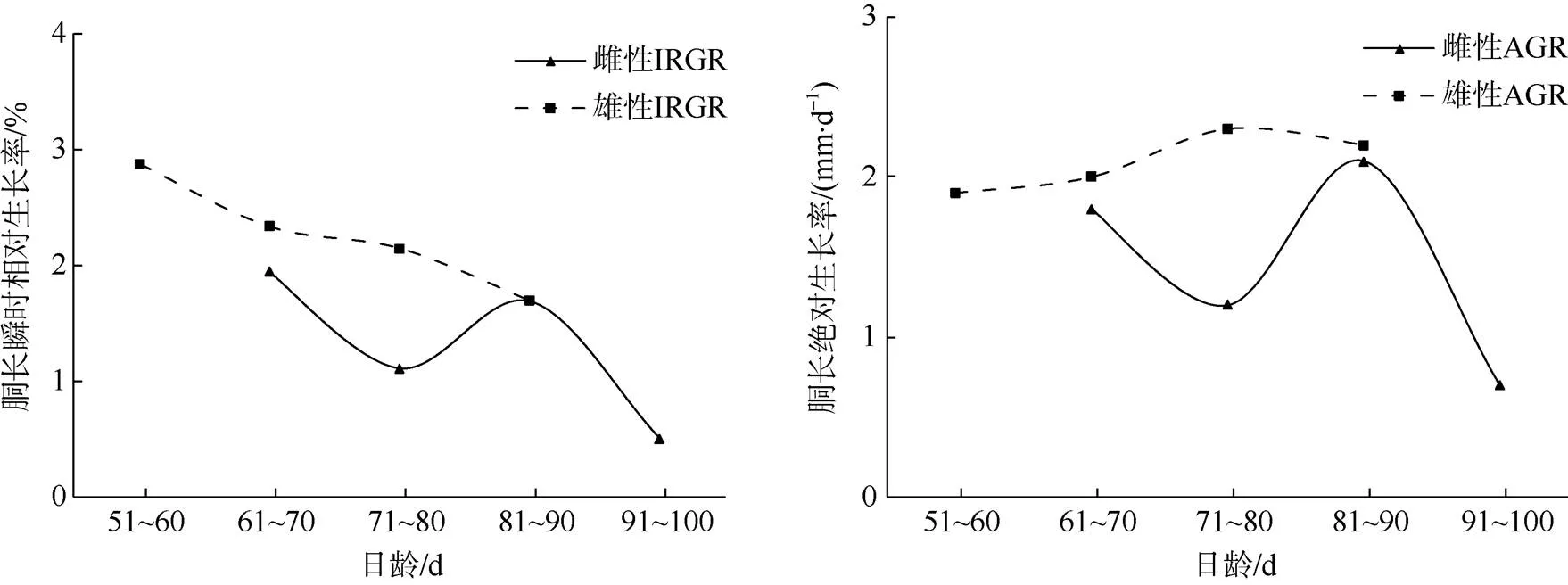
图13 南海鸢乌贼微型群雌雄个体胴长生长率
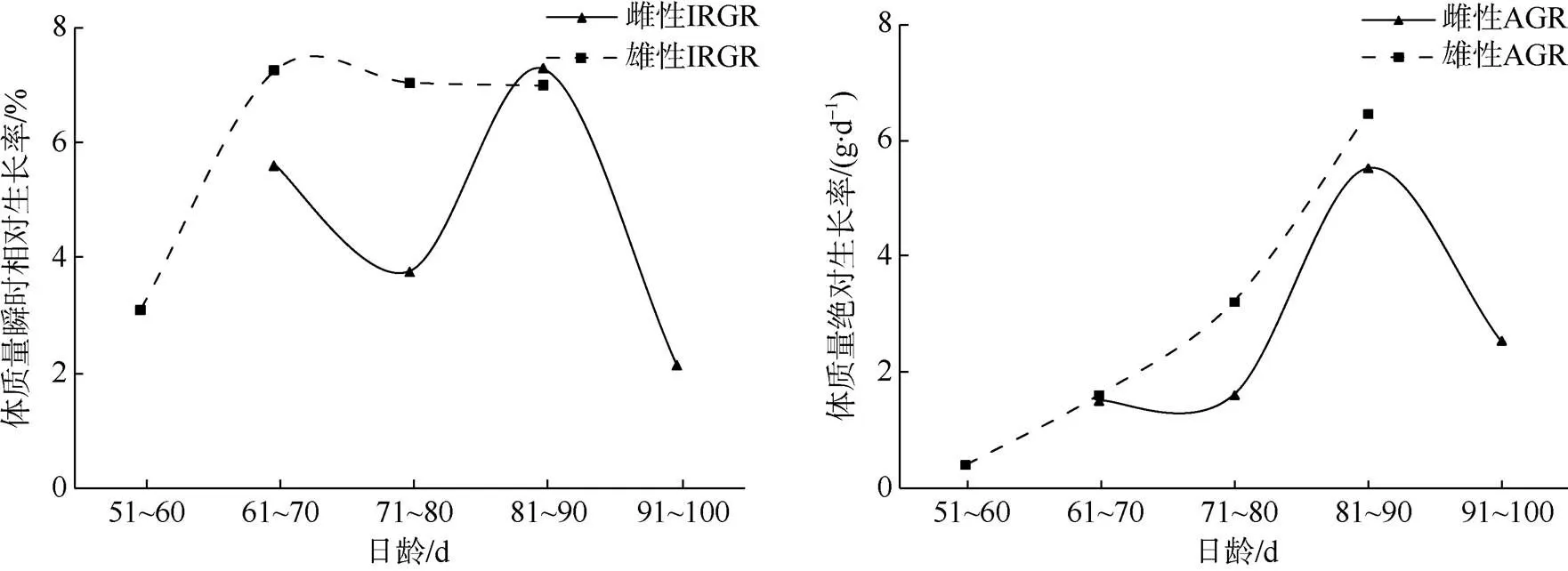
图14 南海鸢乌贼微型群雌雄个体体质量生长率
经方差分析表明, 鸢乌贼雌、雄生长速度无显著性差异(>0.05), 但在整体变化趋势上, 南海鸢乌贼微型群生长速度略大于中型群。中型群中雌性生长速度略大于雄性, 而微型群雌性生长速度略小于雄性。
3 讨论与分析
3.1 耳石研磨对日龄分析的影响
耳石研磨是一个复杂而精细的过程, 其研磨程度的大小及轮纹清晰度直接影响日龄鉴定的准确性和可靠性。头足类的耳石与鱼类相比甚小, 鸢乌贼的耳石长度只有1mm左右(刘必林等, 2008)。刘必林等(2009)利用耳石轮纹成功鉴定了印度洋西北海域鸢乌贼的日龄组成。Takagi等(2002a)研究了耳石研磨程度对太平洋褶柔鱼()日龄读取的影响, 发现未完全研磨的耳石轮纹计数平均差异为43d, 且很难读取; 完全研磨下, 计数之间只有4d的差异, 且差异可能是由耳石边缘区域轮纹数引起的。González等(2000)分别对同一滑柔鱼个体的耳石进行单面和双面研磨, 得出两种方法研磨出的耳石日龄数存在显著差异, 双面研磨效果较好。陆化杰等(2012a)对阿根廷滑柔鱼的耳石微结构进行研究, 发现耳石吻区的轮纹比较模糊, 轮纹的大小和间隔不均匀, 日龄读取困难, 耳石侧区和背区的轮纹清晰且排列整齐均匀, 易于日龄的计数。耳石研磨平面的选择决定了耳石区域的轮纹清晰度和轮距大小, 不同种类的耳石选择不同的研磨平面。纵截面研磨适合耳石吻区或背区生长纹清晰的种类(刘必林等, 2011), 因此鸢乌贼耳石一般选择背区作为研磨平面, 沿纵截面方向研磨, 分别由翼区、侧区两面向中间研磨至核心。横截面研磨以侧区(生长纹清晰)作为研磨平面, 从耳石上下两端研磨至核心处, Lipinski等(1998)采用了横截面研磨方法读取好望角枪乌贼()的耳石生长纹。
3.2 日龄组成分析
鸢乌贼具有生命周期短、生长速度快等特点, 其生命周期约为1年(刘必林等, 2009)。本研究结果表明南海鸢乌贼样本的最大日龄仅4个月左右。Takagi等(2002b)分析了太平洋海域鸢乌贼的年龄和生长, 得出其最大日龄在180d左右, 而印度洋西北海域鸢乌贼的日龄范围为88~363d(刘必林等, 2009)。不同海域鸢乌贼的日龄组成存在较大的差异, 原因可能是不同地理空间的生物因素(饵料丰度、天敌等)和环境因素(温度、盐度等)有较大差异造成的。Liu等(2013)研究发现秘鲁和智利海域的茎柔鱼()寿命大于哥斯达黎加海域, 并认为是由空间差异引起的。另外, 采样作业方式的不同也会对结果产生较大影响。一般情况下, 通过鱿钓作业所捕获的鸢乌贼胴长较大, 而灯光罩网的网目较小, 其选择性较差, 捕获的鸢乌贼胴长大小较为全面(颜云榕等, 2012)。鸢乌贼中型群雌、雄样本的最大日龄分别为125d和119d、平均日龄分别为77d和74d, 微型群雌、雄样本的最大日龄分别为95d和84d、平均日龄分别为66d和61d。雌性个体的寿命大于雄性个体, 这与Takagi等(2002b)对太平洋海域鸢乌贼的研究结果一致。在春、秋季捕捞季节中, 中型群3月和10月的优势日龄较大, 随后降低, 微型群4月和9月优势日龄较大, 随后降低。原因可能是3、4月和9、10月的鸢乌贼在冬季及休渔期间捕捞压力较小, 有着较好的发育环境。而随后优势日龄降低, 是由于春、秋季前期的捕捞压力过大, 日龄较大、胴长较长的个体被过渡捕获导致的。招春旭等(2017)推算南海春季鸢乌贼中型群和微型群的孵化高峰期分别为1—3月和3月, 江艳娥等(2019)推测南海鸢乌贼中型群和微型群的产卵高峰期分别为8月和7月。本研究中, 南海海域鸢乌贼中型群的孵化高峰期为1月和7—8月, 微型群的孵化高峰期为1月和8月, 与两位学者的研究结果较为一致。
3.3 生长速度与模型分析
不同的生长阶段, 鸢乌贼的生长速度不同, 且不同群体和性别间存在较大的差异。影响鸢乌贼生长速度变化的因素主要有食物、捕食者、水温、盐度、光照等(刘必林等, 2009)。另外, 自身的生理变化也会导致生长速度的差异, 70d和90d是中型群雌雄个体胴长生长速度差值的转折点, 颜云榕等(2012)研究表明南沙鸢乌贼雌性个体出现两个性腺发育高峰期, 即101~120mm和161mm以上胴长组。而此时胴长对应的日龄分别为60d和100d左右, 因此这一生长阶段中型群雌、雄个体胴长生长率发生转变的原因可能与当时的性腺发育有关。陈新军等(2011)分析认为柔鱼的生长与性腺发育密切相关, 早期生长阶段获取的营养物质主要用于个体的生长, 性成熟后吸收的营养物质主要用于性腺的发育。鸢乌贼具有昼夜垂直移动的特点, 不同的生长阶段栖息在不同的水层, 良好的索饵条件和生存空间决定了鸢乌贼的生长速度。本研究结果表明南海鸢乌贼中型群雌性的生长速度略大于雄性, 微型群雌性的生长速度略小于雄性, 微型群的生长速度略大于中型群。江艳娥等(2019)研究表明微型群雌性性成熟和产卵高于中型群雌性, 与本文结果相对应。招春旭等(2017)分析认为南海北部海域鸢乌贼的生长速度与南沙海域的不同。陆化杰等(2012b)分析认为同一日龄段内, 阿根廷滑柔鱼雌性的生长率大于雄性。因此, 头足类不同种群、不同性别及不同地理区域间的生长速度均有差异, 导致这一现象的原因可能与自身的遗传发育特性有关, 可从基因方面分析其存在差异的原因。
由于头足类的年龄和生长受到生物、环境及地理空间等诸多因素的影响, 所以头足类的生长方程需要采用不同的生长模型拟合。目前关于鸢乌贼的生长模型研究主要有线性模型、指数模型、对数模型、幂函数模型等。Takagi等(2002b)研究发现推算的理论生长曲线与雌性、雄性仔鱼、稚鱼的实际数据非常吻合, 但是日龄小于50d, 成鱼生长方程推算的理论生长曲线与实际数据不吻合。Markaida等(2004)研究表明逻辑斯蒂生长模型更适合用来描述大型鱿鱼的生长。Liu等(2013)分析认为线性模型能更好的拟合某一生长阶段(成鱼)的生长, 而非线性生长方程则适合描述整个生命周期内的生长。招春旭等(2017)分析认为南海鸢乌贼中型群适合指数生长模型, 微型群则适合幂函数生长模型。江艳娥等(2019)研究认为鸢乌贼胴长与日龄适合对数函数模型, 体质量与日龄适合二次函数模型。本研究中鸢乌贼中、微型群雌性群体的胴长日龄关系均符合对数模型, 但存在显著性差异; 中、微型群的体质量日龄关系分别符合线性和逻辑斯蒂模型, 与不同种群的生长速度存在差异相互印证。头足类分布范围广且具有洄游特性, 在其生活史中有一次或者多次洄游; 鸢乌贼一年多次产卵, 不同产卵群体叠加, 导致渔获群体结构复杂(刘必林等, 2009); 另外海洋环境复杂, 不同性成熟期及不同性别的鸢乌贼生活在不同的外部海洋环境中, 其生长发育不均衡, 上述因素都会对研究结果产生较大的影响。
陈新军, 刘金立, 2007. 利用形态学方法分析印度洋西北部海域鸢乌贼种群结构[J]. 上海水产大学学报, 16(2): 174–179. CHEN XINJUN, LIU JINLI, 2007. Morphological analysis on population structure ofin the northwestern Indian Ocean[J]. Journal of Shanghai Fisheries University, 16(2): 174–179 (in Chinese with English abstract).
陈新军, 马金, 刘必林, 等, 2011. 基于耳石微结构的西北太平洋柔鱼群体结构、年龄与生长的研究[J]. 水产学报, 35(8): 1191–1198. CHEN XINJUN, MA JIN, LIU BILIN, et al, 2011. Population structure, age and growth of neon flying squid () in the northwest Pacific Ocean based on statolith microstructure[J]. Journal of Fisheries of China, 35(8): 1191–1198 (in Chinese with English abstract).
董正之, 1991. 世界大洋经济头足类生物学[M]. 济南: 山东科学技术出版社: 17–94. DONG ZHENGZHI, 1991. Biology of the economic species of cephalopods in the world oceans[M]. Jinan: Shandong Science and Technology Press: 17–94 (in Chinese with English abstract).
龚玉艳, 詹凤娉, 杨玉滔, 等, 2016. 南海鸢乌贼摄食习性的初步研究[J]. 南方水产科学, 12(4): 80–87. GONG YUYAN, ZHAN FENGPING, YANG YUTAO, et al, 2016. Feeding habits ofin the South China Sea[J]. South China Fisheries Science, 12(4): 80–87(in Chinese with English abstract).
江艳娥, 陈作志, 林昭进, 等, 2019. 南海海域鸢乌贼中型群与微型群渔业生物学比较[J]. 水产学报, 43(2): 454–466. JIANG YAN’E, CHEN ZUOZHI, LIN ZHAOJIN, et al, 2019. Comparison of fishery biology between medium-form and dwarf-form ofin South China Sea[J]. Journal of Fisheries of China, 43(2): 454–466 (in Chinese with English abstract).
李斌, 陈国宝, 郭禹, 等, 2016. 南海中部海域渔业资源时空分布和资源量的水声学评估[J]. 南方水产科学, 12(4): 28–37. LI BIN, CHEN GUOBAO, GUO YU, et al, 2016. Hydroacoustic assessment of spatial-temporal distribution and biomass of fishery resources in the central South China Sea[J]. South China Fisheries Science, 12(4): 28–37 (in Chinese with English abstract).
李敏, 张鹏, 张俊, 等, 2019. 南海鸢乌贼的遗传差异: 种群分化还是种间分化[J]. 中国水产科学, 26(1): 133–140. LI MIN, ZHANG PENG, ZHANG JUN, et al, 2019. Genetic differentiation of the purpleback flying squid,, in the South China Sea: population or species divergence[J]. Journal of Fishery Sciences of China, 26(1): 133–140 (in Chinese with English abstract).
刘必林, 陈新军, 钟俊生, 2008. 印度洋西北海域鸢乌贼耳石的形态特征分析[J]. 上海水产大学学报, 17(5): 604–609. LIU BILIN, CHEN XINJUN, ZHONG JUNSHENG, et al, 2008. Statolith morphology of the purpleback flying squidin the northwest Indian Ocean[J]. Journal of Shanghai Fisheries University, 17(5): 604–609 (in Chinese with English abstract).
刘必林, 陈新军, 钟俊生, 2009. 采用耳石研究印度洋西北海域鸢乌贼的年龄、生长和种群结构[J]. 大连水产学院学报, 24(3): 206–212. LIU BILIN, CHEN XINJUN, ZHONG JUNSHENG, 2009. Age, growth and population structure of squidin northwest Indian Ocean by statolith microstructure[J]. Journal of Dalian Fisheries University, 24(3): 206–212 (in Chinese with English abstract).
刘必林, 陈新军, 陆化杰, 等, 2011. 头足类耳石[M]. 北京: 科学出版社: 28–30.
陆化杰, 陈新军, 方舟, 等, 2012a. 西南大西洋阿根廷滑柔鱼耳石微结构及生长特性[J]. 渔业科学进展, 33(3): 15–25. LU HUAJIE, CHEN XINJUN, FANG ZHOU, et al, 2012a. Statolith microstructure and growth characteristics ofin the Southwest Atlantic Ocean[J]. Progress in Fishery Sciences, 33(3): 15–25 (in Chinese with English abstract).
陆化杰, 陈新军, 2012b. 利用耳石微结构研究西南大西洋阿根廷滑柔鱼的日龄、生长与种群结构[J]. 水产学报, 36(7): 1049–1056. LU HUAJIE, CHEN XINJUN, 2012b. Age, growth and population structure ofbased on statolith microstructure in Southwest Atlantic Ocean[J]. Journal of Fisheries of China, 36(7): 1049–1056 (in Chinese with English abstract).
陆化杰, 王从军, 陈新军, 2014. 4–6月东太平洋赤道公海鸢乌贼生物学特性初步研究[J]. 上海海洋大学学报, 23(3): 441–447. LU HUAJIE, WANG CONGJUN, CHEN XINJUN, 2014. Preliminary study on the biological characteristics ofin the high seas nearby the equator of eastern Pacific during April to June[J]. Journal of Shanghai Ocean University, 23(3): 441–447 (in Chinese with English abstract).
田思泉, 陈新军, 杨晓明, 2006. 阿拉伯北部公海海域鸢乌贼渔场分布及其与海洋环境因子关系[J]. 海洋湖沼通报, (1): 51–57. TIAN SIQUAN, CHEN XINJUN, YANG XIAOMING, 2006. Study on the fishing ground distribution ofand its relationship with the environmental factors in the high sea of the northern Arabian sea[J]. Transactions of Oceanology and Limnology, (1): 51–57 (in Chinese with English abstract).
肖述, 郑小东, 王如才, 等, 2003. 头足类耳石轮纹研究进展[J]. 中国水产科学, 10(1): 73–78. XIAO SHU, ZHENG XIAODONG, WANG RUCAI, et al, 2003. Current status and prospects of the research on increments of statoliths in Cephalopods[J]. Journal of Fishery Sciences of China, 10(1): 73–78 (in Chinese with English abstract).
徐红云, 崔雪森, 周为峰, 等, 2016. 基于海洋遥感的南海外海鸢乌贼最适栖息环境分析[J]. 生态学杂志, 35(11): 3080–3085. XU HONGYUN, CUI XUESEN, ZHOU WEIFENG, et al, 2016. Analysis on optimal habitats of purpleback flying squid in the open South China Sea based on remote sensing data[J]. Chinese Journal of Ecology, 35(11): 3080–3085 (in Chinese with English abstract).
晏磊, 张鹏, 杨吝, 等, 2014. 2011年春季南海中南部海域灯光罩网渔业渔获组成的初步分析[J]. 南方水产科学, 10(3): 97–103. YAN LEI, ZHANG PENG, YANG LIN, et al, 2014. Catch composition of light falling-net fishery in the central and southern South China Sea in spring of 2011[J]. South China Fisheries Science, 10(3): 97–103 (in Chinese with English abstract).
颜云榕, 冯波, 卢伙胜, 等, 2012. 南沙群岛北部海域鸢乌贼()夏季渔业生物学研究[J]. 海洋与湖沼, 43(6): 1177–1186. YAN YUNRONG, FENG BO, LU HUOSHENG, et al, 2012. Fishery biology of purpleback flying squidin northern sea areas around Nansha Islands in summer[J]. Oceanologia et Limnologia Sinica, 43(6): 1177–1186 (in Chinese with English abstract).
余景, 胡启伟, 李纯厚, 等, 2017. 西沙-中沙海域春季鸢乌贼资源与海洋环境的关系[J]. 海洋学报, 39(6): 62–73. YU JING, HU QIWEI, LI CHUNHOU, et al, 2017. Relationship between theresource and environmental factors in the Xisha-Zhongsha waters in spring[J]. Acta Oceanologica Sinica, 39(6): 62–73 (in Chinese with English abstract).
张鹏, 晏磊, 杨炳忠, 等, 2015. 春季南沙海域鸢乌贼种群结构特征的研究[J]. 南方水产科学, 11(5): 11–19. ZHANG PENG, YAN LEI, YANG BINGZHONG, et al, 2015. Population structure of purpleback flying squid () in Nansha Area in spring[J]. South China Fisheries Science, 11(5): 11–19 (in Chinese with English abstract).
招春旭, 陈昭澎, 何雄波, 等, 2017. 基于耳石微结构的南海春季鸢乌贼日龄、生长与种群结构的研究[J]. 水生生物学报, 41(4): 884–890. ZHAO CHUNXU, CHEN ZHAOPENG, HE XIONGBO, et al, 2017. Age, growth and population structure of purple back flying squid,in the South China Sea in spring based on statolith microstructure[J]. Acta Hydrobiologica Sinica, 41(4): 884–890 (in Chinese with English abstract).
朱凯, 杜飞雁, 王雪辉, 等, 2017. 南海中南部鸢乌贼中型群群体结构[J]. 应用生态学报, 28(4): 1370–1376. ZHU KAI, DU FEIYAN, WANG XUEHUI, et al, 2017. Morphological variations and discrimination of medium form of the purple flying squidin the central and southern South China Sea[J]. Chinese Journal of Applied Ecology, 28(4): 1370–1376 (in Chinese with English abstract).
ARKHIPKIN A I, LAPTIKHOVSKY V V, 2000. Age and growth of the squid(Cephalopoda: Ommastrephidae) on the North-West African shelf[J]. Journal of the Marine Biological Association of the United Kingdom, 80(4): 747–748.
CHEMBIAN A J, MATHEW S, 2016. Growth and mortality of the oceanic squid(Lesson, 1830) off the South-West Coast of India[J]. Indian Journal of Fisheries, 63(1): 27–34.
CHEN XINJUN, LU HUAJIE, LIU BILIN, et al, 2011. Age, growth and population structure of jumbo flying squid,, based on statolith microstructure off the Exclusive Economic Zone of Chilean waters[J]. Journal of the Marine Biological Association of the United Kingdom, 91(1): 229–235.
GONZÁLEZ A F, DAWE E G, BECK P C, et al, 2000. Bias associated with statolith-based methodologies for ageing squid; a comparative study on(Cephalopoda: Ommastrephidae)[J]. Journal of Experimental Marine Biology and Ecology, 244(2): 161–180.
LIPINSKI M R, DURHOLTZ M D, UNDERHILL L G, 1998. Field validation of age readings from the statoliths of chokka squid (d’Orbigny, 1845) and an assessment of associated errors[J]. ICES Journal of Marine Science, 55(2): 240–257.
LIU BILIN, CAO JIE, TRUESDELL S B, et al, 2016. Reconstructing cephalopod migration with statolith elemental signatures: a case study using[J]. Fisheries Science, 82(3): 425–433.
LIU BILIN, CHEN XINJUN, YI QIAN, 2013. A comparison of fishery biology of jumbo flying squid,outside three Exclusive Economic Zones in the Eastern Pacific Ocean[J]. Chinese Journal of Oceanology and Limnology, 31(3): 523–533.
LIU BILIN, LIN JINGYUAN, FENG CHUNLEI, et al, 2017. Estimation of age, growth and maturation of purpleback flying squid,, in Bashi Channel, Central Pacific Ocean[J]. Journal of Ocean University of China, 16(3): 525–531.
MARKAIDA U, QUIÑÓNEZ-VELÁZQUEZ C, SOSA- NISHIZAKI O, 2004. Age, growth and maturation of jumbo squid(Cephalopoda: Ommastrephidae) from the Gulf of California, Mexico[J]. Fisheries Research, 66(1): 31–47.
PARRY M, 2006. Feeding behavior of two ommastrephid squidsandoff Hawaii[J]. Marine Ecology Progress Series, 318: 229–235.
TAKAGI K, KITAHARA T, 2002a. Bias in age estimation of Japanese common squid due to grinding degree of statoliths[J]. Nippon Suisan Gakkaishi, 68(3): 351–355.
TAKAGI K, KITAHARA T, SUZUKI N, et al, 2002b. The age and growth of(Cephalopoda: Ommastrephidae) in the Pacific Ocean[J]. Bulletin of Marine Science, 71(2): 1105–1108.
WANG XUEHUI, QIU YONGSONG, ZHANG PENG, et al, 2017. Natural mortality estimation and rational exploitation of purpleback flying squidin the southern South China Sea[J]. Chinese Journal of Oceanology and Limnology, 35(4): 902–911.
Age and growth ofbased on statolith microstructure in the South China Sea
LIU Yu1,2,3, WANG Xuehui1,3,4, DU Feiyan1,3, LIU Bilin2, ZHANG Peng1,4, LIU Mengna1,2, QIU Yongsong1
1. South China Sea Fisheries Research Institute, China Academy of Fishery Sciences, Guangzhou 510300, China;2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;3. Guangdong Provincial Key Laboratory of Fishery Ecology and Environment, Guangzhou 510300, China4. Key Laboratory of Open-Sea Fishery Development, Ministry of Agriculture and Rural Affair, Guangzhou 510300, China
Age and growth rate are key parameters in fish stock assessment and management.has a short life cycle and a fast growth rate. We employ statolith microstructure to study the difference in age composition, gender and growth of the squid collected from October 2016 to September 2017 by falling-net in the South China Sea in order to study their age and growth. The results show that the age of medium cohort squid ranged from 48d to 125d and that the dominant age was from 61d to 80d. There were significant differences in the composition of female and male ages; age of dwarf cohort squid was between 44d to 95d, and the dominant age was between 51d to 70d. The difference in age composition between male and female individuals is significant. The estimated incubation period for the medium cohort samples was from July 2016 to July 2017; the peak hatching dates were distributed in the months of January and from July to August; the incubation period of the dwarf cohort was from June to October 2016 and from December 2016 to February 2017, and their peak hatching months were January and August. The mantle length, body mass and age of different individuals in the medium cohort could be fit in logarithm and linear relationship. The mantle length and age of different individuals in the dwarf cohort were fit in logarithm and logistic relationship, while the body mass and age were fit in logistic relationship. Our findings indicate that the growth rate of the dwarf group was higher than that of the medium group. The growth rate of the female was lower than that of the male in the dwarf group, but it was the opposite in the medium group. Through the analysis of statoliths growth pattern, we can learn about the age composition of the squid, estimate their hatching time, select their appropriate growth equation, and estimate their growth rate, to provide basic data for fishery biology.
; statolith; age; growth; the South China Sea
10.11978/2019004
http://www.jto.ac.cn
S917.4
A
1009-5470(2019)06-0062-12
2019-01-06;
2019-03-25。
林强编辑
国家科技支撑计划(2013BAD13B06);国家科技基础资源调查专项(2017FY201405,2018FY100105);广东省科技计划项目(2014A020217011);中国水产科学研究院基本科研业务费专项资金(2019HY-JC0203、2019GH02、2019HY-XKQ03)
刘玉(1994—), 男, 安徽省阜阳市人, 硕士研究生, 从事海洋生物学方向研究。E-mail: liuyu199406@163.com
王雪辉。E-mail:wxhscs@163.com
2019-01-06;
2019-03-25.
Editor: LIN Qiang
National Science and Technology Support Program(2013BAD13B06);National Science and technology basic resources survey(2017FY201405, 2018FY100105); Science and Technology Planning Project ofGuangdong Province, China (2014A020217011); Central Public-interest Scientific Institution Basal Research Fund,CAFS(2019HY-JC0203, 2019GH02, 2019HY-XKQ03)
WANG Xuehui. E-mail: wxhscs@163.com

