地龙降压胶囊对慢性间歇低氧高血压模型大鼠心肌缺氧的影响
张小平 赵信科 李长天 刘永琦 王碧莹 岳晓华 孙少伯 罗露露 谢晓蓉
【摘 要】 目的: 观察地龙降压胶囊对慢性间歇低氧高血压大鼠的影响。方法: 40只SD雄性大鼠随机分成5组,分为空白对照组、慢性间歇低氧组、慢性间歇低氧+地龙降压胶囊低剂量组、慢性间歇低氧+地龙降压胶囊中剂量组、慢性间歇低氧+地龙降压胶囊高剂量组。慢性间歇低氧大鼠在低压氧舱内,每天8h给予间歇低氧循环干预2周,同时使用地龙降压胶囊进行干预后检测相关酶的含量,免疫组化和Western blot分别检测心肌组织和心肌细胞低氧诱导因子HIF-1α的表达情况。结果:地龙降压胶囊对慢性间歇低氧诱发的大鼠血压升高有明显改善作用,心肌组织和心肌细胞HIF-1α的表达以及乳酸脱氢酶(LDH)含量比间歇低氧大鼠组显著降低。结论: 地龙降压胶囊可能通过改善组织缺氧而防止慢性间歇低氧诱发的大鼠血压升高。
【关键词】 地龙降压胶囊;慢性间歇低氧高血压;低氧诱导因子-1α
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2019)17-0016-04
Abstract: Objective To observe the effect of Dilong antihypertension capsule on intermittent hypoxic hypertensive rats. Methods Forty SD male rats were randomly divided into five groups: Control group, chronic intermittent hypoxia group, chronic intermittent hypoxia + low dose of Dilong antihypertension capsule group, chronic intermittent hypoxia + medium dose of Dilong antihypertension capsule group, chronic intermittent hypoxia+high dose of Dilong antihypertension capsule group. Rats in chronic intermittent hypoxia group were given intermittent hypoxic circulation intervention for 2 weeks 8 hours a day in a hypobaric oxygen chamber, accompanied with the treatment of Dilong antihypertension capsules. After the administrations,the related enzymes were checked,immunohistochemistry and western blot were used to detect the expression of HIF-1α in myocardial tissue and myocardial cells respectively. Results Dilong antihypertension capsules could prevent the rise of rats blood pressure induced by chronic intermittent hypoxia, the content of LDH and the expressions of HIF-1alpha in myocardial tissue and myocardial cells of Dilong antihypertension capsules-treated rats were significantly lower than that in intermittent hypoxia rats. Conclusion Dilong antihypertension capsule could attenuate the rise of rats blood pressure induced by chronic intermittent hypoxia though improving tissue oxygen carrying capacity.
Key words:Dilong Antihypertension Capsule; Chronic Intermittent Hypoxia Hypertension; Hypoxia-inducible Factor-1α
阻塞性睡眠呼吸暫停低通气综合征(Obstructive sleepapnea hypopnea syndrom,OSAHS)患者睡眠过程中会反复出现气道阻塞及呼吸中断、睡眠期间反复短暂缺氧为主要生理特征,研究已经证实间歇性低氧可以诱发持续的继发性血压升高,是高血压发病的独立危险因素之一[1]。研究发现,模拟患者的慢性间歇低氧模式可导致大鼠持续性血压升高[2],证明慢性间歇缺氧可以导致高血压发生。蚯蚓俗称地龙,《神农本草经》和《本草纲目》记载地龙具有通络、活血化瘀的功效。本研究试图通过观察地龙提取物地龙降压胶囊是否能够通过促进血液循化改善慢性间歇低氧诱发高血压大鼠的心肌缺氧,进而探讨地龙降压胶囊临床治疗高血压的机制。
1 材料和方法
1.1 材料 8周龄SPF级SD大鼠,平均体重 230g,甘肃中医药大学实验动物中心提供;低压氧舱 FLYDWC 50-IIA(贵州风雷航空军械有限责任公司);地龙降压胶囊(甘肃中医药大学附属医院院内制剂,生产批号:151026);鼠仪BP-98A智能血压计(北京软隆生物技术有限公司)。超氧化物歧化酶、乳酸脱氢酶、谷胱甘肽过氧化物酶检测试剂盒均购自南京建成生物工程研究所。
1.2 方法
1.2.1 间歇低氧高血压模型建立 SD雄性大鼠40只随机分成5组,每组8只,分为空白对照组(UC组,正常饲养)、慢性间歇低氧组(CIH组)、慢性间歇低氧+地龙降压胶囊低剂量组(CIH+lowDL组)、慢性间歇低氧+地龙降压胶囊中剂量组(CIH+midDL组)、慢性间歇低氧+地龙降压胶囊高剂量组(CIH+highDL组)。根据文献[3-4]建立慢性间歇低氧高血压模型:在低压氧舱内,每天8 h给予间歇低氧循环干预( 6%~8% 的O2 40 s,随之21% 的O2 80 s),共2周。
1.2.2 给药及血压测量 地龙降压胶囊干预组用地龙降压胶囊溶于37℃温水灌胃每日3次:每次低剂量组25mg/kg体重、中剂量组50mg/kg体重、高剂量组100mg/kg体重。对照组及模型组给予等体积的蒸馏水灌胃。大鼠心率平稳时用智能无创血压计套尾测量大鼠的尾动脉收缩压(SBP)。
1.2.3 大鼠心肌组织HIF-1α免疫组化染色 石蜡切片用梯度酒精脱蜡,PBS洗涤两次后, 0.01M柠檬酸钠缓冲溶液中高压(125℃·103KPa)修复15 min,自然冷却后,0.02 MPBS洗3min×3次,用3%过氧化氢孵育使内源性过氧化物酶失活,洗涤。37℃下兔血清封闭20min,洗涤后加HIF-1α单克隆抗体(1∶400,武汉博士德公司) 湿盒4 ℃孵育过夜。洗涤后滴加maxvision二抗室温30min,洗涤后DAB显色,苏木精复染,树胶封片,显微镜拍照。最后在 200 倍光镜下,随机选取5个视野,使用Image Pro-Plus6.0图像分析软件进行分析和平均光密度(MOD)值测定。
1.2.4 Western blot检测心肌细胞内HIF-1α蛋白水平 大鼠心肌组织加液氮研钵研磨后,加入4 ℃预冷的组织裂解液(样品∶组织裂解液=1∶6重量比)处理20min后,超声破碎,离心,提取细胞总蛋白,Bradford比色法测定蛋白质浓度。95 ℃水浴变性后每孔上样20μg,12%分离胶、5%浓缩胶SDS-PAGE电泳,转膜(40min),4 ℃下 5%脱脂奶粉封闭2h。加一抗(HIF-1α∶1∶300;GAPDH∶1∶1000)4°C孵育过夜,TBST洗膜,再与辣根过氧化物酶标记的二抗(1∶1000)室温孵育2h。ECL化学发光法显影,Bio-Rad凝胶成像仪成像, Bandscan 5.0 软件进行灰度扫描分析。
1.2.5 相关酶指标的测定 水合氯醛麻醉后,心脏取血 5 mL,室温静置30 min, 3000 r /min离心5 min,吸取血清,液氮保存。按试剂盒说明检测乳酸脱氢酶(LDH)、过氧化物歧化酶(SOD)、谷胱甘肽过氧化酶(GSH-PX)的活性。
2 结果
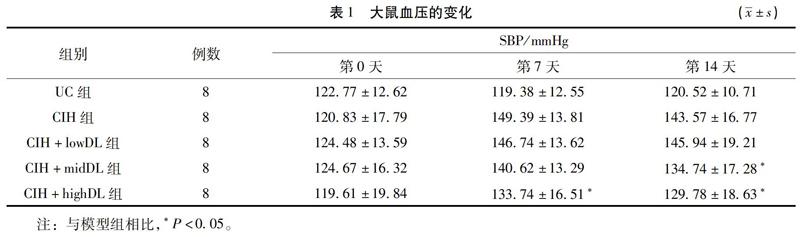
2.1 大鼠血压的变化 血压监测的结果表明,第0天各组大鼠尾动脉收缩压没有明显差异,第7天CIH 组SBP 比间歇性低氧前显著升高[(120.83±17.79) vs(149.39±13.81) mmHg, P<0.05],CIH+lowDL组、CIH+midDL组、CIH+highDL组也均有不同程度的升高,相对而言,高剂量地龙降压胶囊干预组升高幅度较小。干预第14天,相对于UC组,CIH 组和CIH+lowDL组大鼠出现稳定的高血压状态(P<0.05);和CIH 组相比,中、高剂量地龙降压胶囊干预一定程度上防止了血压的升高(P<0.05)。见表1。
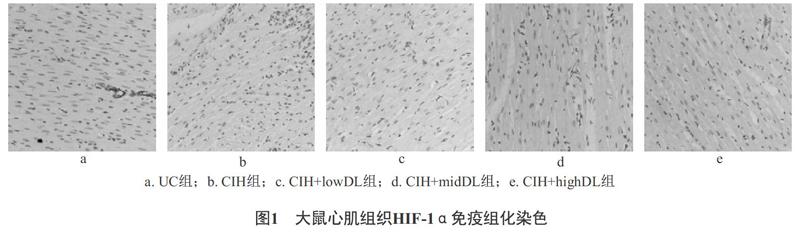
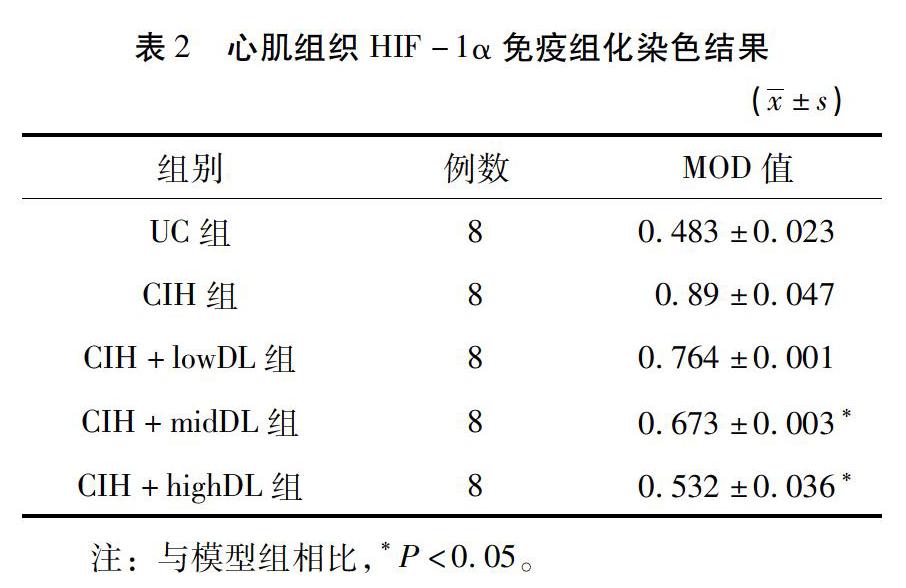
2.2 大鼠心肌组织HIF-1α的表达的影响 使用Image-ProPlus 6.0软件对免疫组化结果进行分析和平均光密度(MOD)值测定,结果见图1、表2。与空白对照组相比,间歇低氧能导致HIF-1α表达的显著升高(P<0.01);与模型组相比,高剂量和中剂量地龙降压胶囊能明显降低HIF-1α的表达(P<0.05)。见表2。
2.3 对心肌细胞HIF-1α的表达的影响 Western blot检测心肌细胞HIF-1α的表达,UC组表达非常轻微,几乎检测不到,CIH组HIF-1α的表达量比UC组明显增加(P<0.01),地龙降压胶囊干预后,HIF-1α的表达出现不同程度的下降,高剂量组下降最为明显,是CIH组的0.57倍(P<0.05),中、低剂量组分别是CIH组表达量的0.73、0.89倍。如图2所示。
2.4 对大鼠心肌LDH、SOD和GSH-PX 酶活性的影響 和UC组相比,CIH组SOD及GSH-PX的含量下降,而LDH含量升高。地龙干预后, 干预组LDH 活性比CIH组明显下降(P<0.05,表3),SOD和GSH-PX 的变化不明显(P>0.05)。见表3。
3 讨论
冠心病、高血压、心竭等心脑血管疾病都和OSAHS存在一定的相关性[5],而且动物模型和人体模型都证实了间歇缺氧和高血压的相关性[2]。此次研究也证实了类似的结果,证明间歇缺氧确实能引起大鼠血压升高(表1),一周的间歇缺氧就能有效引发大鼠血压升高,两周的间歇缺氧能形成稳定的高血压。
中医学认为高血压与血瘀关系较为密切,因气虚而产生痰、瘀等,因此高血压病可以从瘀辨证治疗[6]。汤尔峰等利用抵当汤的活血化瘀、泻下通腑作用通过改善组织缺血缺氧而改善高血压症状[7]。地龙降压胶囊主要成分是地龙蛋白提取物,含有蚓激酶、纤溶酶、胶原酶、纤溶激活蛋白、微量元素等多种成分。它能通过影响人体凝血系统和纤溶系统,减少了血管阻力、降低血液粘稠度而改善微循环,产生降压作用[8]。此次研究发现,地龙降压胶囊干预大鼠血压明显出现下降趋势(表1),可能与地龙提取物通过改善微循环而改善组织缺氧有一定关系。
低氧诱导因子-1 (hypoxia inducible factor-1,HIF-1) 是低氧诱导产生的一种转录调节因子, 由HIF-1α和HIF-1β组成, HIF-1α的表达受氧浓度的调节,对调节氧平衡非常重要,心肌缺血缺氧会引起HIF-1α 表达增加[9]。此次研究发现, 地龙降压胶囊除了对间歇缺氧引起的大鼠高血压有一定的改善作用外,而且经过干预以后,大鼠心肌组织和心肌细胞HIF-1α的表达比间歇低氧组有明显的降低(图1、2), 可能在一定程度上,地龙降压胶囊促进了微循环,因而改善了组织缺氧。另一方面,Harrington JP等發现地龙蛋白能够被用作治疗性氧载体[10],可能本研究中地龙降压胶囊在改善微循环的同时,也能增加组织供氧,因此对组织缺氧有一定的缓解和改善。而且生化酶学指标检测发现,缺氧导致LDH活性升高,可能与无氧酵解加强有关,但地龙降压胶囊干预后LDH明显活性下降,然而SOD和GSH-PX活性与低氧模型组相比没有显著性差异(表3),可能进一步证明地龙降压胶囊是通过改善组织缺氧而不是抗氧化的方式来缓解缺氧性高血压的症状。综上所述,地龙降压胶囊可能主要通过改善组织微循环而改善组织缺氧,因此对缺氧性高血压的发生有一定缓解。
参考文献
[1]Gami A S, Olson E J, Shen W K, et al. Obstructive Sleep Apnea and the Risk of Sudden Cardiac Death: A Longitudinal Study of 10,701 Adults[J]. Journal of the American College of Cardiology, 2013, 62(7):610-616.
[2]Xinshi N, Ling Z, Aidi W, et al. Noradrenergic Activation of Hypoglossal Nucleus Modulates the Central Regulation of Genioglossus in Chronic Intermittent Hypoxic Rats[J]. Frontiers in Neurology, 2017(8):171.
[3] 闫静,侯瑾,盛颖,等.间歇性缺氧大鼠模型的建立及评价[J].山东大学学报(医学版),2013,51(6):53-56.
[4] 蒋丽君,刘建红,宋玮,等. 慢性间歇低氧并高血压SD大鼠模型的建立[J]. 中国临床新医学, 2015, 8(11):1013-1015.
[5]中华医学会呼吸病学分会睡眠呼吸疾病学组. 睡眠呼吸暂停人群高血压患病率的多中心研究[J]. 中华结核和呼吸杂志,2007,30(12):894-897.
[6]曾辉,崔社通,王欣,等. 应用益心健脑汤治疗气虚血瘀型老年高血压病临床经验[J].中华中医药杂志,2018,33(4):1388-1390.
[7]汤尔峰,吴颢昕,姜惟. 抵当汤对高血压脑出血模型大鼠低氧诱导因子-1α的影响[J].中国实验方剂学杂志,2013,19(2):230-234.
[8]彭劲甫,杨得坡,黄世亮,等. 地龙的药理作用与保健功能[J].中药材,2000,23(2):114-117.
[9]Hyvrinen J, Hassinen IE, Sormunen R, et al. Hearts of Hypoxia-inducible Factor Prolyl 4-Hydroxylase-2 Hypomorphic Mice Show Protection against Acute Ischemia-Reperfusion Injury[J]. Journal of Biological Chemistry, 2010, 285(18):13646-13657.
[10]Harrington JP, Kobayashi S, Dorman SC, et al. Acellular Invertebrate Hemoglobins as Model Therapeutic Oxygen Carriers: Unique Redox Potentials[J]. Artificial Cells, Blood Substitutes and Biotechnology, 2007, 35(1):53-67.
(收稿日期:2019-06-24 编辑:程鹏飞)

