载紫杉醇的pH敏感型热休克蛋白纳米载体的肿瘤细胞摄取特性及药理学评估
杨惠卿,王 喻,骆红飞,赵子明
(1.浙江中医药大学附属第二医院,浙江 杭州 310005;2.徐州医科大学药学院,江苏 徐州 221004)
药物治疗是恶性肿瘤治疗的重要方法之一.传统的抗肿瘤化疗药物靶向性差,毒副作用大,患者耐受性差,很大程度上制约了其临床应用[1-2],而纳米粒给药系统由于其独特的尺寸性质和分子结构,可将药物靶向输送到指定的肿瘤部位,提高局部药物浓度,增强杀伤能力,所以在肿瘤治疗领域中已成为国内外研究者最关注的热点之一[3-5].小分子热休克蛋白(sHSP)具有球状笼形空心结构,其内部空腔可作为药物的载库[6],且其内、外表面都有丰富的可修饰位点[7],因此可通过基因工程或化学手段进行改造使其具有理想的性能与更多的功能[8-9].
通过前期研究自行设计并构建了载紫杉醇(PTX)的pH敏感型HSP纳米载体(PT-HSP).该载体以笼形蛋白HSP作为载药内核,穿膜肽Tat通过戊二醛接枝到HSP表面得T-HSP,最外层为对pH敏感的聚磺胺嘧啶/聚乙二醇丙烯酸共聚物(PSPA)通过静电相互作用与T-HSP结合,制备得到Tat/PSPA修饰的PT-HSP[10].利用体内肿瘤部位的pH比正常组织略低的生理特性[11-12],可使PT-HSP在生理pH条件下包衣化而在肿瘤pH条件下去包衣化.通过这种pH敏感的转变使Tat在正常组织被掩盖而在肿瘤组织被暴露,实现肿瘤靶向性.为进一步阐明PT-HSP智能纳米递药载体进入肿瘤细胞的过程和作用,本研究将载PTX的PT-HSP分别与两种肿瘤细胞共孵育,观察药物入胞情况,探究其影响因素及入胞机制,综合评价其细胞杀伤能力,并分析其生物相容性,以期为靶向肿瘤细胞的纳米给药系统提供新思路.
1 材料与方法
1.1 材 料
1.1.1 药品及试剂
聚乙二醇2000(PEG-2K,西陇化工公司),聚乙二醇4000(PEG-4K,国药集团化学试剂有限公司),聚乙二醇6000(PEG-6K,南京化学试剂公司),重组嗜热古细菌(Methanococcusjannaschii)HSP、穿膜肽Tat(上海生工生物工程公司,纯度>85%),PTX(西安昊轩生物科技公司,纯度98.5%),二甲基亚砜(DMSO,西陇化工公司),异硫氰基荧光素(FITC,上海阿拉丁试剂公司),树脂天青(上海阿拉丁试剂公司,纯度≥90%),秋水仙碱(日本东京化成工业株式会社),制霉菌素(美国BIOSHARP公司),盐酸氯丙嗪(CPZ,日本东京化成工业株式会社),莫能星钠(上海源叶生物科技公司),叠氮化钠(国药集团化学试剂有限公司),台盼蓝(K940,南京凯基生物科技公司,质量分数0.4%),RIPA裂解液(南京凯基生物科技公司),胎牛血清(特级,浙江天杭生物科技股份有限公司).
1.1.2 仪 器
F4500荧光分光光度计、UV-2450紫外-可见分光光度计(日本日立公司),冷冻干燥机(FD-1C-50,日本岛津公司),低速离心机(5702,北京博医实验仪器公司),倒置显微镜(CKX31,德国Eppendorf公司),倒置荧光显微镜(U-REL-T、TH4-200、TX2-ILL100,日本奥林巴斯公司).
1.1.3 细胞株、培养基和实验动物
仓鼠肺成纤维细胞CHL、人肺癌细胞A549、人宫颈癌细胞HeLa(中国科学院上海细胞库),DMEM(高糖)培养基、RPMI-1640培养基(南京凯基生物科技公司),普通级兔(徐州医科大学实验动物中心).
1.2 方 法
1.2.1 细胞培养
CHL和HeLa细胞采用DMEM培养基,A549细胞采用RPMI-1640培养基,均含10%(体积分数)胎牛血清并添加1%(体积分数)双抗(80 U/mL青霉素和0.08 mg/mL链霉素)的DMEM培养基,在37 ℃、5%(体积分数)CO2细胞培养箱中培养.
1.2.2 细胞摄取影响因素实验
称取4.0 mg Tat溶于5 mL DMSO中,按摩尔比1∶2加入1.6 mg FITC,37 ℃下搅拌反应12 h,将混合液装入透析袋并置于去离子水中透析,4 h更换一次透析液,透析24 h.透析液经凝胶渗透层析柱(Sephadex G50,美国Pharmacia公司)分离游离的FITC,收集FITC标记的Tat(即FITC-Tat),进一步制得FITC标记的T-HSP与PT-HSP[10].
取对数生长期的CHL细胞以1×105/孔置于24孔板培养24 h.弃去原有培养基,更换为pH 7.4的无血清DMEM培养基.分别选择PEG-2K、PEG-4K和PEG-6K制备的PT-HSP,向每孔中加入200 μg/mL按上述方法制备所得FITC标记的T-HSP与PT-HSP,37 ℃,100 r/min共孵育4 h.用倒置荧光显微镜拍摄其入胞情况.用RIPA裂解液裂解细胞20 min,3 000 r/min下室温离心10 min,取上清用荧光分光光度计检测FITC的荧光强度(激发波长450 nm,发射波长520 nm,狭缝宽度5 nm),以T-HSP为对照,分析不同相对分子质量的PSPA对细胞摄取的影响.
参照上述步骤,采用PEG-6K制备的PSPA,按n(HSP亚基)∶n(PSPA)=1∶1,1∶2,1∶3(下文称投料比)分别制备PT-HSP.以T-HSP为对照,分析不同投料比对细胞摄取的影响.
1.2.3 体外细胞摄取实验
取对数生长期的CHL、A549和HeLa细胞,以1×105/孔置于24孔板培养24 h.弃去原有培养基,CHL细胞更换为pH 7.4的无血清DMEM培养基,A549和HeLa细胞更换为pH 6.5的无血清培养基.然后向每孔中加入200 μg/mL FITC标记的T-HSP与PT-HSP,37 ℃、100 r/min共孵育4 h.倒置荧光显微镜下拍摄其入胞情况.
1.2.4 细胞杀伤实验
取对数生长期的CHL细胞,以1×105/孔置于24孔板培养24 h.弃去原有培养基,更换为pH 7.4(生理pH条件)的无血清DMEM培养基.按50和25 μg/mL的PTX实际质量浓度,分别将PTX的DMSO溶液、载PTX的T-HSP及载PTX的PT-HSP加入培养孔中,每个浓度3个平行孔,加药后继续培养24 h.
取对数生长期的HeLa和A549细胞,以5×104/孔置于96孔板培养24 h.弃去原有培养基,更换为pH 6.5(肿瘤pH条件)的无血清培养基.按0.5,1.0,2.0,5.0,10,15,25,50 μg/mL的PTX实际质量浓度,分别将PTX的DMSO溶液和载PTX的T-HSP加入培养孔中,每个浓度3个平行孔,加药后继续培养24 h.
培养的细胞弃去培养基,用磷酸盐缓冲液(PBS)冲洗3遍,24和96孔板各孔分别加入200和100 μL胰酶消化细胞.待细胞完全悬浮后加200和100 μL培养基终止消化,吸取各孔液体,置于1.5 mL离心管中1 500 r/min离心3 min,弃去上清液,加入400和200 μL 0.04%(质量分数)台盼蓝溶液,小心混匀,取10 μL用细胞计数板在显微镜下计数.以不给药组的细胞数为对照,计算各给药组的细胞存活率.
1.2.5 生物安全性评价
1) 细胞毒性检测
按1.2.4小节中的方法取CHL细胞并更换培养基,分别将HSP、T-HSP及PT-HSP按1 500,750,325,160,80,40 μg/mL的质量浓度加入培养孔中,每个浓度3个平行孔.加药后继续培养24 h.培养的细胞弃去培养基,用PBS冲洗3遍后,按100 μg/mL加入树脂天青溶液[13],继续培养2 h.然后将培养液稀释100倍后用荧光分光光度计测定荧光强度,以不加载体组的荧光强度为对照,计算不同载体组在各浓度下的细胞存活率.
2) 溶血试验
抽取普通级兔新鲜血液15 mL,加入适量肝素,1 500 r/min离心5 min收集红细胞.用PBS清洗3遍后弃去上清,配制成2.5%(体积分数)的红细胞悬液.分别配制20 mg/mL T-HSP和PT-HSP纳米混悬液,各取0.1,0.2,0.4 mL,用PBS定容至2 mL.另取2 mL PBS和去离子水,分别加入2 mL红细胞悬液,充分混匀,其中PBS组作为阴性对照组,去离子水组作为阳性对照组.在37 ℃恒温振荡培养箱中孵育 1 h,3 000 r/min离心10 min,分别用T-HSP与PT-HSP混悬液作为空白对照,在541 nm处测定上清的吸光度,计算溶血率(hemolysis ratio,RH):
RH=(A样品-A阴性对照)/(A阳性对照-A阴性对照)×100%.
1.2.6 细胞摄取机制分析
取对数生长期的A549细胞,以1×105/孔置于24孔板培养24 h.弃去原有培养基,更换为pH 6.5的无血清RPMI-1640培养基.分别加入不同的细胞摄取抑制剂CPZ(10 μg/mL)、秋水仙碱(50 μg/mL)、叠氮化钠(1 mg/mL)、制霉菌素(6 μg/mL)及莫能星钠(2 μg/mL),37 ℃、100 r/min共孵育30 min.再向每孔中加入200 μg/mL FITC标记的PT-HSP,37 ℃、100 r/min继续孵育2 h.用RIPA裂解液裂解细胞20 min,3 000 r/min离心10 min,取上清用荧光分光光度计检测FITC的荧光强度,以不加抑制剂的单纯载体组为对照,比较各抑制剂的作用强度,分析PT-HSP的入胞机制.
1.2.7 统计学分析
所有实验数据以平均值±标准差表示,利用SPSS 13.0软件进行单因素方差分析,p<0.05表示差异显著,p<0.01表示差异中等显著,p<0.001 表示差异极显著.
2 结果与分析
2.1 细胞摄取的影响因素
2.1.1 不同相对分子质量的PSPA
如图1所示:PEG-2K和PEG-4K组的入胞情况较好,而PEG-6K组荧光在胞内分布明显减少,且与PEG-2K、PEG-4K组的细胞摄取率有极显著差异,表明只有具有长链PEG的PSPA包衣层才可以显著抑制CHL细胞对PT-HSP的摄取.

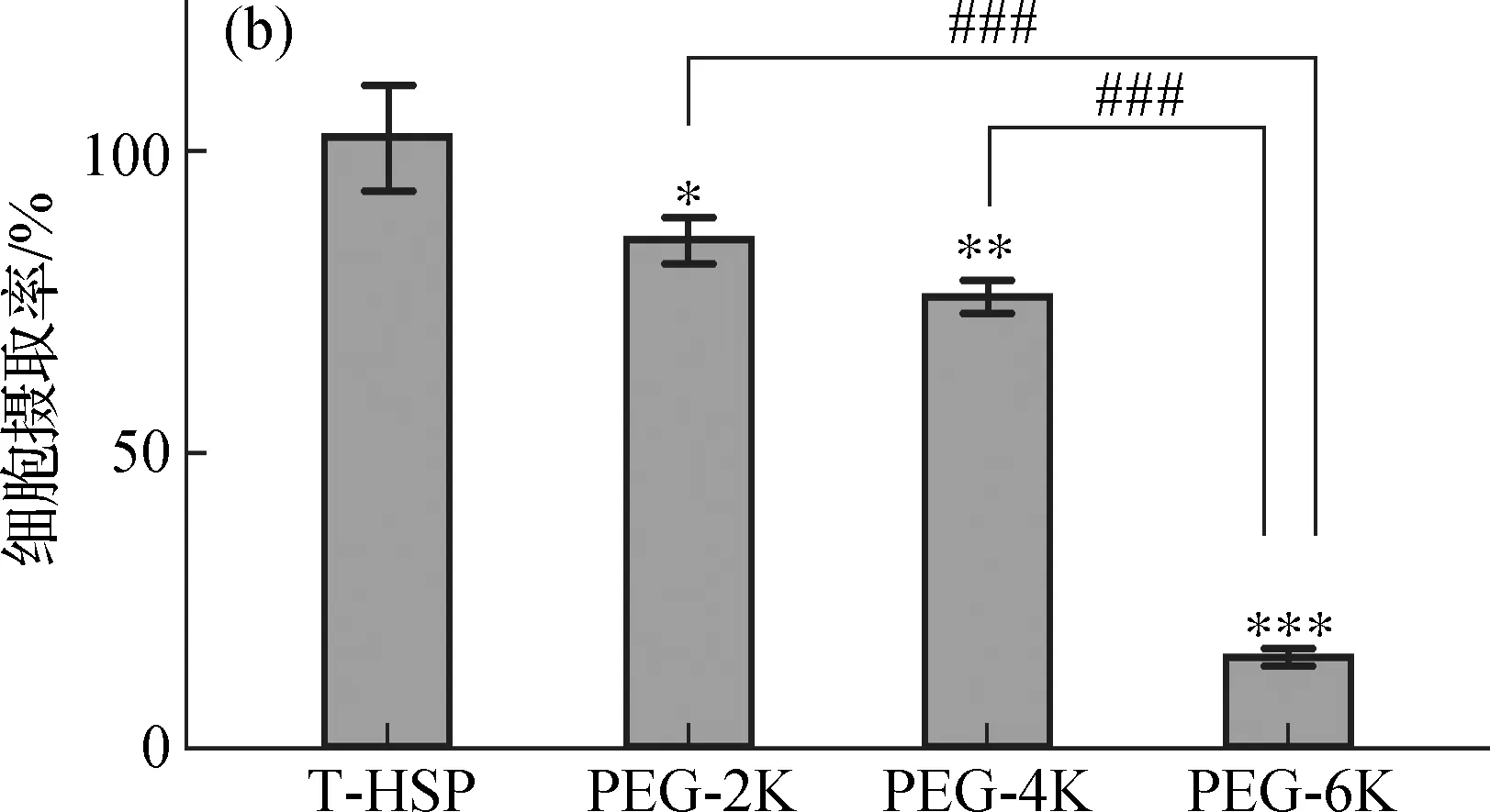
(a) 显微观察结果;(b) 数据统计分析:*,* *,* * *分别
图1 PSPA相对分子质量对PT-HSP入胞的影响
Fig.1 Effects of the relative molecular masses of PSPA on PT-HSP enterance into cells
2.1.2 不同投料比
如图2所示:PT-HSP的入胞情况与T-HSP相比,投料比为1∶1时无显著差异,而投料比为1∶2和1∶3时细胞摄取率均有极显著减小,表明其抑制入胞作用显著强于投料比为1∶1时.

* * *表示与T-HSP组比较,p<0.001.图2 HSP亚基与PSPA投料比对PT-HSP入胞的影响Fig.2 Effects of the ratios of HSP subunit to PSPA on PT-HSP entrance into cells
细胞摄取影响因素实验结果表明,当投料比超过1∶2且PEG相对分子质量较大(6 000)时,PSPA包衣可完全掩盖Tat,对PT-HSP进入正常细胞有明显抑制作用.故后续均采用投料比1∶2且PEG相对分子质量为6 000的PT-HSP进行实验.
2.2 不同细胞的体外摄取差异
为探究正常细胞和肿瘤细胞对PT-HSP的摄取情况,将T-HSP和PT-HSP分别与CHL、A549和HeLa细胞共培养.从图3可见:T-HSP在生理pH条件下培养的CHL细胞中有一定的分布,而PT-HSP基本不入胞.T-HSP可被肿瘤pH条件下培养的A549和HeLa细胞大量摄取,而PT-HSP在同样条件下也可被细胞摄取,且荧光强度与摄取T-HSP的细胞相比未见减弱.上述结果表明PT-HSP能被A549和HeLa两种肿瘤细胞大量摄取,而被正常CHL细胞摄取得极少,体现出良好的体外肿瘤细胞靶向性.
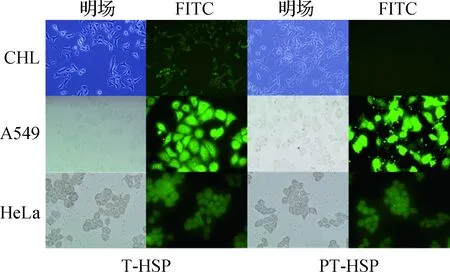
图3 T-HSP和PT-HSP被正常细胞和肿瘤细胞摄取的情况Fig.3 Uptake of T-HSP and PT-HSP by normal and tumor cells
2.3 细胞杀伤的选择性
为确认载PTX的PT-HSP对正常细胞和肿瘤细胞具有高选择性杀伤能力,采用台盼蓝染色法进行验证.如图4(a)所示,在CHL细胞中,载PTX的PT-HSP组细胞存活率极显著高于PTX注射液组和载PTX的T-HSP组.由于PT-HSP在肿瘤pH条件下会去包衣化暴露Tat,所以只分析载PTX的T-HSP在相同PTX浓度下对肿瘤细胞的杀伤作用.如图4(b)和(c)所示,在A549和HeLa细胞中载PTX的T-HSP组细胞存活率均显著低于PTX注射液组.可见载PTX的T-HSP对肿瘤细胞和正常细胞均有较强杀伤作用;而载PTX的PT-HSP对正常细胞伤害较小,对肿瘤细胞则具有较强杀伤作用,说明经PSPA包衣化的载PTX的PT-HSP能更好地选择性杀伤肿瘤细胞.
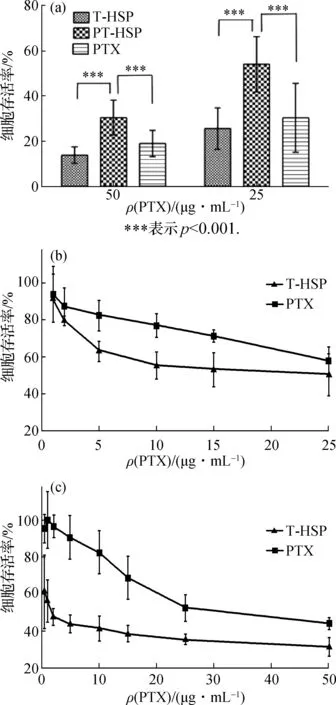
图4 PTX与载PTX的纳米载体对CHL(a)、A549(b)和HeLa(c)细胞的杀伤作用Fig.4 Cell killing effects of PTX and PTX-loaded nano-carriers on CHL (a),A549 (b) and Hela (c) cells
2.4 生物安全性分析
2.4.1 细胞毒性
如图5所示,在40~750 μg/mL的质量浓度下,不同载体对细胞活性均无显著影响,仅当T-HSP的质量浓度高达1 500 μg/mL(远超其使用浓度)时才对CHL细胞产生显著影响,而HSP与PT-HSP在高浓度时仍对CHL细胞活性无显著影响,表明这三者在正常使用时对CHL细胞均不会产生毒性,其中PT-HSP的安全性优于T-HSP.
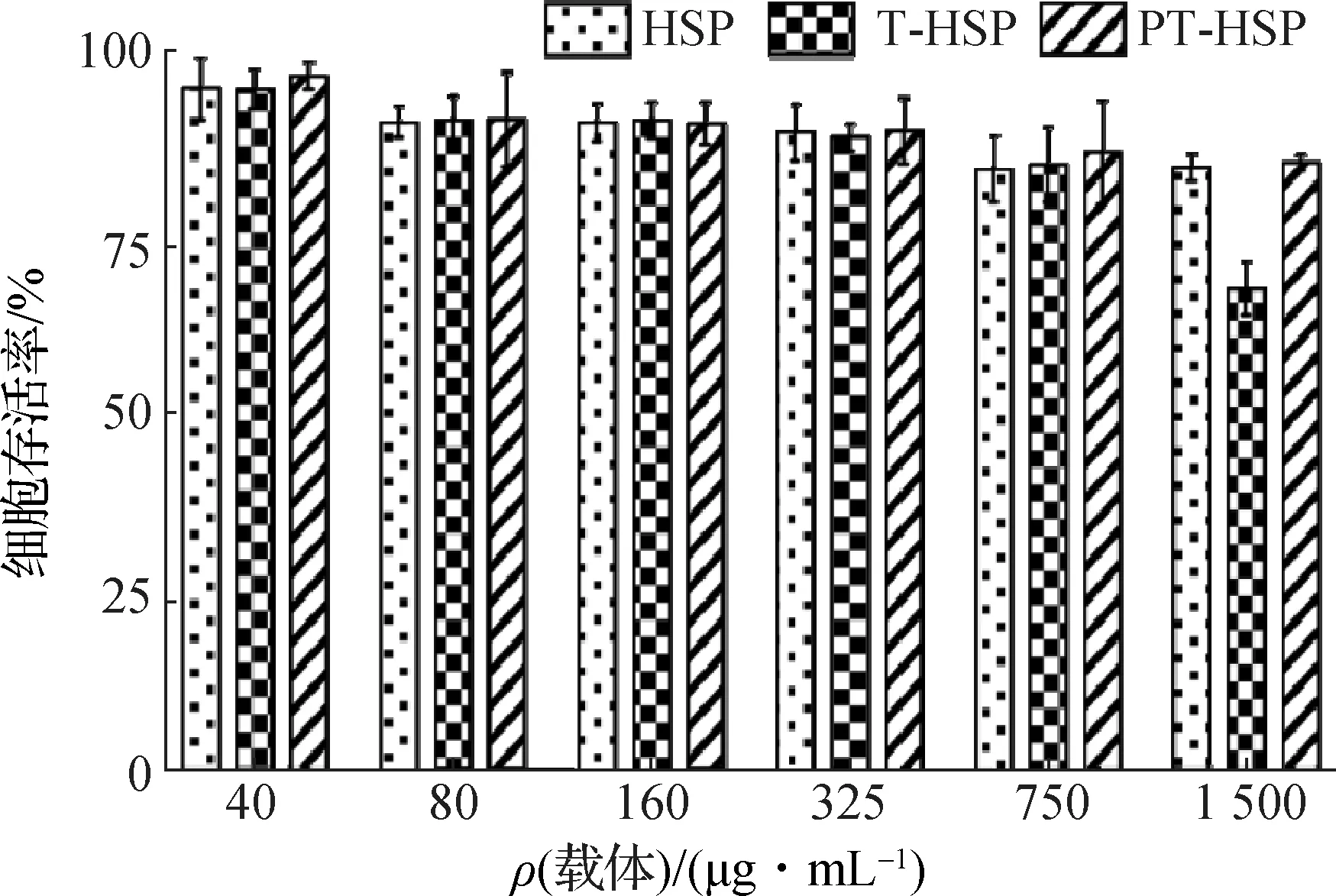
图5 HSP、T-HSP、PT-HSP对CHL细胞的毒性Fig.5 Cytotoxicity of HSP,T-HSP,PT-HSP to CHL cells
2.4.2 体外溶血率
如图6所示,分析载体质量浓度分别为0.5,1.0和2.0 mg/mL时的体外溶血率,T-HSP分别为(1.2±0.7)%,(2.6±0.5)%和(4.9±0.8)%,PT-HSP分别为(0.7±0.2)%,(1.2±0.4)%和(1.6±0.5)%,可见体外注射PT-HSP的溶血率低于5%,不会引起溶血[14],表明PT-HSP具有良好的生物安全性.
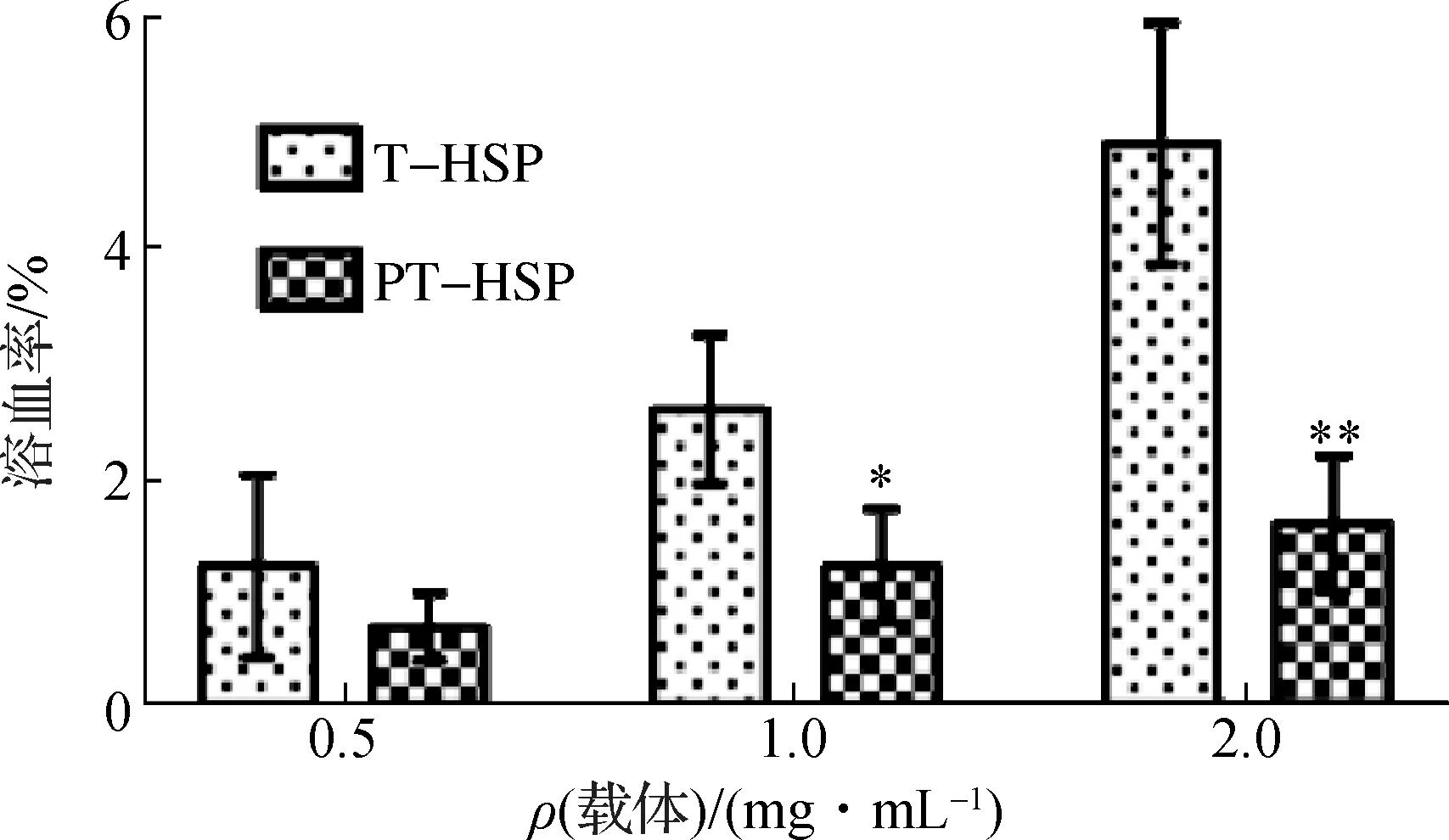
* *表示与T-HSP组比较,p<0.05.图6 T-HSP和PT-HSP的溶血试验Fig.6 Hemolysis assay of T-HSP and PT-HSP
2.5 细胞摄取机制
细胞内吞主要有网格蛋白介导的内吞、小窝蛋白介导的内吞、巨胞饮以及网格蛋白和小窝蛋白非依赖的内吞4种机制[15].为分析PT-HSP进入肿瘤细胞的内吞方式,选用5种不同的抑制剂:叠氮化钠抑制ATP酶,CPZ封闭网格蛋白有被小泡,莫能星钠阻断网格蛋白受体的循环利用,制霉菌素抑制小窝蛋白,秋水仙碱抑制微管蛋白从而阻断细胞的巨胞饮作用.各抑制剂的加入对PT-HSP入胞情况的影响如图7所示:叠氮化钠具有最强的抑制作用,细胞摄取率仅为(2.4±0.5)%;其次为秋水仙碱和制霉菌素,细胞摄取率分别为(35.1±8.7)%和(50.4±1.4)%;而CPZ和莫能星钠的抑制作用不显著.

* * *表示与未加抑制剂的单纯载体组比较,p<0.001.图7 细胞摄取抑制剂对PT-HSP入胞的影响Fig.7 Effects of inhibitors of cellular uptake on PT-HSP enterance into cells
上述结果表明PT-HSP主要通过依赖能量的巨胞饮方式和小窝蛋白介导的内吞方式进入A549细胞,可见Tat在PT-HSP的入胞过程中起主导作用.
3 结 论
本研究基于前期构建的PT-HSP,对其在肿瘤细胞中的摄取特性、药理学活性和细胞摄取机制进行探究.结果表明载PTX的PT-HSP体外肿瘤靶向性能较好,相比于PTX和载PTX的T-HSP能更好地选择性杀伤肿瘤细胞,同时减少对正常细胞的伤害,且生物安全性良好.综上所述,PT-HSP作为一种新型肿瘤药物靶向递送载体,既实现了增强抗肿瘤药的效果,又减少了其毒副作用,具有广阔的应用前景.

