基于混合培养和PCR-变性梯度凝胶电泳的复合净水功能菌群构建
王 新,汤江武,吴逸飞,姚晓红,孙 宏,沈 琦,李园成
(浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
在现有的水体修复技术中,生物修复具有环境友好、生态节能的优点,是一种备受重视、迅速发展的水环境治理技术。其中,微生物在污染物的转化和去除过程中起着核心作用。近年来,基于微生物的污染水体修复技术作为一种公认的高效、低成本的生物修复技术手段,得到了广泛的认可和成功的应用[1-3]。向污染水体中直接投加功能微生物或能促进原位功能微生物生长的营养物质是当前微生物原位修复过程中通用的方法。已有的研究中,用于水体生物修复的菌剂多为单一菌,一些复合净水功能菌剂也多为不同菌种的简单组合、复配,难以适应复杂多变的污染水环境,在水体中的定殖能力和生态活性低,且面临在原位流动水体中容易散失等问题[4-6],不适用于原位水体强化修复。解决该问题的核心在于持续稳定地增加适用于水体污染降解和转化的、执行不同功能的微生物,以强化水体原位生态系统的物质转化循环过程。因而,开发易定殖、高活性的复合净水功能菌剂,是当前该领域的重要基础性问题[7-8]。关于复合菌剂的构建,现有研究通常采用平板划线法检测菌株之间是否存在拮抗,然后以此为基础进行复配和性能检验[9-10]。此类方法的局限之处在于,复合菌剂的构建效率较低,且难以反映不同细菌在共同生长条件下的竞争状况,导致实际应用效果不稳定。
从前期研究获得的净水功能菌出发,以混合培养后的菌群动态变化为依据,探索分子监测条件下的复合菌群构建方法,旨在为复合净水功能菌群的构建和高效应用,以及污染水体微生物强化修复技术的深化提供参考。
1 材料与方法
1.1 菌株
用于构建净水复合功能菌群的菌株系前期从环境中分离获得的,分别具有氨氧化、反硝化、化学需氧量(COD)降解等功能,具体编号和相关信息详见表1。菌株活化、准备均采用LB培养基。经过平板划线法培养检测,这些菌株两两之间均不存在拮抗作用。
1.2 不同净水功能菌株的混合培养特性
用LB液体培养基对11株菌株进行培养,每2 h取样一次,测定D600,确定各菌株的生长曲线。将处于稳定生长期的各菌株培养物,参照D600值最小的菌株培养物的D600值,用新鲜的LB培养基进行稀释,然后各取0.1 mL菌液进行混合,作为起始混合菌液。分别取20、50 μL接入各2个装有50 mL LB培养基的三角瓶中,在28 ℃、160 r·min-1的条件下进行混合培养,分别在12、24、48 h取样。对样品提取基因组DNA并进行PCR-变性梯度凝胶电泳(DGGE)分析,确定所有菌株在共培养条件下的生长特性。
1.3 不同净水功能菌株组合的混合培养特性
通过1.2节实验,初步确定菌株S1(AOZ1)、S3(W14)、S6(BSK9)和S7(BSK3)在所有菌株混合共培养条件下可以良好生长。以这4株菌为主体,分别与其他菌株进行组合(表2)。考虑到菌株S2(ADH1)和S4(GC5)具有反硝化功能,在组合中作为重要待测菌株。参照1.2节方法,每菌株悬液加入0.1 mL,混合菌液的接种量统一为10 μL,进行混合培养,在0和24 h取样,分析菌群结构,筛选适合的复合菌群组合。
表1 用于构建复合功能菌群的净水功能菌株
Table1Water purifying functional strains used for compound bacteria construction
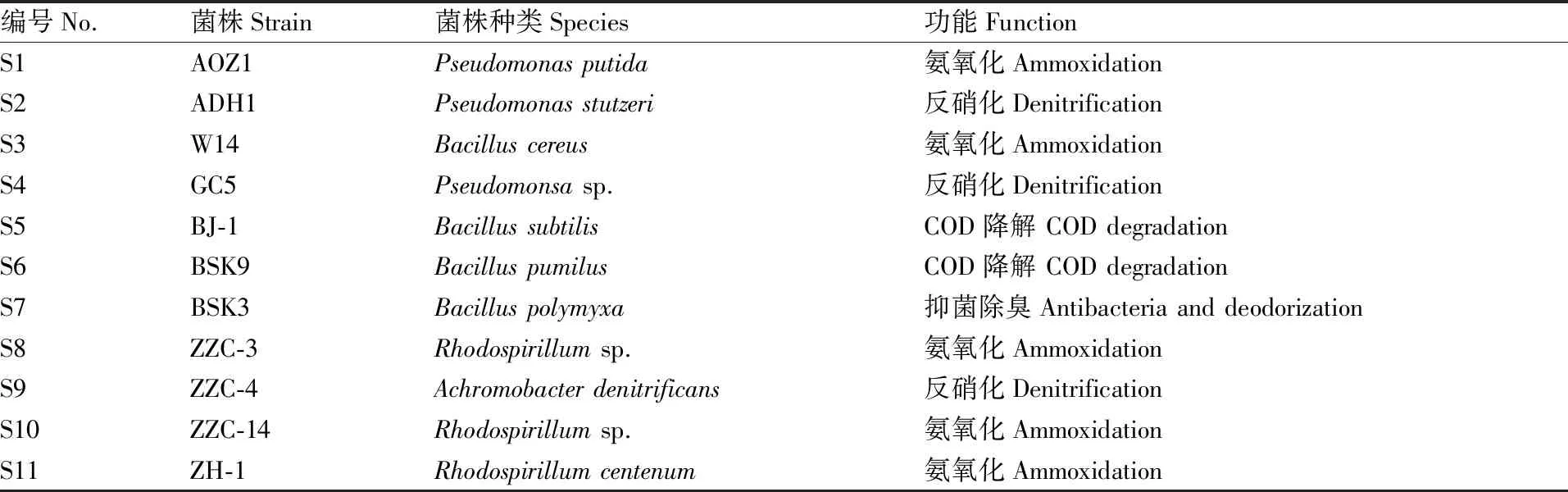
编号No.菌株Strain菌株种类Species功能FunctionS1AOZ1Pseudomonas putida氨氧化AmmoxidationS2ADH1Pseudomonas stutzeri反硝化DenitrificationS3W14Bacillus cereus氨氧化AmmoxidationS4GC5Pseudomonsa sp.反硝化DenitrificationS5BJ-1Bacillus subtilisCOD降解 COD degradationS6BSK9Bacillus pumilusCOD降解 COD degradationS7BSK3Bacillus polymyxa抑菌除臭Antibacteria and deodorizationS8ZZC-3Rhodospirillum sp.氨氧化AmmoxidationS9ZZC-4Achromobacter denitrificans反硝化DenitrificationS10ZZC-14Rhodospirillum sp.氨氧化AmmoxidationS11ZH-1Rhodospirillum centenum氨氧化Ammoxidation
表2 净水功能菌组合
Table2Settings of compounder water purifying functional bacteria

编号No.菌株组成StrainsG1S1, S11G2S1, S3, S6, S7G3S1, S2, S3, S4, S5, S8, S9, S10, S11G4S1, S2, S4, S5, S6, S8, S9, S10, S11G5S2, S3, S4, S5, S7, S8, S9, S10, S11G6S1, S2, S3, S4, S5, S6G7S1, S2, S3, S4, S6, S7G8S1, S2, S3, S6, S9G9S1, S6, S8, S9
1.4 复合净水菌剂净水效果实验
根据净水功能菌群组合的筛选结果,确定以S1(AOZ1)、S3(W14)、S6(BSK9)和S7(BSK3)等4株菌为核心,复配复合菌剂,经培养后用于河道水体的净水效果实验。实验分组及处理方式如表3所示。实验用河道水样采自杭州市城郊某河道,水体氨氮(NN)含量为4.5 mg·L-1,COD为32 mg·L-1。采集的水样分装1 L于4 L的三角瓶中,每个菌剂组合设置一个平行样。将培养后的菌株离心沉淀,弃去培养基,用无菌蒸馏水重悬,所有菌株经无菌水稀释至相同D600值后备用。按照0.5%体积分数加入菌液,单菌直接加入,混菌中各单菌的比例相同。加入5 mL复合菌剂或单菌后,在摇床中以120 r·min-1、30 ℃的条件培养,分别在0、1、2、3、4 d取样,分析水样中COD、氨氮、总氮(TN)的变化,其中,0 d为加入菌悬液后取得的样品。
表3 复合净水菌剂净水效果实验菌株组成
Table3Strains used in the water purification test

编号No.菌株组成StrainsT1S1T2S3T3S6T4S7T5S2, S4T6S1, S2, S4T7S2, S4, S6T8S2, S3, S4T9S2, S4, S7T10S1, S3, S6, S7T11S1, S2, S4, S6T12S2, S3, S4, S7
1.5 混合培养液细菌群落结构的PCR-DGGE分析
1.5.1 DNA提取
各菌株由斜面中接出,在LB液体培养基中培养过夜,取1 mL菌液离心,收集菌泥。取混合培养的培养物0.5 mL,离心,收集菌泥。采用Bioready bacterial gnomic DNA extraction kit提取样品中的基因组DNA,获得的DNA经电泳检测后在-20 ℃保存备用。
1.5.2 PCR-DGGE分析
以提取的样品基因组DNA为模板,PCR扩增16S rDNA V3区片段,引物为连有“GC-夹子”(5′-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G-3′)的Eubac341f(5′-TAC GGG AGG CAG CAG-3′)和Eubac517r(5′-ATT ACC GCG GCT GCT GG-3′)[11-12],参考文献[13-14]中描述的方法,采用Touchdown PCR程序进行扩增。扩增产物经1.0%琼脂糖凝胶电泳检测后用Bio-Rad公司D-code System进行DGGE分析。聚丙烯酰胺凝胶质量分数为8%,变性梯度40%~60%。在60 ℃、50 V条件下电泳1.5 h,然后升电压至150 V,继续电泳6 h。聚丙烯酰胺凝胶在EB染液中染色25 min,用TANNON-2500凝胶成像系统采集图像。
1.6 分析方法与数据统计
水样中COD含量采用重铬酸钾比色法测定,TN含量采用耶拿MULTIN/C 3100型总有机碳/总氮分析仪测定,NN含量参照HJ 536—2009中的方法测定。各项水质指标在测定时均采用3个平行样品。
采用SPSS 13.0软件进行单因素方差分析,对有显著差异的处理,采用Tukey法进行多重比较。
2 结果与分析
2.1 净水菌株及其共同混合培养物的DGGE分析
提取11株净水菌株及所有菌株混合培养物的基因组DNA,并扩增16S rDNA V3区产物进行DGGE分析。如图1所示,1~11号泳道分别为单菌S1~S11,12号泳道为所有菌株的初始混合物,13~14、15~16、17~18号泳道分别为菌株混合培养12、24、48 h的结果。图1中共显示6条条带,其中,菌株S1(AOZ1)和S6(BSK9)、S2(ADH1)和S4(GC5)、S3(W14)和S7(BSK3),以及S8(ZZC-3)、S10(ZZC-14)和S11(AH-1)所示条带均处于相同的位置。但前期实验表明,这些菌株的菌落形态和16S rDNA基因有明显的差异。产生这种现象的原因可能与细菌16S rDNA基因存在多拷贝,以及DGGE技术本身存在的一些不足有关。所有菌株的混合物在培养24 h和48 h后的DGGE图谱中仅显示2个主要条带,对照DGGE图谱中各个菌株的位置,可以初步确定,菌株S1(AOZ1)或S6(BSK9)、S3(W14)或S7(BSK3)在所有菌株共同培养时,单独或共同成为优势菌。
2.2 不同净水功能菌株初筛组合培养物的DGGE分析
以菌株S1(AOZ1)、S3(W14)、S6(BSK9)和S7(BSK3)为主体进行复合菌群的初筛,DGGE图谱如图2所示,其中,1~9号泳道对应表2的G1~G9(0 h),10~18号泳道对应表2的G1~G9(24 h),M为所有菌16S rDNA基因片段的混合物。初始混合物中所有菌株均在相应的泳道出现对应的条带,培养24 h后,混合培养物组成里包含有S1(AOZ1)、S3(W14)、S6(BSK9)和S7(BSK3)4株菌的组合,且其均在相应的培养物中成为优势菌。该结果充分表明,这几株菌在混合培养过程中具有竞争优势。除菌株S2(ADH1)和S4(GC5)在一些培养物中仍能生长外,其他菌株的生长均受到明显的抑制。相对于菌株S1(AOZ1)和S6(BSK9),S3(W14)和S7(BSK3)同时存在对菌株S2(ADH1)和S4(GC5)的生长抑制能力更强,如图2泳道5(0 h)和14(24 h)所示。
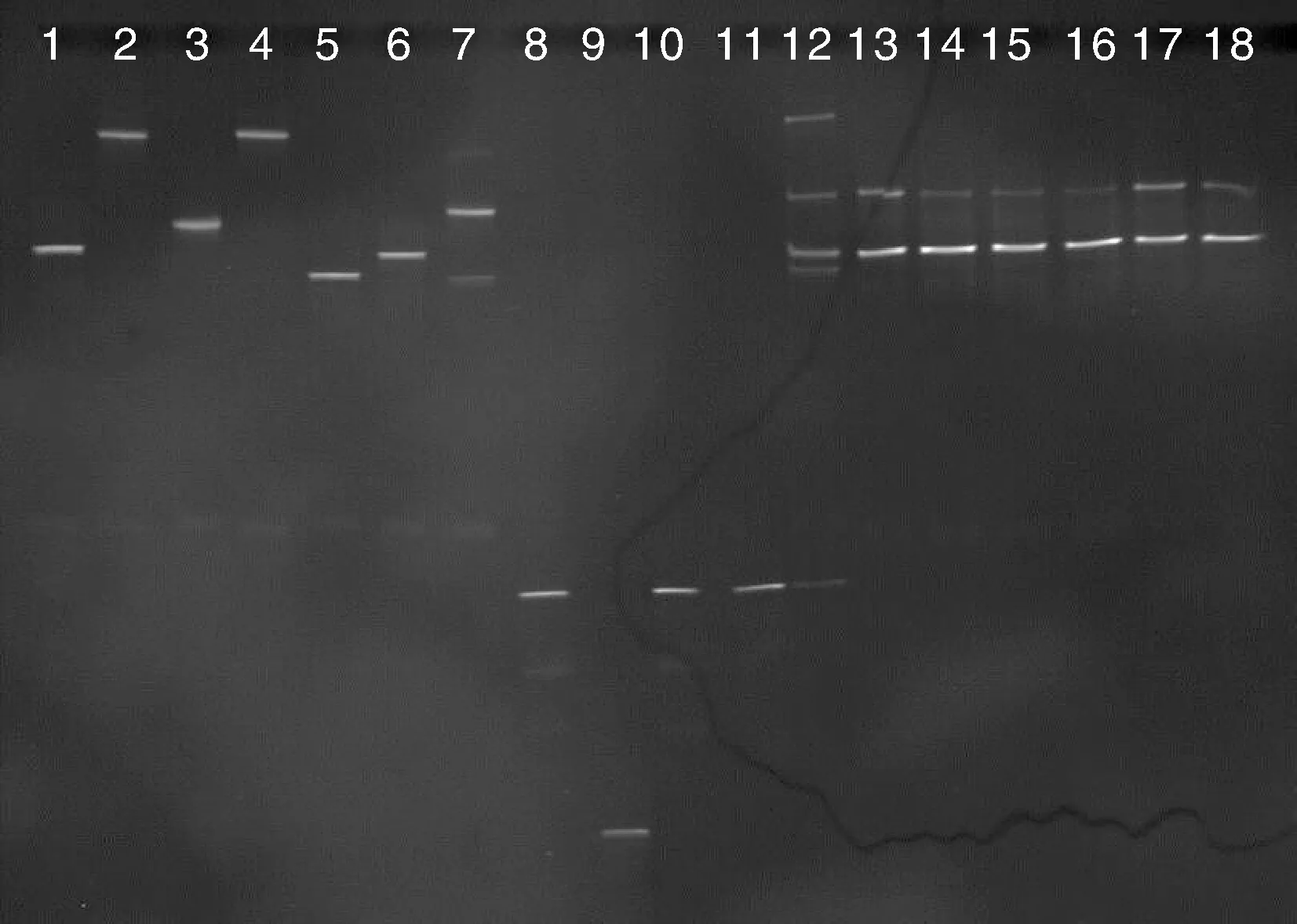
泳道1~11,菌株S1~S11;泳道12,各菌株初始混合物;泳道13~14,培养12 h的各菌株混合物;泳道15~16,培养24 h的各菌株混合物;泳道17~18,培养48 h的各菌株混合物。Lane 1-11, Strain S1-S11, respectively; Lane 12, Initial compound bacteria; Lane 13-14, compound bacteria after 12 h; Lane 15-16, compound bacteria after 24 h; Lane 17-18, compound bacteria after 48 h.图1 各净水功能菌株及其混合培养物的DGGE图谱Fig.1 DGGE profiles of 16S rDNA gene V3 fragments of different water purifying functional strains and their mixture

泳道1~9的菌株对应表2中的G1~G9 (0 h),泳道10~18的菌株对应表2中的G1~G9 (24 h),泳道M为所有基因片段的混合物。Lane 1-9, G1-G9 in Table 2 at 0 h, respectively; Lane 10-18, G1-G9 in Table 2 at 24 h, respectively; Lane M, All the gene fragments in all test strains.图2 不同净水功能菌株初筛组合培养物的DGGE图谱Fig.2 DGGE profiles of 16S rDNA gene V3 fragments of compound bacteria in preliminary screening test

图3 复合净水菌剂作用下水体COD、NN、TN的变化Fig.3 Variation of COD, NN and TN under compound bacteria in 4 d
2.3 复合净水菌剂的净水效果
对菌株S1(AOZ1)、S3(W14)、S6(BSK9)、S7(BSK3),以及以其为主体构建的复合菌剂,用河道原位水进行净水效果实验。结果(图3)显示,4 d之内,相对于不加菌的对照(CK),COD的最高去除率为T10组合的48.0%,其中,含有菌株S6的组合,COD去除率均超过40.2%,显著(P<0.05)高于其他菌株组合。NN的最高去除率同样为组合T10(76.8%),含有菌株S1的组合,氨氮去除率均超过69.2%,显著(P<0.05)高于其他菌株组。在4 d内,TN的最高去除率为组合T11,约为42.8%,其他含有菌株S2和S4的组合之间总氮的去除率差异不显著,但显著(P<0.05)高于未含有S2和S4的组合。对COD和NN均有较高去除率的T10的TN去除率仅为23.9%。菌株S1和S6分别具有NN降解和COD降解的功能,在组合的情况下,对污染水体中的COD和NN均具有较好的去除效果。实验所用的河道水体本身含有大量的微生物,这说明以菌株S1和S6为主体构建的复合菌剂可以有效在水体中定殖、生长,并实现净水功能。
3 讨论
水体污染物的降解和转化主要依赖于微生物的作用[15],这也是人类利用功能微生物修复污染环境的基础。通过强化水环境中的功能微生物,进而加快污染降解、转化进程,实现水体污染物去除和生态修复,是当前的思路。在实践中,无论是直接投加功能微生物,还是调控水体生态环境,使原位环境中的土著功能微生物增殖、强化,其本质都是提高特定种类的微生物生态功能,以实现其生态效应。显然,投加的微生物能否在原位环境下定殖和生长,是影响微生物强化修复效果的核心问题。现有的水体微生物强化修复实践中,光合细菌、芽孢杆菌、乳酸菌等菌剂得到了较多的应用,尽管已经取得了一定的效果,但也存在投加微生物作用不明确、应用效果不稳定等问题[5-8],这与污染水环境的水质和水体生态的复杂性有关。因此,组合适应能力更强、功能范围更广的复合菌,是今后一段时间内的重要基础性工作之一,这也是本研究的出发点。
菌株之间的组合并不是简单的复配,还要面临生长相容、功能耦合、定殖迅速、活性高等一系列考验。传统的复合菌群构建,基本上是先对不同菌分别组合,然后通过功能效果进行检验和筛选[9,16-18],或者直接通过长期的驯化,直接获得复合菌群[9,19]。这种模式不但效率较低,而且实验室构建完成的菌群在原位环境中应用时也会出现功能不稳定的问题。针对水环境而言,功能菌株在其中的定殖和生态功能的实现,实质上是一个在原位环境中生长和增殖的过程。因此,在复合菌群的构建过程中,确保菌株的生长是一个极其重要的问题。现有的分子生态技术的发展[20-21],可以有效监测混合培养过程中菌株增殖和菌群的变化情况,与传统的培养方法相结合,可以有效发掘能够复配的出发菌株,并通过菌株功能的互补,实现不同功能复合净水功能菌群的构建。尽管采用这种模式获得的复合菌群,如以往获得的大多数复合菌群一样,可能因为实验室混合培养和原位环境的差异而在实际应用中达不到预期的功能效果,但在菌群构建这一过程中具有明显的优势。基于这种理念,本研究快速、有效地初步从11株功能菌中筛选出在混合培养条件下能生长成为优势菌的菌株AOZ1、W14、BSK9和BSK3,并通过进一步的净水实验,构建出适合水体污染物去除的复合净水功能菌群,且在模拟净水实验中,菌群表现出对河道污水中COD和NN较高的去除率。

