茶枯饼提取物对骨髓来源巨噬细胞炎症反应的作用研究*
王 斐,何伟亮,谢 璐,曾招林,陈水亲,宋 涛,刘志平
(赣南医学院1.2017级硕士研究生;2.2016级生物技术本科生;3.基础医学院;4.第一附属医院,江西 赣州 341000)
炎症性肠病(Inflammatory bowel disease, IBD),包括溃疡性结肠炎(Ulcerative Colitis, UC)和克罗恩病(Crohn's Diseases, CD),是一种慢性反复发作的炎症性肠道疾病,表现为腹泻、腹痛和便血等症状,其病变主要累及回肠和结直肠。IBD病情反复发作,迁延不愈,严重影响患者正常的生活质量[1-2]。IBD 的发病机制非常复杂,至今仍未被完全阐明,主要可能与遗传的缺陷、免疫功能的紊乱以及肠道菌群的失调等有关[2-4]。因此,干预上述环节,可能延缓或减弱炎症反应过程。5-氨基水杨酸类化合物、皮质类固醇类激素、多种免疫抑制剂和钙调磷酸酶抑制剂等为临床常用治疗IBD的药物[5]。然而,这些药物存在疗效有限且不良反应多,甚至有致癌作用[6-7]。因此, 寻找一种新型有效且不良反应小的药物成为当务之急。
油茶是山茶科山茶属植物,是中国南方的特色树种[8-9]。油茶树产出的果称为油茶籽,其提炼的油即是茶油。茶油是一种绿色、原生态、高营养的物质,是广为认可的保健食用油,有“东方橄榄油”之称[10]。近年研究显示油茶中含有抗肿瘤、抗氧化、杀菌和抗炎症作用的多种特殊成分[11-14]。茶枯饼为油茶果实榨取茶油后的残渣, 在中药大辞典和岭南草药志中记载茶枯饼含有多种药用成分[15],但具体作用尚不清楚。本研究对茶枯饼进行处理后,获得茶枯饼提取物(Camellia cake extracts, CCEs),以细菌脂多糖(Lipopolysaccharide, LPS)诱导的C57 BL/6小鼠骨髓来源的巨噬细胞(Bone marrow derived macrophages,BMDM)为研究对象,探究CCEs对LPS诱发的炎症反应的影响。
1 材料与方法
1.1材料
1.1.1小鼠的来源C57 BL/6小鼠从南京模式动物研究所购买(N000013),之后饲养在赣南医学院实验动物中心。
1.2方法
1.2.1茶枯饼提取物的提取和纯化CCEs的提取和纯化根据文献描述的方法[16-17]。取油茶籽粕(油茶籽榨取完油后的茶饼),碎粉,过60目筛,加入6倍量的浓度为75%的乙醇溶液回流提取2.5 h。剩余残渣加入4倍量的浓度为75%的乙醇溶液回流提取2 h。然后合并乙醇提取液。将提取液浓缩到原体积的1/5,逐步加入丙酮至不再产生明显沉淀(约为2倍量),放置过夜。滤取沉淀,在50 ℃下,边振边摇加入70%甲醇至刚好溶解,过滤,滤液置于5 ℃左右的环境中静置8 h以上,滤取结晶,得CCEs粗品。取CCEs粗品,过D-101型大孔树脂,10%、30%、50%、70%的乙醇溶液洗脱,TCL检识,得CCEs精制品。
1.2.2BMDM的培养根据文献的方法[18], 取得骨髓细胞,培养在有L-细胞液体的IMDM加入10% FBS、1%的非必需氨基酸和1%的盘尼西林-链霉素, 培养5 d制备BMDM。我们将使用0、30和50 μg·mL-1SQS处理BMDM 12 h,然后用LPS刺激,在0、10、30、60和120 min后收集细胞,用Western-blot测定NF-κB的激活水平。在0、1、4和8 h后收集细胞,测定细胞因子mRNA表达水平。
1.2.3PCR测定目标基因表达在特定时间收集样品,使用Trizol提取RNA,反转录成cDNA, 然后通过目标基因如细胞因子的特定引物使用Sybergreen试剂盒检测基因表达情况。
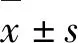
2 结 果
2.1LPS刺激BMDM的合适时间点测定为了研究CCEs能否抑制NF-κB信号通路和促炎症细胞因子产生,我们按照文献方法[19-20]利用LPS刺激下的BMDM来研究。我们探究了LPS刺激BMDM细胞的最适时间与CCEs能够影响LPS刺激的BMDM细胞的最适浓度。我们首先采用1 μg·mL-1的LPS分别刺激BMDM细胞1、2、 4、8和16 h,细胞数量为1×106每组,Control组未受LPS刺激。收细胞后用PCR测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、角质细胞趋化因子(KC)和诱导型一氧化氮合酶(iNOS)的表达水平,发现炎症细胞因子IL-6, TNF-α均在LPS刺激4 h时存在炎症因子峰值,并且抗氧化指标因子iNOS在8 h后呈现下降趋势。各炎症细胞因子峰值均出现在LPS刺激4 h或4 h之前,故本次实验选用4 h之前为LPS刺激BMDM的合适时间点(图1)。
2.2LPS刺激BMDM的合适CCEs浓度测定首先,将CCEs分别稀释为0.625、1.25、2.5、 5、10、20和40 μg·mL-1,分别刺激1×106BMDM 12 h,之后再用浓度为1 μg·mL-1的LPS刺激4 h,其中Control组为未加CCEs与LPS,LPS组为未加CCEs只加LPS,收细胞后用PCR测IL-6和 TNF-α的表达水平。结果显示,当CCEs浓度大约在0.6~1 μg·mL-1左右时,IL-6、TNF-α细胞因子表达水平较单纯LPS刺激有低的趋势,但在高浓度时候,细胞因子表达均处在上升阶段,这也可能与细胞过量刺激有关,因此我们选取CCEs浓度为0.625~2.5 μg·mL-1为刺激BMDM的合适浓度(图2)。
2.3CCEs对LPS刺激的BMDM细胞因子表达的影响当选定出了LPS的最佳刺激时间与CCEs最佳刺激浓度后,为了更加系统全面的研究CCE对于促炎症细胞因子产生的影响,我们将CCEs浓度分为3组,其中0.5 μg·mL-1为低浓度组(CCEs-L),1 μg·mL-1为中浓度组(CCEs-M),2 μg·mL-1为高浓度组(CCEs-H)。之后,我们将3组CCEs浓度分别刺激细胞数为1×106的BMDM细胞12 h之后, 再用1 μg·mL-1LPS刺激4 h,使用PCR测定各类经典炎症细胞因子,其中未加CCEs与LPS刺激设为对照组,单纯LPS刺激4 h设为LPS组。收细胞后用PCR测相关经典炎症细胞因子IL-6、TNF-α、KC和单核细胞趋化蛋白1(MCP-1)的表达水平。经综合对照后发现,3组CCEs浓度刺激中,IL-6、TNF-α、KC、MCP-1炎性细胞因子表达水平与LPS组对比差异无统计学意义(P>0.05),也未出现剂量效应。这些研究结果表明,CCEs在LPS刺激后的BMDM细胞中没有明显的抑制炎症效果(图3、表1)。
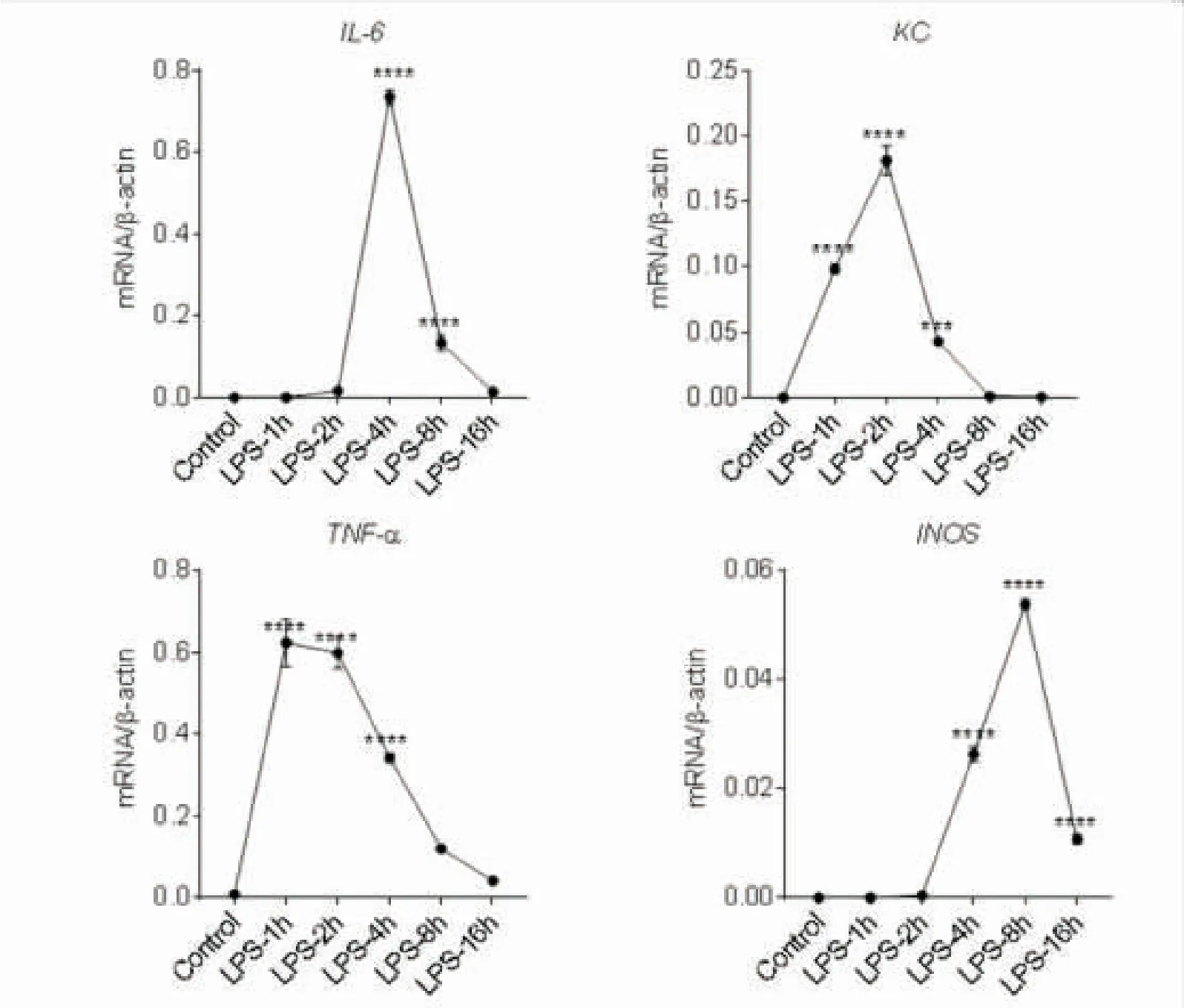
所有LPS刺激组均与Control组比较, ***P<0.001;****P<0.0001。
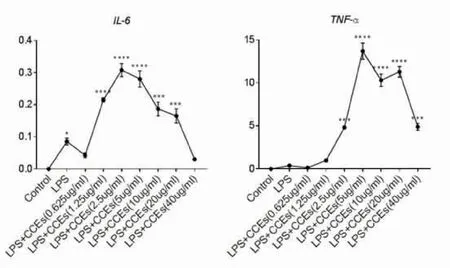
所有LPS+CCEs刺激组均与Control组比较,*P<0.05;***P<0.001;****P<0.0001。
图3 CCEs对LPS刺激的BMDM细胞因子表达的影响
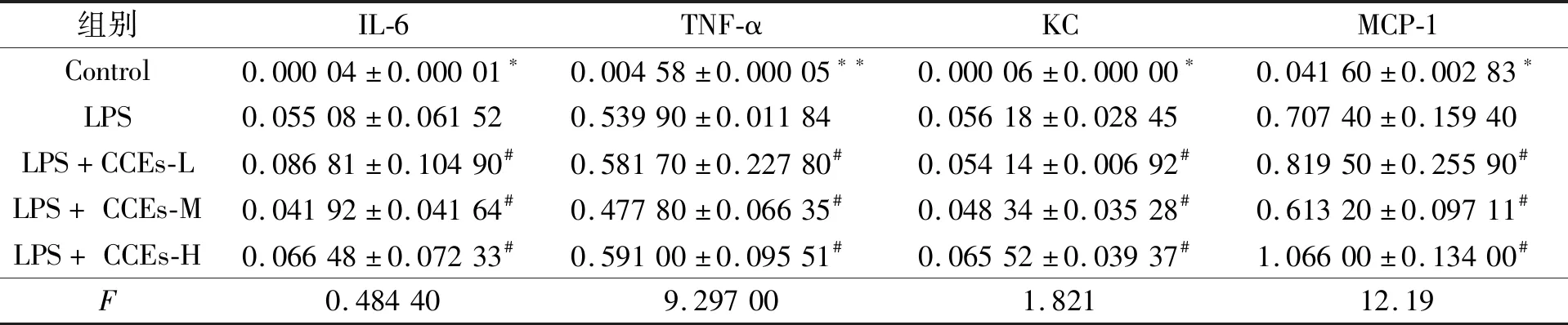
组别IL-6TNF-αKCMCP-1Control0.00004±0.00001∗0.00458±0.00005∗∗0.00006±0.00000∗0.04160±0.00283∗LPS0.05508±0.061520.53990±0.011840.05618±0.028450.70740±0.15940LPS+CCEs-L0.08681±0.10490#0.58170±0.22780#0.05414±0.00692#0.81950±0.25590#LPS+CCEs-M0.04192±0.04164#0.47780±0.06635#0.04834±0.03528#0.61320±0.09711#LPS+CCEs-H0.06648±0.07233#0.59100±0.09551#0.06552±0.03937#1.06600±0.13400#F0.484409.297001.82112.19
注:与LPS组比较,*P<0.05;**P<0.01;#表示差异无统计学意义。
3 讨 论
研究表明,许多植物中茶多酚和茶皂素能够抑制NF-κB信号通路和相关促炎症细胞因子来抑制炎症的发生发展。油茶三萜醇等油茶果提取物能够抑制十四酰佛波乙酯所诱导的小鼠耳炎[21];油茶根提取物能够通过环氧酶与脂肪氧合酶通路抑制花生四烯酸诱导的大鼠的爪部水肿[22]。在我们的研究中,通过参考文献,先用最适浓度的油茶饼提取物与BMDM细胞共培养,然后用LPS刺激,CCEs并没有产生预想的抑制炎症效果,各浓度组CCEs与LPS组在炎症细胞因子表达水平上并未出现明显差别,因此推测CCEs在LPS刺激的BMDM细胞中并未产生相应抑炎影响。我们分析出现这种情况的可能原因是因为我们本次CCEs采用油茶中榨油残渣茶枯饼所得,而文献中多采用植物的籽、茎、根、果等提取,可能后者提取物抗炎成分相对较充足。另外,我们本次实验采用75%乙醇溶剂提取CCEs,而在其它文献中提取方法各异,而在两次实验中[21-22]均采用甲醇溶剂提取油茶果或根所得提取物。提取部位、溶剂和提取时间的不同都能影响提取物成分的不同。可是,就我们目前的研究条件下,75%乙醇所提取的茶枯饼提取物并不能在LPS刺激的BMDM细胞中产生抑制炎症的作用。

