多甲藻和微囊藻竞争利用不同形态磷增殖研究
肖宇梅,陈杨锋,苏玉萍,2*,张立香,佘晨兴,廖福萍
多甲藻和微囊藻竞争利用不同形态磷增殖研究
肖宇梅1,陈杨锋1,苏玉萍1,2*,张立香1,佘晨兴1,廖福萍1
(1.福建师范大学环境科学与工程学院,福建 福州 350007;2.福建省湖库流域生态修复工程研究中心,福建 福州350007)
为了探究不同藻竞争利用不同形态磷对浮游植物群落结构影响,分别以楯形多甲藻不等变种()和铜绿微囊藻()进行PM4A板多磷源单培养实验,并向原位水样添加其两藻种进行5’-单磷酸腺苷(5’-AMP)和磷酸氢二钾(K2HPO4)增殖模拟实验.结果表明:不同的藻种对不同形态磷的竞争利用具有选择性,楯形多甲藻不等变种和铜绿微囊藻分别能够利用溶解性有机磷(DOP)35种和25种,两种藻能够较好的利用氨基酸和核苷酸.当以楯形多甲藻不等变种调控起始生物量占比(绿藻:甲藻:硅藻:蓝藻为38%:26%:20%:7%),无论以有机磷还是无机磷为磷源,甲藻的竞争优势明显,生物量占比达37.11%~50.19%;当以铜绿微囊藻调控起始生物量占比(绿藻:蓝藻:硅藻:甲藻为38%:29%:20%:4%),蓝藻竞争优势明显,生物量占比达52.25%~53.44%.在温度和光照等环境条件一定的情况下,磷源形态和藻类起始生物量结构共同影响浮游植物群落结构演替.
楯形多甲藻不等变种;铜绿微囊藻;5’-单磷酸腺苷(5’-AMP);群落结构
全球多甲藻和微囊藻频发,是形成水华的常见藻类群体[1-5].磷是浮游植物生长的必需营养元素之一,也是导致富营养化的重要营养盐.溶解性无机磷(DIP)是浮游植物生长所需要的最重要磷源,然而,近些年的研究也发现溶解性有机磷(DOP)同样能被浮游植物吸收利用[6-7],在溶解性无机磷贫乏的水域,DOP在浮游植物的生长中扮演着重要角色.部分难以被藻类直接利用的有机磷(如植酸等有机磷)在细菌的作用下转化为DOP,进而被藻类有效利用[8-9].
藻类对有机磷的利用具有选择性,但就目前淡水甲藻对有机磷的利用情况少有研究,多甲藻能够分泌碱性磷酸酶(AP)的独有生理生态优势使其能在无机磷浓度较低的情况下,分泌AP产生正磷酸盐以满足生长需要[3].与淡水甲藻对磷源的利用情况研究相比,海洋甲藻对有机磷的利用研究相对较为广泛,如有学者研究短凯伦藻()和米氏凯伦藻()对29种DOP利用情况,结果表明两种藻类对磷酸单酯的利用效果高于无机磷(NaH2PO4),而对磷酸二酯和膦酸酯中大部分有机磷利用效果较差[10].5种水华浮游藻类对9种DOP的利用情况,结果发现海洋原甲藻()和海洋卡盾藻()利用DOP能力较强并能够在群落结构中发挥竞争优势,大多数核苷酸(ATP; AMP; CMP; GMP和UMP)和磷酸单酯(G6P)中生长更好.而在湖泊蓝藻水华形成的初期,DIP含量不足,DOP将作为补充磷源,促进水华蓝藻的生长[11-12].磷酸氢二钾(K2HPO4)和有机磷甘油磷酸钠(NaGly)是藻细胞优先利用的磷源,促进铜绿微囊藻的生长[13].同时相关研究表明,群落演替状况与初始浮游植物生物量比例密切相关[14-15].苏玉萍等[16]研究了有机磷AMP培养下3个水库不同起始浮游植物群落结构的演替,结果表明有机磷AMP能有效促进甲藻的增殖,进而改变浮游植物群落结构.
通过以上研究发现磷源形态的不同和起始浮游植物群落结构是藻类增殖的重要因素,但现有研究局限于有限磷源对藻类的利用效果,且更多的研究都关注在海洋藻类对有机磷的响应,而淡水藻类对有机磷的相应研究较少.目前,甲藻和蓝藻利用有机磷能力的差异以及其竞争优势尚不明确.借此,为了探究不同藻竞争利用不同形态磷对浮游植物群落结构影响,本文采用PM4A多磷源培养板提供的54种DOP和5种DIP对楯形多甲藻不等变种和铜绿微囊藻的单培养增殖影响进行研究,再以添加楯形多甲藻不等变种和铜绿微囊藻进行了不同形态磷营养盐培养条件下浮游植物群落演替实验,比较在不同起始浮游植物种类和生物量的水体中,在有机磷和无机磷营养盐条件下,浮游植物竞争和群落演替情况研究,以期为富营养化水体藻类水华的防控提供科学参考.
1 材料与方法
1.1 实验藻种和有机磷
本实验以楯形多甲藻不等变种和铜绿微囊藻为研究对象,藻株购自于中国科学院淡水藻种库. PM4A磷源板上提供了5种DIP和54种DOP(美国BIOLOG公司),其中包含了绝大多数DOP类别,如单磷酸核苷酸(NMP)、二硫代磷酸盐、氨基酸等.
1.2 样品采集
在2016~2018年对三十六脚湖(25°27′-25°29′N, 118°23′-118°27′E)研究调查发现,水质逐渐呈富营养化趋势.2016年5月下旬,2017年10月以及2018年5月在三十六脚湖库区部分水域均发生微囊藻水华.为了更好地了解水华发生期浮游植物群落结构,本研究开展模拟实验于水华前期2017年9月采集三十六脚湖表层水样2.5L,1L现场加入15mL鲁哥试剂固定,作为浮游植物定量样品;另采集5L水样带回实验室开展模拟试验.定性样品用25#浮游生物网在水面下大范围捞取获得.定量样品带回实验室静置48h后虹吸浓缩至30mL,进行定量计数[17],水样低温避光保存.
1.3 实验设计
本实验以楯形多甲藻不等变种和铜绿微囊藻进行PM4A磷源板单培养实验,再以楯形多甲藻不等变种和铜绿微囊藻为添加藻类调控三十六脚湖水样起始生物量占比改变浮游植物群落结构,探究5’-单磷酸腺苷(5’-AMP)作为磷源,磷酸氢二钾(K2HPO4)作为对照,有机磷源对浮游植物种间竞争及群落演替的影响.
1.3.1 培养条件 楯形多甲藻不等变种和铜绿微囊藻的培养分别采用无磷119培养基和无磷BG-11培养基,单培养实验温度设置为(15±1)℃,磷调控实验温度设置为(25±1)℃,光照采用白色冷光源,光照强度2000lx,光暗比12h:12h,每天定期摇动锥形瓶,以防止藻细胞贴壁生长及缺氧.
1.3.2 实验设置 (1)单培养实验
实验藻种先无磷处理72h以耗尽藻细胞内的磷酸盐.向PM4A磷源板各微孔中分别注入100μL灭菌去离子水溶解各微孔中的磷营养物质.将各微孔中的磷源母液转移50μL到细胞培养板对应微孔中.向细胞培养板各微孔中分别加入150μL磷饥饿处理后的楯形多甲藻不等变种和铜绿微囊藻,进行两种藻的单培养实验.实验体积均为200μL.每组设置2个平行.
(2)磷调控实验
藻种先无磷处理72h以耗尽藻细胞内的磷酸盐.参照《水和废水监测分析方法(第四版)》[18],测定三十六脚湖原位水样总磷(TP)含量为0.03mg/L,总氮(TN)含量为0.52mg/L,参考《地表水环境质量标准》(GB3838-83)[19]可知三十六脚湖水环境质量属于Ⅱ类水标准,且该湖区为磷限制状态,为了更好地了解该湖区在水华期浮游植物群落结构状态,本文采用实验室内模拟湖区Ⅲ类水标准添加初始磷浓度为0.05mg/L的无机磷K2HPO4和有机磷5'-dAMP,同时添加藻种调节该湖区浮游植物起始群落结构探究多甲藻和微囊藻竞争利用不同形态磷增殖情况,实验过程中不再添加磷营养物质.湖区原水样的模拟试验设4个实验组,见表1.

表1 水体浮游植物初始生物量比例(%)
1.3.3 细胞计数 (1)单培养实验
第7d和15d将细胞培养板各微孔中的藻液转移到做好记号的对应0.5mL离心管中,分别加入适量鲁哥试剂固定,于徕卡显微镜(Leica BM-E)下用0.1mL(20mm×20mm)浮游生物计数框计数,根据式(1)计算细胞密度,并换算生物量[17].接种后暂养1d,次日起为第1d.第7d和15d观察细胞培养板各微孔中藻细胞的生长情况.藻细胞在各磷源中的生长情况以相对生长(the relative growth,RG)表示.相对生长以各磷源中藻类生物量与对照组中藻类生物量的比值确定.

式中:为细胞丰度,cells/L;为计数框面积,mm2;0为计数视野面积,mm2;0为浓缩后体积,mL;为计数体积,mL;为计数所得藻类个数,cells.
(2)磷调控实验
接种后暂养1d,次日起为第1d.向原位水样添加藻类磷调控实验于第3、6、9、12和15d在显微镜(Leica BM-E)下计数,根据式(1)计算各组细胞密度,并换算成生物量[17].
1.3.4 生物量换算 考虑到实验2种藻单个细胞的体积差较大,本实验以生物量评价2种藻在不同磷源中的生长情况.藻类的比重接近1,因此,可由藻类体积直接换算生物量(湿重).藻类生物量为细胞密度与平均体积(视藻类为球体,利用球体积公式计算)相乘所得,单位为mg/L[17].单培养实验细胞培养板上各微孔中楯形多甲藻不等变种的起始细胞密度均为2.52×105cells/L;铜绿微囊藻的起始细胞密度均为3.02×107cells/L.细胞培养板各微孔中2种藻的起始生物量近似1:1,单培养时约为2.0mg/L.
1.3.5 统计分析 通过每组实验的平行样计算平均值及标准偏差(=5).实验组和对照组的显著差异用one-way ANOVA进行分析,Tukey test(=0.05)用于平均值的检验(<0.05表示具有统计学意义).
2 结果与分析
2.1 单培养楯形多甲藻不等变种和铜绿微囊藻对不同种类有机磷的利用及其生长
为期15d的单培养后,楯形多甲藻不等变种可利用DOP有35种,其中包括有21种非核苷酸DOP和14种单磷酸核苷酸(NMP)(图1).非核苷酸DOP中对楯形多甲藻不等变种生长促进效果较好的有六磷酸肌醇、二硫代磷酸盐、磷酸葡萄糖(D-氨基葡萄糖6-磷酸,D-G6P)、磷酸烯醇式丙酮酸(PEP)和膦酰基乙酸等,相对生长(RG)比值均在1.21~2.34之间.楯形多甲藻不等变种在单磷酸核苷5’-AMP、3’-GMP、5’-UMP、5’-CMP和3’-UMP中生长较好,相对生长(RG)比值均在1.51~1.94之间.而可利用的DIP有三偏磷酸钠和次磷酸钠,楯形多甲藻不等变种生物量有明显增加,相对生长(RG)比值分别为1.69和1.66,大于磷酸盐(RG为1.10).楯形多甲藻不等变种在其可利用的多数DOP中生长情况优于无机磷酸盐.
为期15d的单培养后,铜绿微囊藻可利用DOP有25种,其中包括有16种非核苷酸DOP和9种单磷酸核苷酸(NMP)(图1).非核苷酸DOP对铜绿微囊藻生长促进效果较好的有膦酰基乙酸(RG=2.34)、O-磷酸-D-丝氨酸(RG=1.98)、2-氨基乙基膦酸(RG=2.11)、硫代磷酸盐(RG=1.66)和D-磷酸酪氨酸(RG=1.28)等.铜绿微囊藻在单磷酸核苷酸5’-UMP (RG=1.86)和5’-GMP(RG=1.26)中生长最好,明显大于无机磷.而可利用的DIP有焦磷酸盐(RG=1.40)和三聚磷酸盐(RG=1.53),均高于磷酸盐(RG=1.12).
15d的单培养结果表明,2种藻均生长良好的DOP包括3’-AMP、5’-AMP、5’-UMP、磷酸葡萄糖(D-G6P)、磷酸胆碱、氨基酸、膦酰基乙酸和六磷酸肌醇等.
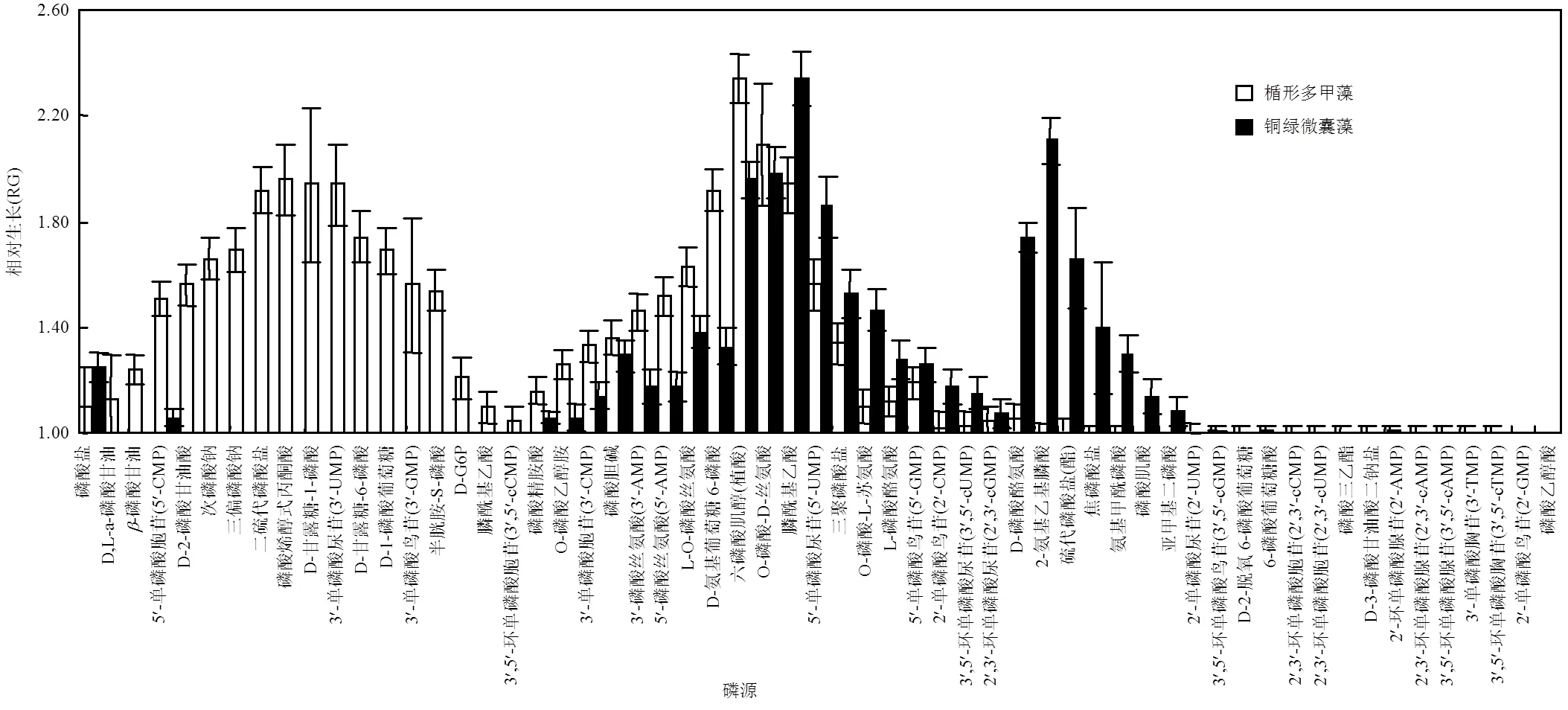
图1 单培养楯形多甲藻不等变种和铜绿微囊藻在不同磷源中的生长情况
本研究表明,不同形式的磷源会对纯种藻类的生长和竞争产生影响.实验的54种DOP中,核苷酸和氨基酸对2种藻具有较高的营养价值,大部分磷酸单酯和少数膦酸盐(酯)对楯形多甲藻的生长具有较高的营养价值.Kononova等[20]发现了膦酰乙醛水解酶可以水解2-氨乙基膦酸.楯形多甲藻可能也含有类似的膦酸酶可以促进膦酰基乙酸的水解.大部分糖类衍生物,如六磷酸肌醇和D-氨基葡萄糖-6-磷酸对铜绿微囊藻的生长有促进作用, RG分别为1.96和1.33.膦酸盐(膦酰基乙酸和2-氨乙基膦酸)和6种氨基酸对铜绿微囊藻的生长均有促进作用.有研究表明与磷酸氢二钾(K2HPO4)和焦磷酸钠(Na4P2O7)相比,三聚磷酸钠(Na5P3O10)对铜绿微囊藻现存量的影响最大[21].本文结果表明楯形多甲藻不等变种和铜绿微囊藻对有机磷AMP的利用效果较好.有研究表明AMP是水中常见的有机磷成分,相对分子量较低,容易被生物利用,且已有研究表明AMP可以被一些水华常见藻种有效利用,且表明不同藻类对溶解性有机磷的利用能力不同[22].此外,结合我们前期研究表明有机磷AMP能有效促进甲藻的增殖,进而改变浮游植物群落结构[14],因此本研究选择了5’-AMP作为有机磷源,探究其对浮游植物群落结构演替的影响.
2.2 不同形态磷培养条件下浮游植物群落结构演替
2.2.1 三十六脚湖原水中浮游藻类特征 共检出浮游植物6门34属(种),绿藻门种类数为12属(种),占总种类数的35.29%;硅藻门9属(种),占总种类数的26.47%;蓝藻门6种,占总种类数的17.65%;隐藻门4属(种),占总种类数的11.76%;裸藻门2属(种),占总种类数的5.89%;甲藻门1属(种),占总种类数的2.94%.水体起始浮游植物总细胞密度为1.90× 107cells/L,生物量近似为3.62mg/L,浮游植物群落为甲藻(0.20mg/L,5.56%)、绿藻(1.75mg/L,48.23%)、硅藻(0.90mg/L,24.81%)、蓝藻(0.32mg/L,8.89%)和隐藻(0.51mg/L,4.17%),绿藻门中以栅藻(0.25mg/L,6.17%)和盘星藻(1.06mg/L,26.16%)居多,蓝藻门中以微囊藻属(0.10mg/L,2.78%)居多(图2).
2.2.2 楯形多甲藻不等变种调控下不同磷源对浮游植物群落结构演替影响 向三十六脚湖秋季的表层水样中添加楯形多甲藻不等变种后改变了浮游植物群落起始结构(绿藻:硅藻:甲藻:蓝藻= 38%:20%:26%:7%),浮游植物群落结构为绿藻(1.75mg/L,37.79%),甲藻(1.20mg/L,26.00%)、硅藻(0.90mg/L,19.44%)、蓝藻(0.32mg/L,6.97%)、裸藻(0.30mg/L,6.53%)、隐藻(0.15mg/L,3.27%)(图3).
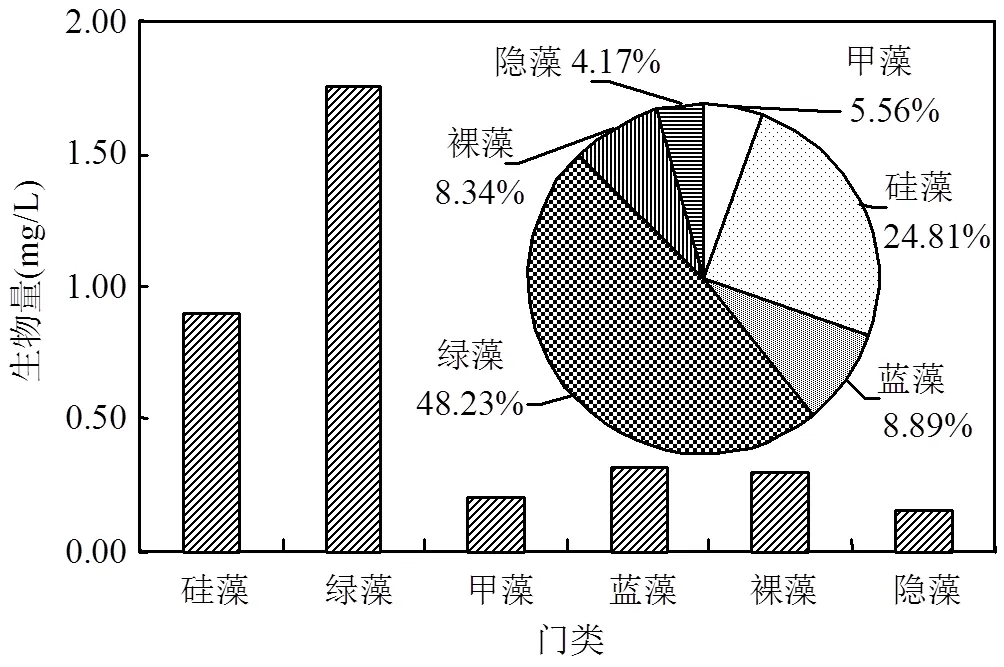
图2 三十六脚湖原位水体中浮游植物种类和群落结构生物量占比

有机磷(5'-dAMP)组实验中,浮游植物总生物量由4.62mg/L逐渐增加到5.21mg/L.浮游植物群落结构从以绿藻(1.75mg/L,37.79%)、甲藻(1.20mg/L, 26.00%)、硅藻(0.90mg/L,19.44%)和蓝藻(0.32mg/L, 6.97%)为主演替为甲藻(2.62mg/L,50.19%)和绿藻(1.76mg/L,33.66%)为优势类群,硅藻生物量有所下降,生物量占比降至5.74%.当浮游植物群落结构中甲藻的起始生物量占比约30%时,甲藻竞争优势明显,从26.00%增加到50.19%,并成为优势种,而蓝藻的起始生物量占比低于10%时难以发挥优势(= 0.0038),绿藻的生物量下降,从37.79%下降到33.66%,此时绿藻竞争利用有机磷能力相对甲藻而言更弱(= 0.003).
对于无机磷(K2HPO4)对照组,浮游植物总生物量由4.62mg/L增加到5.97mg/L.浮游植物群落结构从以绿藻(1.75mg/L,37.79%)、甲藻(1.20mg/L, 26.00%)、硅藻(0.90mg/L,19.44%)和蓝藻(0.32mg/L, 6.97%)为主演替为以甲藻(2.21mg/L,37.11%)、绿藻(1.88mg/L,31.54%)和硅藻(1.07mg/L,17.92%)为主.可以看出,无机磷组几种藻类的增殖比较均衡,而且发现当浮游植物群落结构中蓝藻的起始生物量占比小于10%时,绿藻的生物量下降,从37.79%下降到31.54%,蓝藻竞争优势难以发挥,反而甲藻的竞争优势比蓝藻更明显(= 0.002).
比较有机磷组和无机磷组发现,添加楯形多甲藻不等变种调控三十六脚湖原位水样浮游植物群落演替中,楯形多甲藻在整个实验持续时间呈显著的竞争性优势.当浮游植物群落结构中甲藻的起始生物量占比约30%时,2种磷源条件下,甲藻的竞争优势明显(=0.53).当蓝藻的起始生物量占比低于10%时, 2种磷源条件下蓝藻难以发挥竞争优势(= 0.12).当绿藻的起始生物量占比40%左右时,2种磷源条件下绿藻在浮游植物群落结构中难以发挥优势,其竞争利用有机磷营养盐的能力较弱于甲藻(= 0.023).
2.2.3 铜绿微囊藻调控下不同磷源对浮游植物群落结构演替影响 向三十六脚湖表层水样中添加铜绿微囊藻后改变浮游植物群落起始结构(绿藻:硅藻:甲藻:蓝藻=38%:20%:4%:29%),浮游植物群落结构为绿藻(1.75mg/L,37.79%)、蓝藻(1.32mg/L, 28.61%)、硅藻(0.90mg/L,19.44%)、甲藻(0.20mg/L, 4.36%)、裸藻(0.30mg/L,6.53%)和隐藻(0.15mg/L, 3.27%)(图4).
对于有机磷(5'-dAMP)实验组,浮游植物总生物量从4.62mg/L减少至4.22mg/L.浮游植物群落结构从绿藻(1.75mg/L,37.79%)、蓝藻(1.32mg/L,28.61%)、硅藻(0.90mg/L,19.44%)为主演替为以蓝藻(2.26mg/ L,53.44%)和绿藻(1.71mg/L,40.54%)为主,硅藻失去竞争优势,生物量由0.90mg/L减少至0.05mg/L,铜绿微囊藻在浮游植物群落增殖竞争中具有明显的竞争优势,生物量由1.48mg/L(46.30%)增加到2.24mg/ L(53.06%),绿藻生物量占比从37.79%增加到40.54%,其增殖幅度较小.当浮游植物群落结构中甲藻的起始生物量占比小于10%时,甲藻在有机磷中的竞争优势难以发挥,反而是蓝藻的竞争优势明显(=0.0017).
对于无机磷(K2HPO4)对照组,浮游植物总生物量持续增长到4.80mg/L.浮游植物群落结构从绿藻(1.75mg/L,37.79%)、蓝藻(1.32mg/L,28.61%)、硅藻(0.90mg/L,19.44%)为主演替为以蓝藻(2.51mg/L, 52.25%)和绿藻(1.69mg/L,35.22%)为优势门类,硅藻生物量占比减小至7.29%,蓝藻的生物量占比从28.61%增加到52.25%,蓝藻在浮游植物群落结构中演替为优势门类,其中铜绿微囊藻表现出明显的竞争增殖优势,生物量占比由23.82%增长到51.89%,绿藻的生物量降低,生物量占比从37.79%下降到35.22%.当浮游植物群落结构中蓝藻的起始生物量占比约30%时,蓝藻在无机磷中的竞争优势明显(=0.0017).
比较有机磷组和无机磷组发现,添加铜绿微囊藻调控三十六脚湖原位水样浮游植物群落演替中,铜绿微囊藻在整个实验持续时间呈显著的竞争性优势,绿藻较落后于蓝藻竞争利用磷源.该实验结果存在差异性可能与浮游植物起始生物量有关,与Keating[23]和陈洁[24]得到的藻类初始比例对竞争结果有重要影响的结果一致.当浮游植物群落结构中蓝藻的起始生物量占比约30%时,2种磷源条件下,蓝藻的竞争优势明显(=0.89).当甲藻的起始生物量占比低于10%时,2种磷源条件下,甲藻的竞争优势难以发挥(=0.99).当绿藻的起始生物量占比达40%左右时,2种磷源条件下,绿藻在浮游植物群落结构演替中难以发挥优势,其竞争利用无机磷营养盐能力的可能较弱于蓝藻(=0.82).
已有的研究更多关注于添加无机形态的氮磷营养盐对水体浮游植物群落结构演替的影响.实际上,在磷酸盐有限的水域,DOP可以占据水体总磷(TP)较高比例.某些能有效利用DOP的藻类容易在DIP浓度较低情况下获得竞争优势而大量生长成为优势种,甚至形成水华,影响水质和水生态安全.

有机磷组实验结果表明,起始生物量多甲藻:微囊藻为近4:1时,浮游植物演替为以甲藻(2.62mg/L, 50.19%)和绿藻(1.76mg/L,33.66%)为主,甲藻的生物量达2.62mg/L,其占比从26.00%增加到50.19%,说明甲藻能有效利用有机磷并在浮游植物群落结构中占据优势,此实验结果与单培养实验表明楯形多甲藻能更好的利用有机磷,如其对氨基酸和核苷酸类更能有效利用结果一致,由此也验证了楯形多甲藻在实际水体中也能够有效利用5’-AMP生长增殖,该实验结果与苏玉萍等[16]研究结果一致;但当起始生物量多甲藻:微囊藻为1:7时,浮游植物群落结构主要以蓝藻(2.26mg/L,53.44%)和绿藻(1.71mg/L, 40.54%)为主,甲藻能够利用有机磷,但甲藻难以在其群落结构中发挥优势,蓝藻竞争利用有机磷增殖能力优于甲藻而占据优势,这实验结果可能受起始生物量占比的影响,但也有可能是因为本实验研究采用的有机磷5’-AMP并不是最适用于多甲藻生长增殖的有机磷,存在一定的局限性.而董云伟等[25]发现,藻类以不同比例混合培养时,2种藻类的竞争结果差异明显,从而改变浮游植物群落结构,本研究结果与其结果相一致.通过以上两组调控实验发现,甲藻和绿藻均可利用有机磷5’-AMP,但其利用吸收有机磷生长增殖的能力有所不同,在不同的起始生物量占比情况下将影响甲藻演替为群落结构优势种,这与Uchida等[14]研究甲藻之间的竞争结果取决于藻种初始细胞密度的结果一致.
无机磷组实验结构表明,不同起始生物量多甲藻:微囊藻为近4:1时,各种浮游植物生长较为均衡,以甲藻(2.21mg/L,37.11%)和绿藻(1.88mg/ L,31.54%)为主,而单培养实验结果表明,微囊藻能更好的利用无机磷,但在此无机磷实验组中,蓝藻难以发挥竞争优势,反而甲藻占据优势,这可能是与浮游植物起始生物量占比有关,而且陈露等[26]研究发现甲藻在低正磷酸盐浓度的环境条件下适应能力较强,在浮游植物群落中更有竞争优势,以及晁建颖等[27]研究表明藻初始密度会影响铜绿微囊藻生长速度,研究趋势基本一致,区别在于本研究采用的生物量“mg/L”,而其研究采用的是细胞密度“cells/L”,计算方式上有差异可能会导致结果有所不同,但两者都体现了藻类的增殖趋势.当起始生物量多甲藻:微囊藻为1:7时,无机磷组浮游植物群落结构以蓝藻(2.51mg/L,52.25%)和绿藻(1.69mg/L,35.22%)为主,蓝藻能够较好地有效利用无机磷生长增殖,此实验结构与单培养实验表明在一定条件下相比于竞争利用有机磷,微囊藻能够更好地利用无机磷的结果一致,也验证微囊藻在实际水体中同样能够利用无机磷.陈纯等[28]发现,适量添加磷营养盐(KH2PO4)可提高浮游植物群落结构的多样性.同时与沉积物中无机磷所占比例较高的湖泊更容易爆发蓝藻水华的结果相一致[29].
本研究在实验室培养条件下观察不同起始藻种源生物量占比和磷源形态对浮游植物群落结构演替的影响.当以楯形多甲藻不等变种调控起始生物量绿藻:甲藻:硅藻:蓝藻为38%:26%:20%:7%,2种磷源条件下,甲藻的竞争优势明显生物量占比达37.11%~ 50.19%.当以铜绿微囊藻调控起始生物量绿藻:蓝藻:硅藻:甲藻为38%:29%:20%:4%,2种磷源培养条件下蓝藻竞争优势明显生物量占比达52.25%~53.44%.综上研究发现,同一生态环境中的浮游植物的种间竞争及群落演替情况取决于生态环境中各物种对营养盐的利用效率和对环境的适应能力,从而导致浮游植物群落结构的演替情况随时间和环境状态的变化而变化,这与Vuorio等[30]研究结果一致.
3 结论
3.1 楯形多甲藻不等变种和铜绿微囊藻均能利用DOP维持生长,可利用有机磷分别达35种和25种,两者均可很好的利用核苷酸(5’-AMP、5’-CMP、3’-GMP等)、氨基酸(O-磷酸-D-丝氨酸、L-O-磷酸丝氨酸等)、糖类衍生物(六磷酸肌醇(植酸)、D-氨基葡萄糖6-磷酸等)、磷酸甘油(-磷酸甘油、D-2-磷酸甘油酸)和膦酸盐(膦酰基乙酸等).
3.2 当库区浮游植物群落结构中蓝藻的起始生物量占比小于10%,甲藻的起始生物量达30%,绿藻的起始生物量约达40%时,2种磷源条件下甲藻均表现出明显的竞争优势,绿藻竞争利用磷营养盐优势落后于甲藻,而蓝藻难以发挥竞争优势.此时库区浮游植物群落结构由绿藻(37.79%)、甲藻(26.00%)和硅藻(19.44%)演替为以甲藻(37.11%~50.19%)和绿藻(31.54%~33.66%)为主.
3.3 当库区浮游植物群落结构中蓝藻的起始生物量约达30%,甲藻的起始生物量占比小于10%,绿藻的起始生物量约达40%时,2种磷源条件下,蓝藻都表现出明显的竞争优势,绿藻竞争利用磷营养盐优势落后于蓝藻,而甲藻难以发挥竞争优势.此时库区浮游植物群落结构由绿藻(37.79%)、蓝藻(38.61%)和硅藻(19.44%)演替为以蓝藻(52.25%~53.44%)和绿藻(35.22%~40.54%)为主.
[1] Kishimoto N. Mathematical simulation on accumulation process of a blooming plankton(Dinophyceae) in a dam reservoir [J]. Water Sci.technol.water Supply, 2001,1(2):37-48.
[2] Regel, R. H. Vertical migration, entrainment and photosynthesis of the freshwater dinoflagellatein a shallow urban lake [J]. Journal of Plankton Research, 2004,26(2):143-157.
[3] 吴兴华,李 翀,陈 磊,等.三峡水库香溪河库湾拟多甲藻()水华对环境中磷的响应机制[J]. 湖泊科学, 2017,(5). Wu X H, Li C, Chen L, et al. Response mechanism of Peridiniopsis bloom to phosphorus in the environment in xiangxi river bay, three gorges reservoir [J]. Science of lakes, 2017,(5).
[4] 姚绪姣.三峡水库香溪河库湾浮游植物群落结构演替规律研究[D]. 宜昌:三峡大学, 2013. Yao X J. Research the succession rules of phytoplankton community structure in xiangxihe kuwan, three gorges reservoir [D]. Yichang: Three gorges university, 2013.
[5] 边归国.九龙江拟多甲藻水华预警和应急处置的初步研究[J]. 中国环境管理, 2013,5(3):30-34.Bian G G. Preliminary study on early warning and emergency response of multiple dinoflagellates bloom in jiulong river [J]. China environmental management, 2013,5(3):30-34.
[6] Yang H, Flower R J, Thompson J R. Sustaining China's Water Resources [J]. Science, 2013,339(6116):141.
[7] Mather R L, Reynolds S E, Wolff G A, et al. Phosphorus cycling in the North and South Atlantic Ocean subtropical gyres [J]. Nature Geoscience, 2008,1(7):439-443.
[8] 张 民,史小丽,蒋丽娟,等.两种外源性磷及振荡对铜绿微囊藻()生长的影响[J]. 应用与环境生物学报, 2002,8(5):507-510.Zhang M, Shi X L, Jiang L J, et al. Effects of two exogenous phosphorus and oscillation on the growth of[J]. Chinese journal of applied and environmental biology, 2002,8(5):507-510.
[9] 邹 迪,肖 琳,杨柳燕,等.不同形态磷源对铜绿微囊藻与附生假单胞菌磷代谢的影响[J]. 环境科学, 2005,26(3):118-121.Zou D, Xiao L, Yang L Y, et al. Effects of different phosphorus sources on phosphorus metabolism of microcystis aeruginosa and pseudomonas aeruginosa [J]. Environmental science, 2005,26(3):118-121.
[10] Richardson B, Corcoran A A. Use of dissolved inorganic and organic phosphorus by axenic and nonaxenic clones ofand[J]. Harmful Algae, 2015,48:30-36.
[11] Wang Z, Li D, Li G, et al. Mechanism of photosynthetic response inPCC7806 to low inorganic phosphorus [J]. Harmful Algae, 2010,9(6):613-619.
[12] Li J, Wang Z, Cao X, et al. Effect of orthophosphate and bioavailability of dissolved organic phosphorous compounds to typically harmful cyanobacterium[J]. Marine Pollution Bulletin, 2015,92(1/2):52-58.
[13] 邓 洪,刘惠见,包 立,等.铜绿微囊藻污染下滇池草海表层沉积物中各形态磷的含量 [J]. 湿地科学, 2018,16(6):808-815.Deng H, Liu H J, Bao L, et al. Phosphorus content in the surface sediments of grass sea in dianchi lake underpollution [J]. Wetland science, 2008,16(6):808-815.
[14] Uchida T, Toda S, Matsuyama Y, et al. Interactions between the red tide dinoflagellatesandin laboratory culture [J]. Journal of Experimental Marine Biology and Ecology, 1999,241(2):285-299.
[15] 李 慧,王江涛.东海原甲藻与中肋骨条藻的种间竞争特征[J]. 生态学报, 2012,32(4):1115-1123. Li H, Wang J T. Interspecific competition betweenandof the east China sea [J]. Journal of Ecology, 2012,32(4):1115-1123.
[16] 苏玉萍,张立香,陈杨锋,等.有机磷培养下水体浮游植物竞争与群落结构演替[J]. 生态学报, 2018,(16):5679-5687. Su Y P, Zhang L X, Chen Y F, et al. Phytoplankton competition and community structure succession in water under organic phosphorus culture [J]. Journal of Ecology, 2018,(16):5679-5687.
[17] 章宗涉,黄祥飞.淡水浮游生物研究方法[M]. 北京:科学出版社, 1991. Zhang Z S, Huang X F. Methods of freshwater plankton research [M]. Beijing: science press, 1991.
[18] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2009. State Environmental Protection Administration of China. Methods for monitoring and analysis of water and wastewater (fourth edition) [M]. Beijing: Chinese Environmental Science Press, 2009.
[19] GB3838-83 地表水环境质量标准 [S]. 2002. GB3838-83 Environmental quality standard for surface water [S]. 2002.
[20] Kononova S V, Nesmeyanova M A. Phosphonates and Their Degradation by Microorganisms [J]. Biochemistry (Moscow), 2002, 67(2):184-195.
[21] 赵秀侠.太湖蓝藻水华形成过程中的浮游植物群落动态及其驱动因素研究[D]. 合肥:安徽大学, 2013. Zhao X X. Phytoplankton community dynamics and driving factors during the formation of cyanobacteria bloom in taihu lake [D]. Hefei: Anhui university, 2013.
[22] Wang Z H, Liang Y, Kang W. Utilization of dissolved organic phosphorus by different groups of phytoplankton taxa [J]. Harmful Algae, 2011,12(4):113-118.
[23] Keating K I. Blue-green algal inhibition of diatom growth: transition from mesotrophic to eutrophic community structure [J]. Science, 1978,199(4332):971-973.
[24] 陈 洁,段舜山,李爱芬,等.眼点拟微绿球藻与扁藻在不同接种比例下的竞争[J]. 海洋科学, 2003,27(5):73-76. Chen J, Duan S S, Li A F, et al. Competition betweenandat different inoculation rates [J]. Marine science, 2003,27(5):73-76.
[25] 董云伟,董双林,刘相义.不同起始浓度对塔玛亚历山大藻和赤潮异弯藻种群竞争的影响[J]. 中国海洋大学学报(自然科学版), 2004, 34(6):964-968.Dong Y W, Dong S L, Liu X Y. Effects of different initial concentrations on population competition ofand[J]. Journal of ocean university of China (natural science edition), 2004,34(6):964-968.
[26] 陈 露,李纯厚,魏小岚,等.南沙海域夏季氮磷添加模拟实验中浮游植物群落的变化[J]. 南方水产科学, 2015,11(5):56-66.Chen L, Li C H, Wei X L, et al. Phytoplankton community changes in the simulation experiment of nitrogen and phosphorus addition in summer in nansha waters [J]. Southern aquatic science, 2015,11(5):56-66.
[27] 晁建颖,颜润润,张毅敏.不同温度下铜绿微囊藻和斜生栅藻的最佳生长率及竞争作用[J]. 生态与农村环境学报, 2011,27(2):53-57. Chao J Y, Yan R R, Zhang Y M. Optimal growth rates and competitive effects ofandat different temperatures [J]. Journal of ecology and rural environment, 2011,27(2):53-57.
[28] 陈 纯,李思嘉,肖利娟,等.营养盐加富和鱼类添加对浮游植物群落演替和多样性的影响[J]. 生态学报, 2013,33(18):5777-5784. Chen C, Lli S J, Xiao L J, et al. Effects of nutrient enrichment and fish addition on phytoplankton community succession and diversity [J]. Journal of Ecology, 2013,33(18):5777-5784.
[29] 黎 睿,王圣瑞,肖尚斌,等.长江中下游与云南高原湖泊沉积物磷形态及内源磷负荷[J]. 中国环境科学, 2015,35(6):1831-1839. Li R, Wang S R, Xiao S B, et al. Phosphorus morphology and endogenous phosphorus load in sediments in the middle and lower reaches of the Yangtze river and yunnan plateau lakes [J]. China Environmental Science, 2015,35(6):1831-1839.
[30] Vuorio K, Lagus A, Lehtimaki J M, et al. Phytoplankton community responses to nutrient and iron enrichment under different nitrogen to phosphorus ratios in the northern Baltic Sea [J]. Journal of Experimental Marine Biology and Ecology, 2005,322(1):39-52.
Proliferation of different forms of phosphorus in the competition ofand.
XIAO Yu-mei1, CHEN Yang-feng1, SU Yu-ping1,2*, ZHANG Li-xiang1, SHE Chen-xing1, LIAO Fu-ping1
(1.College of Environmental Science and Engineering, Fujian Normal University, Fuzhou 350007, China;2.Fujian Key Laboratory of Pollution Control and Resource Recycling, Fujian Normal University, Fuzhou 350007, China)., 2019,39(11):4796~4803
To investigate the competitive utilization of different phosphorus species by different algal species and their influences on phytoplankton community structure, mono-culture experiments were performed firstly withvar.andin the PM4A plate at different phosphorus resources. Secondly, one species were added to natural seawater samples, separately, and performed mixed-culture experiments under 5’-AMP and K2HPO4conditions. It was found that both species can make use of amino acids and nucleotides efficiently, andvar.andcan, respectively, utilize 35 and 25 kinds of dissolved organic phosphates (DOP). These results suggest that dinoflagellate and cyanobacteria can take up DOP resources selectively. Whenvar.was used to regulate phytoplankton community composition, and chlorophyta: dinoflagellate: diatom: cyanobacteria were set to 38%:26%:20%:7%, dinoflagellate possessed competitive advantages regardless of the phosphorus resources and their percentages were 37.11%~50.19%. Oncewas added to natural seawater samples, and chlorophyta : dinoflagellate : diatom : cyanobacteria were set to 38% : 29% : 20% : 4%, cyanobacteria had competitive advantages and their percentages were 52.25%~53.44%. Our data indicate that at the same temperature and light intensity, both phosphorus species and the proportion of initial phytoplankton biomass play important roles on regulating succession of the phytoplankton community.
var.;;adenosine-5'-monophosphate;community structure
X17
A
1000-6923(2019)11-4796-08
肖宇梅(1995-),女,江西新余人,福建师范大学硕士研究生,主要从事水体富营养化与生态修复方面研究.发表论文1篇.
2019-04-26
国家自然科学基金资助项目(41573075);福建省科技厅高校产学合作项目(2017Y4003);福建省环保厅项目(2015R017);福州市科技局项目(2016-G-68);平潭综合实验区环境与国土资源局(DH1181);大学生创新创业项目(201810394016)
* 责任作者, 教授, ypsu@fjnu.edu.cn

