葫芦砧木萎蔫病病原镰刀菌鉴定及其防治药剂的筛选
张曼 钱芳 徐锦华

摘要 本研究对葫芦砧木萎蔫病病原菌进行了分离鉴定及室内杀菌剂筛选,为葫芦萎蔫病的防控提供参考依据。从嫁接西瓜主产区和葫芦砧木育种大棚采集具有典型萎蔫症状的病样,进行病原菌的分离和鉴定,共得到6株分离物。形态学观察发现分离物具有茄病镰刀菌Fusarium solani的特征。基于病原菌的rDNA-ITS和TEF-1α序列分析,6株分离物的序列与茄病镰刀菌的序列相似性为100%,与形态学鉴定结果一致。采用柯赫氏法则对分离菌株进行致病力验证,结果表明,6株分离物都能使葫芦砧木发病,且症状与田间发病症状一致,其中LS-2致病力最强。选用11种杀菌剂对葫芦茄病镰刀菌进行室内毒力测定,结果表明,供试药剂中,20%硅唑·咪鲜胺EW、70%甲基硫菌灵WP和25%多菌灵WP能很好地抑制茄病镰刀菌菌丝的生长,抑菌率达到80%以上。20%硅唑·咪鲜胺EW的毒力最强,EC50为0.08 μg/mL。
关键词 葫芦砧木; 嫁接西瓜; 萎蔫病; 茄病镰刀菌; 药剂防治
中图分类号: S 436.42 文献标识码: A DOI: 10.16688/j.zwbh.2018395
Abstract In order to provide basis for prevention and control of the wilt disease in bottle gourd rootstocks, the causal agent of wilt disease in bottle gourd rootstocks was identified and fungicides widely used in commercial were screened. Diseased plants with typical wilt symptoms in the main production area of grafted watermelon and in the bottle gourd rootstock breeding greenhouse were sampled and used for pathogen identification and characterization. A total of six isolates were obtained. Morphological analysis reviewed that all isolates possessed the characteristics of Fusarium solani. Based on sequence alignment of rDNA-ITS and TEF-1α, sequences of bottle gourd isolates of Fusarium showed 100% identity with those of F.solani, which is consistent with the morphological characteristics. According to Kochs postulates, all of the six isolates could induce the wilt symptom which was consistent with that in the field. LS-2 was the most virulent isolate. Eleven fungicides were used to evaluate their toxicity to F.solani in bottle gourd. Results showed that among the tested fungicides, 20% flusilazole·prochloraz EW, thiophanate-methyl 70% WP and carbendazim 25% WP could effectively control the mycelial growth, with the inhibition rate up to 80%. flusilazole·prochloraz 20% EW had the strongest toxicity with the EC50 value of 0.08 μg/mL.
Key words bottle gourd rootstock; grafted watermelon; wilt disease; Fusarium solani; fungicide control
嫁接技术是生产上有效防治由尖孢镰刀菌西瓜专化型侵染引起的西瓜枯萎病的重要手段。大量研究表明,利用砧木高抗或免疫的特点,嫁接不仅提高了植株对土传病害的抗性,还能增强其对其他病虫害[1]和非生物胁迫,如盐胁迫、湿土、高/低温等[2]的抵抗能力,因此,在西瓜生产上得以广泛应用。据统计,日本温室栽培西瓜的98%、露地西瓜的92%,韩国温室栽培西瓜的98%、露地西瓜的90%均采用了嫁接栽培[3-4]。我国西瓜主产区嫁接栽培面积也占到了总面积的70%以上[4]。
然而,随着嫁接西瓜設施栽培面积的不断增加,近年来在我国一些地区,葫芦砧木嫁接西瓜田间发现嫁接植株发生了与枯萎病症状很相似的病害,根系在土壤中染病,叶片逐渐枯萎直至全株死亡(图1),如2005年浙江省温岭市首次出现嫁接西瓜连片枯萎,7.3 hm2 嫁接西瓜全部死亡的现象[5]。随后,在河北、湖北等地嫁接西瓜田也发生了此类病害,致使西瓜产量和品质下降,造成经济损失。目前国内外关于嫁接西瓜萎蔫死亡病因的研究相对较少,根据菌落特征、孢子形态和分子鉴定,现有研究认为尖孢镰刀菌Fusarium oxysporum[5]和茄病镰刀菌F.solani[5-7]是引起嫁接西瓜萎蔫病的优势菌株。本研究以此为参考,在病原菌分离的基础上,根据菌丝形态、病原菌致病力,结合ITS序列的测序和同源性分析,明确葫芦砧木萎蔫病致病病原菌,筛选能有效抑制病原菌生长的药剂,为该病害的有效防治提供依据。
1 材料与方法
1.1 试验材料
从江苏省农业科学院蔬菜研究所葫芦砧木大棚中采集葫芦砧木萎蔫植株。采用马铃薯琼脂培养基(PDA)分离病原菌; 采用绿豆汤培养基(绿豆20 g,水1 000 mL,煮沸20 min,4层纱布过滤,取滤液分装于250 mL三角瓶中,121℃灭菌20 min)制备孢子悬浮液。
1.2 镰刀菌的分离与纯化
用刀片切取下胚轴发病部位与健康组织结合处约0.2 cm的组织,70%乙醇表面消毒30 s,再用10%次氯酸钠溶液消毒5 min,灭菌水清洗3次后置于无菌滤纸上吸干水分。将病样组织接种于含1%链霉素的PDA平板上,25℃培养至长出菌丝。待产生分生孢子后,将分生孢子挑入无菌水中,配制成不同稀释倍数的孢子悬浮液,将孢子悬浮液均匀涂布于PDA平板上,25℃培养3 d,观察由单个分生孢子萌发形成的微小菌落,将其挑出转接到另一PDA平板上,获得单孢纯化菌株[8]。
1.3 形态学鉴定
将病原菌接种于PDA培养基上,25℃培养7 d,用无菌水清洗平板,收集孢子,用Olympus BX41显微镜观察菌丝和分生孢子的形态,用Image-Pro plus软件测量菌丝及分生孢子的大小。
1.4 分子生物学鉴定
采用Fungi DNA提取试剂盒(Sigma)提取菌丝DNA,用真菌通用rDNA-ITS引物ITS1/ITS4[10]和TEF-1α特异性引物分别进行PCR扩增。扩增体系为25 μL,扩增程序为: 98℃预变性5 s; 98℃变性5 s,56℃退火20 s,72℃延伸1 min,30个循环; 72℃延伸2 min,4℃保存。取5 μL扩增产物于1%琼脂糖凝胶上检测,并割胶回收目的条带,纯化后连接pClone007载体(TsingKe, Beijing)进行蓝白斑筛选,阳性克隆送南京擎科公司测序。测序结果与NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)中的基因序列进行同源性比对。
1.5 镰刀菌致病力测定
将病原菌菌丝接种于PDA培养基上,25℃培养7 d。用孔径为6 mm的打孔器取2块菌饼,接种于绿豆汤培养基中,25℃,200 r/min振荡培养5 d。将培养物用4层纱布过滤,去除菌丝等杂质,滤液用灭菌水稀释至浓度为106个/mL的孢子悬浮液。采用浸根接种法[9]接种葫芦砧木,共接种30株,设3次重复。以接种无菌水的植株为对照。接种20 d时统计植株发病率,并从病株中再次分离病原菌,与原接种菌株进行比较。
1.6 杀菌剂对病原菌抑菌活性的测定
供试药剂为:40%苯醚甲环唑悬浮剂(济南泰禾化工有限公司)、20%硅唑·咪鲜胺水乳剂(成都科利隆生化有限公司)、75%百菌清可湿性粉剂(陕西标正作物科学有限公司)、80%代森锰锌可湿性粉剂(山东乡村生物科技有限公司)、25%嘧菌酯悬浮剂(陕西美邦农药有限公司)、40%烯酰·异菌脲悬浮剂(深圳诺普信农化股份有限公司)、15%噁霉灵水剂(深圳诺普信农化股份有限公司)、60%苯甲·醚菌酯可湿性粉剂(山东中新科农生物科技有限公司)、45%五氯·福美双可湿性粉剂(青州市日中经贸有限公司)、70%甲基硫菌灵可湿性粉剂(江苏龙灯化学有限公司)、25%多菌灵可湿性粉剂(陕西美邦农药有限公司)。
11种杀菌剂按照田间推荐使用浓度分别添加到PDA培养基中,制成含有杀菌剂的PDA平板。用孔径为5 mm的打孔器取菌丝块接种到PDA药板上,菌丝面朝下放置,25℃培养,重复4次。以无菌水为对照。培养第5 d测量菌落直径,计算各杀菌剂菌丝生长抑制率。
抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
2 结果与分析
2.1 病害症状
葫芦砧木萎蔫病在育苗期及定植后各生育期均可发生,症状表现为,发病初期植株地上部萎蔫(图1a),早晚可恢复,类似西瓜枯萎病发病症状,随着病程加重,葫芦砧木下胚轴变褐,开裂,致使植株因为水分、养分供应不足而死亡。
2.2 茄病镰刀菌的分离纯化及形态学特征
从葫芦砧木发病组织中分离到6株疑似致病真菌,编号依次为LS-1~ LS-6。将6株真菌分别进行单孢纯化,PDA培养基上培养7 d,观察菌丝形态。6株菌株菌落形态一致(图1b,c),气生菌丝为白色薄绒毛状,逐渐变为灰色至浅土黄色。显微观察显示,大型分生孢子为镰刀型,有隔膜,大小为(17.6~57)μm×(3.1~6.0)μm,小型孢子呈卵形,有纵横隔膜,大小为(8.9~14.0)μm×(3.0~4.4)μm(图1d)。参考《中国真菌志》分类方法,初步判定该病原菌为茄病镰刀菌。此外,6株菌株的菌落特征,分生孢子形状和大小差异不显著。
2.3 病原菌rDNA-ITS序列分析
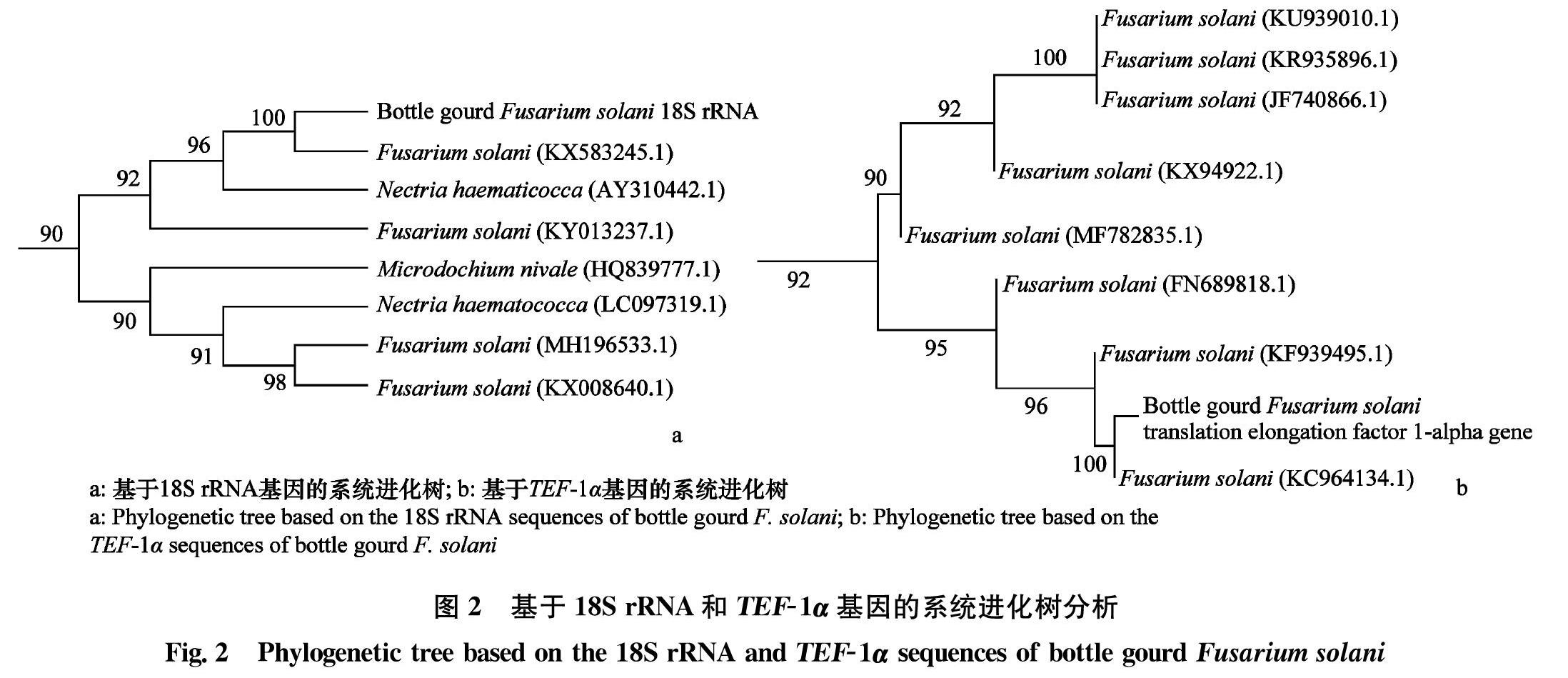
以6株菌株的DNA为模板,采用真菌通用引物ITS1/ITS4和TEF-1α基因特异引物分别进行PCR扩增,6株分离物均得到一条分子量约为568 bp(18S rRNA基因)和528 bp(TEF-1α基因)的特异性扩增条带。测序分析发现,6株菌株扩增条带大小一致。系统进化树分析结果显示,该序列与GenBank数据库中其他物種的茄病镰刀菌菌株的序列相似性均为100%(图2a,b)。结合菌丝形态特征和分子生物学检测结果,确定该菌株为茄病镰刀菌。
2.4 致病力测定
分别制备6株菌株的孢子悬浮液,采用浸根侵染法接种葫芦砧木品种‘超丰抗生王。接种后15 d,植株开始发病,叶片萎蔫,下胚轴有一条褐色病斑。接种20 d时,下胚轴开裂,植株死亡(图3b)。症状与田间发病症状相同。而清水接种的对照植株则未发病(图3a)。从发病植株上重新分离病原菌,形态学鉴定表明与田间分离菌株一致,依据柯赫氏法则(Kochs postulate),该病原菌即为从田间病样中分离纯化的致病菌。6株菌株致病力略有差异,其中LS-2致病力最强,病情指数为0.56,其余菌株致病力较弱,病情指数在0.12~0.36之间。因此,选用LS-2菌株做进一步的杀菌剂毒力测定。
2.5 不同杀菌剂对茄病镰刀菌的毒力测定
2.5.1 不同杀菌剂对茄病镰刀菌菌丝生长的抑制效果
利用11种生产上常用的杀菌剂进行菌丝生长抑制试验,结果显示,11种杀菌剂对茄病镰刀菌菌丝生长抑制效果差异显著。20%硅唑·咪鲜胺EW、70%甲基硫菌灵WP和25%多菌灵WP 3种杀菌剂的抑菌率在90%以上,是防治茄病镰刀菌的理想药剂。40%烯酰·异菌脲SC、80%代森锰锌WP和45%五氯·福美双WP也具有一定的抑菌作用,抑菌率分别为56.1%、65.9%和51.2%,也可以用于茄病镰刀菌的防治。而噁霉灵没有抑菌效果(表1)。
2.5.2 不同杀菌剂对茄病镰刀菌的毒力
20%硅唑·咪鲜胺EW、60%苯甲·醚菌酯WP、70%甲基硫菌灵WP和25%多菌灵WP对茄病镰刀菌的室内毒力测定结果表明,4种杀菌剂对茄病镰刀菌的EC50分别为0.08、7.27、0.38、1.47 μg/mL,咪鲜胺对茄病镰刀菌的毒力最强,而醚菌酯对茄病镰刀菌的毒力最弱。
3 讨论
有很多病原菌都可造成植物根部腐烂引起根腐病的发生,已报道过的主要有镰刀菌Fusarium sp.、立枯丝核菌Rhizoctonia solani、终极腐霉Pythium ultimum、疫霉Phytophthora和平脐蠕孢菌Bipolaris sorokiniana等[11-13]。其中镰刀菌的分布很广,普遍存在于土壤及动植物体内,在植物病原菌中属于最重要的一类。许多植物萎蔫、根部腐烂、接穗腐烂都是由镰刀菌造成的。目前已报道的致病镰刀菌主要有尖孢镰刀菌F.oxysporum[14-17]和茄病镰刀菌F.solani[13,18-22]。林燚等[5]从嫁接西瓜病株上同时分离到了茄病镰刀菌和尖孢镰刀菌,且两种病原菌均有致病性,但茄病镰刀菌致病力强于尖孢镰刀菌。Armengol等[6]和Jiang等[7]从南瓜砧木嫁接西瓜病株上分离到的致病菌为茄病镰刀菌瓜类专化型生理小种1号。本研究从葫芦砧木萎蔫病株中分离到6株病原真菌,通过孢子形态观察、分子生物学鉴定和致病力测定,确定葫芦砧木萎蔫病致病菌为茄病镰刀菌,与前人研究结果一致。
对茄病镰刀菌瓜类专化型侵染寄主和传播介质的研究发现,在田间茄病镰刀菌瓜类专化型通常只侵染不同品种的南瓜,并未在西瓜及甜瓜上造成危害,而在实验室接种情况下,则可对许多瓜类作物表现出致病性[23-25]。茄病镰刀菌瓜类专化型菌能在土壤中产生大量的厚垣孢子,其存活时间可达3年,但该菌被广泛认为是通过种子带菌来传播的,可存活于种子的内部和外部1~2 年,而带菌的种子并不影响种子活力和种子发芽情况。因此,作为目前生产上广泛使用的西瓜嫁接砧木,需加强该病害的防治工作。
研究发现,茄病镰刀菌寄主广泛,除本研究中的葫芦砧木外,还是黄瓜[26]、茄子[27]、豇豆[28]、大白菜[29]等作物的主要致病菌,為害严重。近年来,发现嫁接西瓜萎蔫病发病率较高,严重影响了西瓜生产,因此,探寻有效的防治措施尤为必要。为了筛选抑制茄病镰刀菌生长的药剂,为大田防治葫芦砧木茄病镰刀菌危害提供参考,测定了11种常见杀菌剂对茄病镰刀菌菌丝生长抑制效果和4种杀菌剂的室内毒力,发现硅唑·咪鲜胺、甲基硫菌灵和多菌灵对该病菌菌丝生长的抑制效果最好,抑制率在90%以上,而咪鲜胺对茄病镰刀菌的EC50为0.08 μg/mL。因此,可作为防治该病害的主要药剂。对茄病镰刀菌的生物学特性研究发现,该病菌最适生长温度为25~30℃,最适pH为7~10[30],因此,生产中除药剂防治外,可以结合土壤改良进行该病害的综合防治,提高西瓜产量。
参考文献
[1] KING S R,DAVIS A R,LIU W G,et al.Grafting for disease resistance [J].HortScience,2008,43(6):1673-1676.
[2] YANG Xingping,HU Xuedan,ZHANG Man,et al.Effect of low night temperature on graft union formation in watermelon grafted onto bottle gourd rootstock[J].Scientia Horticulturae,2016,212:29-34.
[3] LEE J M,ODA M.Grafting of herbaceous vegetable and ornamental crops [J].Horticultural Reviews,2010,28:61-124.
[4] 别之龙.我国西瓜甜瓜嫁接育苗产业发展现状和对策[J].中国瓜菜,2011,24(2):68-71.
[5] 林燚,李茜,李红叶.嫁接西瓜枯萎病原研究初报[J].浙江农业科学,2007(1):84-86.
[6] ARMENGOL J,JOS C M,MOYA M J,et al.Fusarium solani f.sp.cucurbitae race 1,a potential pathogen of grafted watermelon production in Spain [J].EPPO Bulletin,2010,30(2):179-183.
[7] JIANG W,HUANG Y,KONG Q S,et al.Identification of pathogens causing grafted watermelon root rot and screen of resistant rootstocks [C].∥1st ISHS International Symposium on Vegetable Grafting,2014:65.
[8] 朱桂宁,蔡健和,胡春锦,等.广西山药炭疽病病原菌的鉴定与ITS序列分析[J].植物病理学报,2007,37(6):572-577.
[9] ZHANG Man,XU Jinhua,LIU Guang,et al.Proteomic analysis of responsive root proteins of Fusarium oxysporum-infected watermelon seedlings [J].Plant and Soil,2018,422:169-181.
[10] WHITE T J,BRUNS T,LEE S,et al.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetic[M]∥INNIS M A,GELFAND D H,SNINSKY J J,et al.PCR Protocols:A guide to methods and applications.Academic Press,New York,USA,ISBN 978-0123721808,1990:315-322.
[11] 张萍.葫芦巴根腐病病原菌的鉴定[J].西北农业学报,2008,17(6):202-204.
[12] 袁胜亮,刘峰,张娜.6 种杀菌剂对小麦叶斑根腐病菌的毒力测定[J].中国农学通报,2011,27(15):273-276.
[13] 刘淑娟,陈秀蓉,袁宏波.孜然根腐病病原分离及鉴定[J].浙江农业学报,2012,24(3):481-485.
[14] LEARY J V,ENDO R M A.Fusarium-induced root rot of staked tomatoes [J].Phytopathology,1971,61(8):900.
[15] SATO R,ARAKI T.On the tomato root-rot disease occurring under vinyl-house conditions in southern Hokkaido [J].Annual Report of the Society of Plant Protection North Japan,1974,25:5-13.
[16] YAMAMOTO I,KOMADA H,KYNIYASU K,et al.A new race of Fusarium oxysporum f.sp.lycopersici inducing root rot of tomato [J].Annual Report of the Kansai Plant Protection Society,1974,16:17-29.
[17] 任春光,桑维钧,刘曼.撑绿杂交竹根腐病的病原鉴定[J].中国森林病虫,2011,30(6):5-7.
[18] BELISARIO A,FORTI E,CORAZZA L.Collar and root rot of walnut trees,associated with Fusarium solani [J].Petria,1999,9(3):277-282.
[19] PADAGANUR G M,KACHAPUR M R,NAIK K S,et al.Hibiscus sabdariffa L.,a new host to Fusarium solani (Mart.) Sacc.[J].Plant Pathology Newsletter,1988,6(l/2):13.
[20] RATHNAMMA K,KHAN A N A,FAROOQUI A A,et al.Root-rot of garden rue (Ruta graveolens L.) caused by Fusarium solani (Mart.) Sacc.emend Synder and Hansen-a new record [J].Advances in Plant Science Research in India,1999,9:41-48.
[21] KIRK P M,CANNON P F,DAVID J C,et al.Dictionary of Fungi [M].CAB International,2001.
[22] 朱蕾.蒙古黃芪根腐病病原菌的分离鉴定及药剂筛选防治研究[D].兰州:甘肃农业大学,2010:1-46.
[23] TOUSSOUN T A,SNYDER W C.Germination of chlamydospores of Fusarium solani f.phaseoli in unsterilized soils [J].Phytopathology,1961,51(9):620-623.
[24] KERLING L C P,BRAVENBOER L.Foot rot of Cucurbita ficifolla,the rootstock of cucumber,caused by Nectria haematococca var.cucurbitae [J].Netherlands Journal of Plant Pathology,1967,73:15-24.
[25] PATERNOTE S J.Pathogenicity of Fusarium solani f.sp.cucurbitae race 1 to courgette [J].Netherlands Journal of Plant Pathology,1987,93(6):245-252.
[26] LI B J,LIU Y,SHI Y X,et al.First report of crown rot of grafted cucumber caused by Fusarium solani in China [J].Plant Disease,2010,94(11):1377.
[27] 王勇,杨秀荣,杨依军,等.茄根腐病致病病原-茄病镰刀菌及其蓝色变种的生物学特性研究[J].天津农学院学报,2002,9(2):21-25.
[28] 吴仁锋, 杨绍丽, 万鹏, 等. 豇豆根腐病病原分离鉴定及其核糖体rDNA-ITS序列分析[J]. 湖北农业科学, 2011, 50(24):5107-5110.
[29] 闫文雪,石延霞,李盼亮,等.大白菜枯萎病病原镰刀菌种类的初步研究[J].植物病理学报,2018,48(5):587-593.
[30] 杨静美,陈健,罗金堂,等.番木瓜茄病镰刀菌的生物学特性研究[J].中国热带农业,2011,38(1):56-58.
(责任编辑: 杨明丽)

