血清淀粉样蛋白A联合细胞角蛋白片段-1检测对非小细胞肺癌的诊断价值
张晶 赖飞 蔡建兴 叶辉铭 梁小亮
(1厦门大学附属妇女儿童医院 厦门市妇幼保健院检验科,福建 厦门 361003;厦门医学院附属第二医院 2输血科;3检验科)
肺癌目前已成为严重威胁人类健康和生命的常见恶性肿瘤,在我国也早在2008年取代肝癌成为发病率最高的恶性肿瘤〔1~3〕。其中非小细胞肺癌(NSCLC)占肺癌患者的70%~80%〔4~6〕,由于NSCLC被诊断时常为晚期,因此患者无法进行有效治疗,5年生存率常常<15%,肺癌的血清肿瘤标志物检测因其操作简便、价格低廉、无毒副反应等优势,已经成为肺癌早期诊断、疗效评价和预后判断的重要辅助参考指标〔7〕。血清肿瘤标志物是由肿瘤细胞分泌入血并且可以反映肿瘤存在的特异性或相关性抗原。肿瘤标志物可由肿瘤细胞或非肿瘤细胞产生,但在数量和性质上有明显差别;一种肿瘤可以有多种肿瘤标志物并存,各个肿瘤间交叉和界限不清。因此单项肿瘤标志物在肿瘤人群中的表达率并不高,仅用单项指标进行肿瘤的筛查或监测,易于造成肿瘤的漏检或假阳性结果。为使肿瘤的检出率提高,可采用多项指标联合检测,起到互补作用。研究表明,联合检测优于单项检测,不同肿瘤标志物联合检测可明显提高肿瘤检出率,但在最佳组合问题上,仍需做大量的探讨和研究,才能获取基本认同〔8~10〕。本文通过对血清癌胚抗原(CEA)、细胞角蛋白片段(CYFRA)21-1、神经元特异性烯醇化酶(NSE)、血清淀粉样蛋白(SA)A四个指标的检测,探讨其单独检测及两两联合检测对NSCLC的诊断和鉴别诊断的意义,从而得到准确、方便、快捷的检测组合。
1 材料与方法
1.1基本资料 收集厦门医学院附属第二医院2018年1~12月NSCLC、良性肺病变、健康体检受试者各40例,年龄>60岁,其中NSCLC组男25例,女15例,诊断标准参照我国2015版肺癌诊疗指南,所有入选患者经过病理学或组织学确诊,并将其进行分期,其中Ⅰ~Ⅱ期28例,Ⅲ~Ⅳ期12例;良性肺病变组男22例,女18例,包括肺炎20例,肺结核12例,肺部纤维瘤8例;健康对照组男20例,女20例,无肺部疾病,体格检查无异常,既往无脑、心、肝、肾等疾病。
1.2主要仪器与试剂 和迈FIC-S100型荧光免疫分析仪;罗氏E601电化学发光仪:CYFRA21-1 试剂盒、NSE、CEA试剂盒均为罗氏仪器配套原装试剂盒;SAA试剂盒为厦门波生生物技术有限公司。
1.3方法
1.3.1标本采集 所有实验对象空腹静脉采血5 ml,离心后分离血清,-80℃冷冻保存。
1.3.2标本检测 正常范围CYFRA21-1、NSE、CEA等指标采用电化学发光法进行检测;SAA则采用量子点免疫荧光法检测。CYFRA21-1<3.3 ng/ml;NSE<16.3 μg/L;CEA<5 μg/L;SAA<10 ng/ml,检测结果超过正常值即判定为阳性,联合检测中其中任何一项超过正常值即判定为阳性。
1.4统计学方法 采用SPSS22.0统计软件进行方差分析、t及χ2检验。
2 结 果
2.1各组CEA、CYFRA21-1、NSE及SAA水平比较 健康对照组与良性肺疾病组血清CEA、CYFRA21-1、NSE、SAA水平比较差异有统计学意义(P<0.05);健康对照组与NSCLC组血清CEA、CYFRA21-1、NSE、SAA水平比较差异有统计学意义(P<0.05);良性肺疾病组与NSCLC组血清CEA、CYFRA21-1、NSE水平比较差异有统计学意义(P<0.05),血清SAA水平差异无统计学意义(P>0.05),见表1。
2.2不同临床分期NSCLC患者CEA、CYFRAZ1-1、NSE及SAA水平比较 中晚期(Ⅲ~Ⅳ期)与早期NSCLC(Ⅰ~Ⅱ期)患者血清CYFRA21-1、SAA水平比较差异有统计学意义(P<0.05),血清CEA、NSE水平比较差异无统计学意义(P>0.05),见表2。
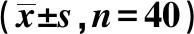
表1 各组CEA、CYFRA21-1、NSE及SAA水平比较
与健康对照组比较:1)P<0.05;与良性肺疾病组比较:2)P<0.05
表2 不同临床分期NSCLC患者CEA、CYFRA21-1、NSE及SAA水平比较
与早期比较:1)P<0.05
2.3各组CEA、CYFRA21-1、NSE及SAA阳性率比较健康对照组及良性肺疾病组CEA、CYFRA21-1、NSE的阳性率明显增高,差异有统计学意义(P<0.05);而SAA在NSCLC组和良性肺疾病组分别与健康对照组差异有统计学意义(P<0.05),但NSCLC组与良性肺疾病组差异无统计学意义(P>0.05),见表3。

表3 各组CEA、CYFRA21-1、NSE及SAA阳性率比较〔n(%),n=40〕
与NSCLC组比较:1)P<0.05;与良性肺疾病组比较:2)P<0.05
2.4血清CEA、CYFRA21-1、NSE、SAA单独检测诊断NSCLC的ROC曲线下面积(AUC)分别为0.774、0.822、0.634、0.805,两两联合检测诊断NSCLC的ROC AUC:CEA+CYFRA21-1为0.736;CEA+NSE为0.678;CEA+SAA为0.795;CYFRA21-1+NSE为0.712;CYFRA21-1+SAA为0.923;NSE+SAA为0.734(见图1)。CYFRA21-1与SAA联合检测对NSCLC的诊断敏感性、特异性、阳性预测值、阴性预测值分别为92.4%、88.5%、87.6%,82.3%均显著高于各项单独检测及其他两两联合检测(P<0.05)。

图1 各指标的ROC曲线
3 讨 论
细胞角蛋白(CK)是一种中间微丝蛋白,在上皮细胞中特异表达,通常在恶性肿瘤中稳定持续表达〔11,12〕,恶性肿瘤细胞死亡或溶解时会激活蛋白酶,加速CK降解,释放CYFRA21-1到血液中。CYFRA21-1是可溶性的CK19片段,是一种酸性蛋白质,广泛存在于多种组织,尤其恶性肿瘤组织呈高表达,研究显示〔13〕,在NSCLC患者血清中的CYFRA21-1水平明显升高,其对NSCLC的敏感性超过50%。SAA由被激活的巨噬细胞和成纤维细胞在肝脏中合成,是一类多基因编码的多形态蛋白家族〔14〕,是组织淀粉样蛋白A的前体物质,在正常人血液中有少量存在。当人体处于炎症、疾病活动期和大面积组织损伤时SAA则快速升高,早在20世纪70~80年代,就有学者用放射免疫法(RIA)和放射免疫扩散法(RID)检测SAA,发现该蛋白不仅仅和淀粉样变有关,与恶性肿瘤之间可能也存在着千丝万缕的关系。当时,一部分学者发现该指标在癌症人群中的血清水平高于健康人群,尤其在肺癌患者中水平最高〔15~17〕。本研究显示早期NSCLC患者检测血清CYFRA21-1、SAA水平对于疾病的早诊断、早治疗起着至关重要的作用,CYFRA21-1+SAA联合检测可提高早期NSCLC的诊断价值。

