荔枝核多酚提取工艺研究
周秋艳 唐方华 刘剑清 陈伟鸿 陈浩明
摘要 在单因素试验的基础上,采用正交试验对荔枝核多酚的提取工艺进行研究。结果表明,荔枝核多酚的最佳提取工艺条件如下:提取温度60 ℃,乙醇浓度70%,料液比1∶8(g∶mL),第1次提取时间60 min。在最佳提取工艺条件下,荔枝核多酚提取物的平均得率为18.51%,荔枝核多酚的平均含量为31.36%,
关键词 荔枝核多酚;提取工艺;正交试验;多酚含量
中图分类号 TS209文献标识码 A
文章编号 0517-6611(2019)20-0182-04
doi:10.3969/j.issn.0517-6611.2019.20.049
开放科学(资源服务)标识码(OSID):
Study on the Extraction Process of Polyphenols from Litchi Seed
ZHOU Qiu yan1,TANG Fang hua1,LIU Jian qing2 et al (1.Extraction and Fermentation Laboratory of Nuspower Greatsun(Guangdong) Biotechnology Co.,Ltd.,Guangzhou,Guangdong 510900;2.Guangzhou Nanyang Polytechnic College,Guangzhou,Guangdong 510925)
Abstract Based on the single factor experiment,the extraction process of polyphenols from litchi seed was studied by orthogonal experiment.The results showed that the optimal process conditions were as follows:extract temperature of 60 ℃,ethanol concentration of 70%,solid liquid ratio of 1∶8,the first extraction time of 60 min.Under the optimum extraction process parameters,the average yield of polyphenols extract from litchi seed was 18.51%,and the average content of polyphenols from litchi seed was 31.36%.
Key words Polyphenols from litchi seed;Extraction process;Orthogonal experiment;Polyphenol content
植物多酚(polyphenols) 为广泛存在于植物体内的次生代谢产物,是对植物的生长代谢起着重要作用的一类具有多个酚羟基化合物,主要分布于植物的根、皮、叶中。植物多酚在狭义上定义为单宁或者鞣质,在广义上指的是酚类小分子化合物,包括花青素、儿茶素、没食子酸等[1]。植物多酚类物质已被证实除了抗氧化作用外[2],由于其本身多样、复杂的结构,同时也具有许多其他生物活性,如抗肿瘤作用[3]、抗炎作用[4]、抑菌作用[5]、预防老年痴呆[6]、预防心血管疾病[7]及调节肠道菌群[8]等功效,目前人们已经从茶叶、葡萄、石榴、菜籽等原料中提取出多酚类物质,并将其广泛应用于医疗、食品等领域[9]。荔枝核是无患子科常绿乔木荔枝(Litchi chinensis Sonn.)的干燥成熟种子,约为荔枝果重的13%左右,是一种传统的中药,包含酚酸类、黄酮类、脂肪酸、挥发性成分以及鞣质类等[10]成分。多酚物质作为荔枝核的主要成分之一,已有文献报道具有多种生物活性,如抗氧化、降血糖、抗肿瘤、抗病毒等功效[11-14]。近年来,虽然荔枝加工得到一定发展,但在加工的同时产生的约占鲜果质量40%的荔枝果皮和荔枝果核被当作废弃物处理,因此减少荔枝采后损失、提高加工利用率和产品附加值已成为荔枝产业发展中迫切需要解决的问题。笔者对从荔枝核中的提取多酚类物质的工艺进行了研究,以多酚含量作为评价指标,通过单因素试验以及正交试验优化荔枝核多酚的提取工艺参数,旨在为荔枝的深加工提供思路,为提高荔枝的综合利用价值奠定基础。
1 材料与方法
1.1 原料和试剂
1.1.1 原料。“淮枝”“糯米糍”“黑叶”“桂味”品种荔枝核,取自广州市从化区明珠市场的荔枝整果。
1.1.2 试剂。没食子酸(中国食品药品检定研究院)、福林酚(中国食品药品检定研究院)、95%乙醇(分析纯,天津市大茂化学试剂厂)、甲醇(分析纯,天津市大茂化学试剂厂)、碳酸钠(分析纯,天津市大茂化学试剂厂)。
1.2 主要仪器与设备
DMF-10A多功能摇摆式粉碎机(浙江温岭市铭大药材机械设备有限公司)、DMF-4B手提式高速中药粉碎机(浙江温岭市铭大药材机械设备有限公司)、2WAJ阿贝折射仪(上海仪电物理光学仪器有限公司)、LT-1002电子天平(常熟市天量仪器有限责任公司)、ATX224分析天平(岛津制作所)、TD-5M离心机(山东博科科学仪器有限公司)、SP-752PC紫外分光光度计(上海光谱仪器有限公司)、5L旋转蒸发器(上海大颜仪器设备有限公司)、EXRE-2002旋转蒸发器(巩义市宇翔仪器有限公司)、DHG-9240A电热鼓风干燥箱(上海一恒科学仪器有限公司)、DZF-6053真空干燥箱(上海一恒科學仪器有限公司)。
1.3 荔枝核原料的筛选
将4种品种荔枝“淮枝”“糯米糍”“黑叶”“桂味”的皮、果肉、核进行分离,冷藏保存,备用;检测荔枝核多酚含量(按干重计),以多酚含量为指标,确定荔枝核原料。
1.4 荔枝核多酚的提取工艺流程
荔枝核多酚的提取工艺流程如下:新鲜荔枝核60 ℃烘8 h、粉碎成粗粉→水或乙醇提取→提取液过300目,除渣→滤液经旋转蒸发浓缩(60 ℃,-0.09~-0.03 MPa)→浓缩液干燥(60 ℃,-0.09~-0.06 MPa)。
1.5 没食子酸标准曲线的绘制
准确称取(0.110±0.010)g 没食子酸,用蒸馏水溶解,然后定容至100 mL,即为没食子酸标准储备溶液。准确量取1.0、2.0、3.0、4.0、5.0 mL标准储备溶液置于100 mL容量瓶中,定容至刻度,摇匀,浓度分别为10、20、30、40、50 μg/mL,即为没食子酸工作液。准确量取1.0 mL没食子酸工作液置于刻度试管中,分别加入5.0 mL 10%福林酚试剂,摇匀,反应3~8 min后,加入4.0mL 7.5% Na2CO3溶液,加水定容至刻度、摇匀,室温下放置60 min,于765 nm波长下,使用紫外可见分光光度计测定吸光度值(A),绘制标准曲线。空白用蒸馏水代替没食子酸标准溶液。
1.6 多酚含量的检测
称取0.2 g荔枝核提取物干粉置于10 mL离心管中,加入70 ℃预热过的70%甲醇溶液5 mL,搅拌均匀,立即移入70 ℃水浴10 min,冷却至室温,3 500 r/min转速离心10 min,将上清液转移至10 mL容量瓶。沉淀物中再加入5 mL70%甲醇溶液,重复以上操作。合并提取液定容至10 mL,摇匀,再准确量取1.0 mL置于100 mL容量瓶中,摇匀,待测。空白用水代替样品,其余操作参照“1.4”部分标准曲线的绘制方法。在波长765 nm下测定样品吸光度,记录并计算样品提取物中多酚的含量。
1.7 荔枝核多酚提取工艺优化
采用溶剂萃取法提取荔枝核多酚。通过单因素试验考察提取温度、乙醇浓度、料液比、提取时间等因素对荔枝核提取物多酚含量的影响进行研究。
在单因素试验结果的基础上,选取对荔枝核提取物多酚含量影响较大的各个单因素,每个因素3个水平设计正交试验,探究各提取条件对荔枝核多酚含量的影响,通过正交试验探讨最佳提取工艺条件。
2 结果与分析
2.1 没食子酸的标准曲线
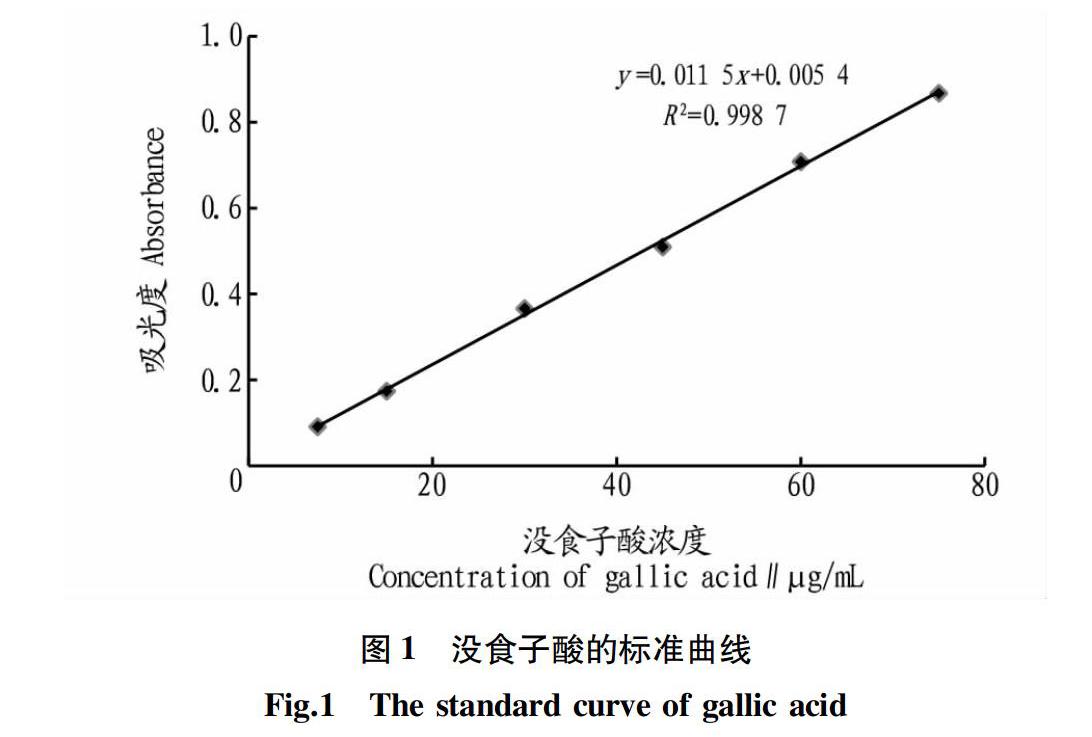
以没食子酸浓度(μg/mL)为横坐标,以吸光度(A)为纵坐标,绘制标准曲线。没食子酸的标准曲线方程为y=0.011 5 x+0.005 4(R2=0.998 7),标准曲线见图1。
2.2 荔枝核原料筛选
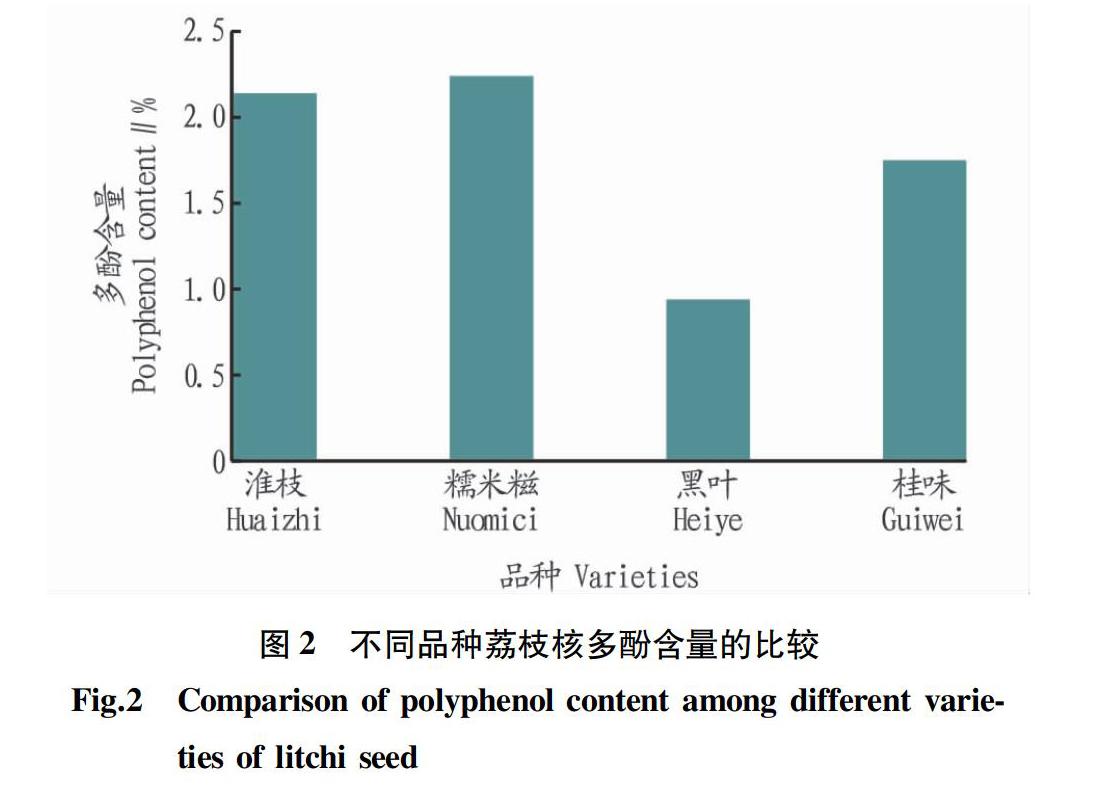
检测4种品种“淮枝”“糯米糍”“黑叶”“桂味”荔枝核的多酚含量(折干计),结果见图2。由图2可知,“淮枝”“糯米糍”荔枝核的多酚含量明显高于其他2个品种,虽然“糯米糍”荔枝核的多酚含量稍高于“淮枝”荔枝核,但市售“淮枝”荔枝的价格明显低于“糯米糍”荔枝,考虑到成本问题,“淮枝”荔枝核为该试验最佳原料。
2.3 单因素试验
2.3.1 不同提取温度对荔枝核多酚含量的影响。
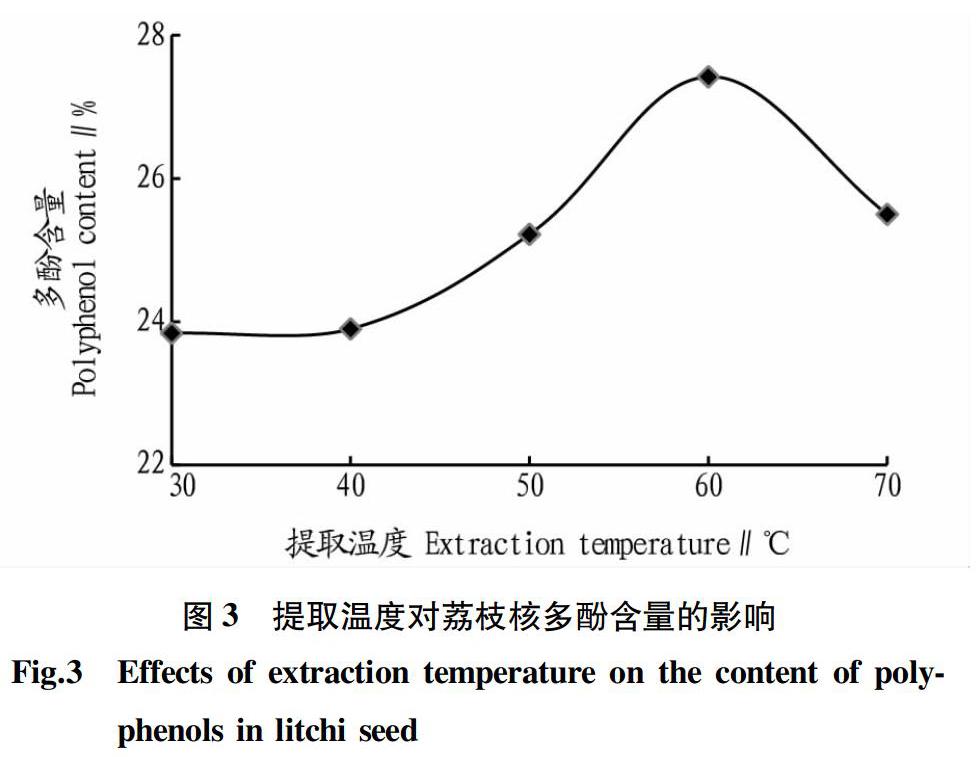
准确称取100 g干燥的荔枝核粉碎粗粉5份,置于恒温水浴锅中,提取温度分别为30、40、50、60、70 ℃,料液比1∶6(g∶mL),50%乙醇提取2次,第1次提取时间60 min,第2次提取时间60 min,研究不同提取温度对多酚含量的影响。由图3可知,随着提取温度的增加,多酚含量先增加后降低。这是由于随着温度的升高,分子运动速率也会加快,有利于提取溶剂进入荔枝核组织的内部,加快多酚物质的溶出,但温度过高,可能会使多酚分解,因此60 ℃为最佳提取温度。
2.3.2 不同乙醇浓度对荔枝核多酚含量的影响。
准确称取100 g干燥的荔枝核粉碎粗粉5份,置于恒温水浴锅中,乙醇浓度分别为0、20%、40%、60%、80%,料液比1∶6,提取温度50 ℃,提取2次,第1次提取时间60 min,第2次提取时间60 min,研究提取乙醇浓度对多酚含量的影响。由图4可知,随着乙醇浓度的增加,多酚含量呈现先增后减的趋势。这是因为植物体内的水溶性多酚分布在细胞液泡中,而非水溶性多酚类物质存在于细胞壁上,且多与蛋白质、多糖类等物质以氢键结合。低体积分数的乙醇溶液可以进入细胞内部,而高体积分数的乙醇会引起蛋白质变性,阻止多酚类物质的传质过程,从而降低多酚含量,故60%乙醇为最佳提取溶剂。
2.3.3 不同料液比对荔枝核多酚含量的影响。
准确称取100 g干燥的荔枝核粉碎粗粉5份,置于恒温水浴锅中,料液比分别为1∶6、1∶7、1∶8、1∶9、1∶10,提取温度50 ℃,50%乙醇提取2次,第1次提取时间60 min,第2次提取时间60 min,研究不同料液比对荔枝核多酚含量的影响。由图5可知,多酚含量随着料液比的增加呈现先急剧增加后逐渐增加的趋势。增加液料比,可以加快整个溶媒的传质过程,提高提取率,但若液料比过大则不仅会浪费能源,而且延长浓缩时间,因此最佳料液比为1∶7。
2.3.4 不同提取时间对荔枝核多酚含量的影响。
准确称取100 g干燥的荔枝核粉碎粗粉5份,置于恒温水浴锅中,料液比1∶6,提取温度50 ℃,用50%乙醇提取2次,第1次提取时间分别为20、40、60、80、100 min,第2次提取时间60 min,研究第1次提取时间对荔枝核多酚含量的影响。由图6可知,随着提取时间的增加,多酚含量呈先增加后降低的趋势,第1次提取时间为60 min时,多酚含量最高。这可能是因为在没有抗氧化剂的溶液系统内,长时间提取会诱导产生一系列的化学反应,从而引起多酚类物质的氧化分解,綜合考虑第1次提取时间以60 min最佳。
2.4 正交试验
在单因素试验结果的基础上,选取提取温度、提取乙醇浓度、料液比和提取时间作为考察因素,每个因素3个水平,以多酚含量为指标,进行L9(34)正交试验,正交试验因素与水平设计见表 结果见表2。由表2可知,各因素对荔枝核多酚含量的影响从大到小依次为B、A、C、D,其中乙醇浓度的影响最大,而提取时间的影响最小。根据正交试验结果,结合能源方面综合分析,确定提取工艺的最佳组合为A3B3C3D2,即提取温度60 ℃,乙醇浓度70%,料液比1∶8,第1次提取时间为60 min。
2.5 验证试验
称取3份经处理后的荔枝核粗粉100 g,按照正交试验结果确定优选工艺条件,测得荔枝核多酚提取物得率分别为18.54%、18.68%和18.30%,平均值为18.51%,相对标准偏差(RSD)为1.03%;多酚含量分别为31.74%、31.37%和30.96%,平均值为31.36%,相对标准偏差(RSD)为1.24%,此结果表明该提取工艺稳定、可行。
3 结论与讨论
3.1 结论
该试验通过对荔枝核多酚提取工艺进行研究,结果表明用溶剂浸提法提取荔枝核多酚,提取温度、乙醇浓度、料液比和提取时间都是影响荔枝核多酚含量的重要因素。荔枝核多酚的最优提取工艺为提取温度60 ℃,乙醇浓度70%,料液比1∶8(g∶mL),第1次提取时间60 min,各因素对荔枝核提取物多酚含量的影响从大到小依次为乙醇浓度、提取温度、料液比、提取时间。
3.2 讨论
荔枝核作为传统中药,其中多酚物质为主要化学成分之一,具有抗氧化、降血糖、抗肿瘤、抗病毒等功效,可应用于食品、药品、营养保健等领域,因此荔枝核多酚的提取分离已逐渐成为研究热点。目前已有一些学者对荔枝核多酚的提取工艺进行了研究,如罗威等[15]采用超声波辅助提取荔枝核多酚,得到最优提取工艺参数:超声波功率148 W,超声波处理时间1.9 min,液料比10.6∶ 乙醇体积分数54.95%,提取时间60 min,在此提取参数下多酚含量为26.33 mg/kg。熊何健等[10]用5倍稀释、体积分数70%的丙酮溶液在45 ℃下对荔枝核浸提2次,每次3 h,在此条件下浸提,浸提液经浓缩、冻干得到荔枝核粗提物,产物得率为19.81%,多酚含量为16.71%。该研究通过单因素试验、正交试验探究荔枝核多酚的提取工艺,结果显示虽然获取的荔枝核提取物得率稍低于熊何健等[10]的研究结果,但多酚含量明显较高,说明此提取工艺是可行的、理想的。
关于荔枝核多酚的稳定性试验、荔枝核多酚的进一步分离纯化以及相应产品的开发等,还有待深入研究和探讨。
参考文献
[1] 唐春红.天然防腐剂与抗氧化剂[M].北京:中国轻工业出版社,2010.
[2] ZHANG X M,LIU Y G,ZHU Z Y,et al.Total polyphenols,flavonoids and antioxidant activities in mulberry (Morus alba) leaves and fruit at different maturities[J].Journal of fruit science,2014,31(4):660-666.
[3] MOORE J,YOUSEF M,TSIANI E.Anticancer effects of posemary (Rosmarinus officinalis L.) extract and rosemary extract polyphenols[J].Nutrients,2016,8(11):1-32.
[4] MARTIN D A,BOLLING B W.A review of the efficacy of dietary polyphenols in experimental models of inflammatory bowel diseases[J].Food & function,2015,6(6):1773-1786.
[5] SLOBODN KOV L,FIALOV S,RENDEKOV K,et al.Antibiofilmactivity of plant polyphenols[J].Molecules,2016,21(12):1-15.
[6] RIGACCI S.Olive oil phenols as promising multi-targetingagents against Alzheimer's disease[M]//Vassallo N.Natural compounds as therapeutic agents for amyloidogenic diseases.Switzerland:Springer International Publishing,2015:1.
[7] TANGNEY C C,RASMUSSEN H E.Polyphenols,inflammation,and cardiovascular disease[J].Current atherosclerosis reports,2013,15(5):1-10.
[8] CARDONA F,ANDR S LACUEVA C,TULIPANI S,et al.Benefits of polyphenols on gut microbiota and implications in human health[J].Journal of nutritional biochemistry,2013,24(8):1415-1422.
[9] 董科,冷云,何方婷,等.植物多酚及其提取方法的研究進展[J].食品工业科技,2019,40(2):326-330.
[10] 熊何健,庞杰,林琳.荔枝核中活性成分的提取及抗氧化活力研究[J].西南大学学报(自然科学版),2010,32(3):134-139.
[11] DUAN X W,WU G F,JIANG Y M.Evaluation of the antioxidant properties of litchi fruit phenolics in relation to pericarp browning prevention[J].Molecules,2007,12:759-771.
[12] 黄晓兵,李积华,彭芍丹,等.五个产地荔枝核中药饮片抗氧化活性研究[J].食品工业科学,2014,35(22):91-94.
[13] LI J R,JIANG Y M.Litchi flavonoids:Isolation,identification and biological activity [J].Molecules,2007,12(4):745-758.
[14] 马艳芳,刘敏,钟巧莉,等.荔枝的活性功能及主要功能物质研究进展[J].现代生物医学进展,2016,16(3):586-588.
[15] 罗威,钟萍,胡杰.超声波辅助提取荔枝核多酚工艺的响应面优化[J].轻工科学,2014(2):11-14.

