苏拉明通过抑制纤维增生和炎症反应减轻小鼠的瘢痕增生*
林 康, 苏海燕, 虞 庆, 蒋良福, 高伟阳△
(温州医科大学附属第二医院 1手外整形科, 2儿童内分泌科, 浙江 温州 325000)
增生性瘢痕(hyperplasia scar,HPS)是一种复杂的皮肤纤维增生性疾病,以伴有伤口过度的愈合反应为特征[1]。HPS患者的生活质量严重受损,常常因为疤痕而引起身体、心理和社会上的不适[2]。已有的研究结果表明,成纤维细胞的异常增殖和活化与瘢痕形成密切相关[3]。在HPS中,活化的成纤维细胞因长时间保持活化而导致瘢痕收缩,通常会造成患者肢体的残疾和功能障碍。因此,在瘢痕形成中起重要作用的成纤维细胞的过度激活和功能亢进是HPS形成的根源[4]。近年来研究人员一直致力于寻找能降低成纤维细胞功能并减少瘢痕形成的药物来为临床带来新的治疗策略。
苏拉明(suramin)是多磺化萘基脲类的衍生物,具有减轻特应性皮炎小鼠皮肤组织损伤的作用[5]。近年来有研究表明,苏拉明在减少腹膜纤维化、慢性肾纤维化及增生性眼病的纤维化方面具有良好的效果[6-7]。此外,苏拉明能通过抑制单核巨噬细胞THP1中环二核苷酸(cyclic guanosine monophosphate-adenosine monophosphate,cyclic AMP-GMP,cGAMP)和cGAMP合成酶(cGAMP synthase,cGAS)的表达来调节干扰素β(interferon-β,IFN-β)水平,从而起到抗炎的作用。同时,有研究表明,苏拉明具有抑制细胞增殖作用[8],由此,可以推测,苏拉明可以通过抑制成纤维细胞的增殖和炎症反应的发生来预防增生性瘢痕的形成,但目前关于这方面的研究尚且缺乏。本研究拟通过建立增生性瘢痕小鼠模型并给予苏拉明以探究苏拉明对瘢痕形成的作用及机制。
材 料 和 方 法
1 实验材料
1.1实验动物 8周龄的成年雌性BALB/c小鼠24只,体重为(25.5±3.4) g,小鼠均来自温州医科大学实验动物中心[SCXK(浙)2015-0001],饲养温州医科大学实验动物中心SPF级动物房[SYXK(浙)2018-0017],饲养环境保持在室温(20±6) ℃,相对湿度(60±10)%。给予动物房14 h光照/10 h黑暗光周期,小鼠可以自由摄食和饮水。小鼠适应性饲养3 d后,进行HPS造模。
1.2实验试剂 苏拉明(YJ-25986R,上海雅吉生物科技有限公司);HE染液试剂盒(ZKP-E151004,苏州泽科生物有限公司);免疫组化试剂盒(GT-2123156,上海科顺生物公司);TRIzol试剂和RIPA缓冲液(2330和3532,Sigma);PVDF膜和SuperScript IV逆转录PCR试剂盒(PB5240和18090200,Thermo Fisher Scientific);RT-qPCR定量试剂盒(RR071A,TaKaRa); 抗IL-6、TGF-β1和α-SMA抗体(13029、19832和25439,Cell Signaling Technology); II 抗(ab9482,Abcam);小鼠IL-6、IL-10、TNF-α和TGF-β1 ELISA试剂盒(a10042、a10091、J20376和a10655,上海江莱生物公司)。
2 方法
2.1HPS模型的构建 根据文献[9]描述的方法制作HPS模型,在每只小鼠的背中线制作长度为2 cm的切口,然后用6-0尼龙缝合线重新缝合。在缝合线移除后的第4天,使用固定拉伸机械装置拉伸伤口,拉伸开始于切割后第4天并持续至第14天。在拉伸期间,通过经皮涂覆给药的方法向治疗组的小鼠瘢痕部位涂抹苏拉明溶液,以同样的方法向模型组小鼠给予生理盐水,给药频率为每天1次,即每组分别给药10 d。小鼠随机分为3组:模型(model)组、低剂量苏拉明治疗组(5 mg/kg)和高剂量苏拉明治疗组(10 mg/kg),每组8只小鼠。模型组小鼠在实验全程给予生理盐水,低剂量苏拉明治疗组、高剂量苏拉明治疗组小鼠在制备成HPS模型后的第4天起,每天一次分别给予5 mg/kg和10 mg/kg的苏拉明溶液。给药10 d后,拍照瘢痕区域,并用ImageJ软件统计瘢痕表面积;然后给予过量麻醉药物处死小鼠,收集疤痕组织。
2.2HE染色 将瘢痕组织用石蜡包埋和4%多聚甲醛固定过夜。切成5 μm切片后,切片脱蜡后再水化,然后按照HE染色试剂盒操作步骤,进行常规HE染色。
2.3ELISA检测 取100 mg瘢痕组织置于玻璃匀浆器中,并加入500 μL预冷的磷酸盐缓冲液(PBS)和100 μL裂解液进行匀浆。将匀浆液在4 ℃条件下600×g离心10 min。取上清液经BCA定量总蛋白浓度后,取50 μL上清液按照ELISA试剂盒说明书步骤,检测瘢痕组织提取物中IL-6、IL-10、TNF-α和TGF-β1含量。IL-6、IL-10、TNF-α和TGF-β1水平根据标准曲线进行量化。
2.4免疫组化染色 5 μm厚度的瘢痕组织石蜡切片经脱蜡、水化后,滴加3%的过氧化氢室温孵育10 min,PBS洗3次。然后5%羊血清封闭切片30 min。接着向切片滴加1∶500稀释的IL-6和TGF-β1的 I 抗,并在4 ℃冰箱中过夜。PBS洗切片3次后,向切片滴加1∶500稀释的与辣根过氧化物酶偶联的 II 抗,并在室温下孵育45 min。PBS洗切片3次后,滴加DAB显色液并孵育1 min,用苏木精染核1 min并用1%的盐酸乙醇分化,水洗返蓝。常规脱水后,甘油树脂封片。随后使用显微镜观察,并随机拍摄6个视野,利用ImageJ软件分析切片中IL-6和TGF-β1阳性细胞数。
2.5免疫荧光观察 瘢痕组织经4%多聚甲醛和蔗糖脱水后,经OCT包埋,制作冰冻组织。然后经冰冻切片机切6 μm厚度的切片。切片干燥后,0.5% Triton X-100通透切片10 min,然后滴加1∶500稀释的针对α-SMA的 I 抗,并在4 ℃冰箱中过夜。PBS洗切片3次后,向切片滴加1∶500稀释的TRITC-IG II 抗并在室温避光下孵育45 min。PBS洗切片3次后,滴加DAPI染核5 min。甘油树脂封片。随后使用荧光显微镜观察,并随机拍摄6个视野,利用ImageJ软件分析切片中α-SMA阳性细胞数。
2.6RT-qPCR实验 将100 mg瘢痕组织在液氮中彻底研磨,然后用注射器和针头将其均匀地分开。根据TRIzol试剂盒说明书指示,提取瘢痕组织总RNA。使用逆转录试剂盒把总RNA逆转录为cDNA后,以cDNA为模板,使用定制α-SMA引物和RT-qPCR试剂盒,根据说明书在Power SYBR Green PCR仪进行RT-qPCR。α-SMA的正向引物序列为5’-GACGCTGAAGTATCCGATAGAACACG-3’,反向引物序列为5’-CACCATCTCCAGAGTCCAGCACAAT-3’;GAPDH的正向引物序列为5’-ATGGGTGTGAACCACGAGA-3’,反向引物序列为5’-CAGGGATGATGTTCTGGGCA-3’。以GAPDH为内参照,α-SMA的相对表达量采用2-ΔΔCt法计算。
2.7Western blot实验 使用RIPA裂解液从皮肤瘢痕组织中提取总蛋白,采用BCA蛋白测定法测定蛋白质的浓度。取每组20 μg的蛋白质,行10%SDS-PAGE。用5%的BSA封闭膜上的非特异性蛋白质结合位点,然后加入抗α-SMA抗体,在4 ℃过夜。第2天,将膜与 II 抗一起温育。使用增强的化学发光检测系统使条带可视化,并使用ImageJ软件定量分析目的条带。
3 统计学处理
利用SPSS 13.0软件进行统计。实验数据采用均数±标准差(mean±SD)表示,数据的比较使用单因素方差分析后Bonfferoni检验。以P<0.05为差异具有统计学意义。
结 果
1 苏拉明减少机械牵拉后瘢痕形成的总表面积
在外用苏拉明10 d后(切口后第4天至第14天),与未用苏拉明的HPS小鼠(模型组)相比,低、高剂量苏拉明治疗组瘢痕形成的总表面积均显著减少(P<0.01),见图1。这一结果提示,苏拉明在HPS小鼠模型上的局部应用可抑制由机械拉伸诱导的瘢痕形成。
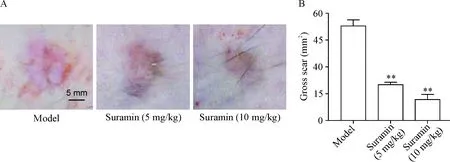
Figure 1.The surface area of scars in HPS mice was reduced after suramin treatment. A: representative macroscopic images of scar area in different groups; B: statistical data of gross surface area of scar formation in different groups. The scale bar=5 mm. Mean±SD.n=8.**P<0.01vsmodel group.
图1 苏拉明处理后HPS小鼠瘢痕表面积减少
2 苏拉明降低机械牵拉后瘢痕横截面积与瘢痕抬高指数
未用苏拉明的HPS小鼠瘢痕横截面面积大,可达1.5 mm2,瘢痕抬高指数高,可达3 mm2;而给予低、高剂量苏拉明治疗组小鼠瘢痕横截面面积均显著减少(P<0.05或P<0.01),瘢痕抬高指数均显著降低(P<0.05或P<0.01),见图2。这一结果提示,苏拉明可减轻由机械牵拉造成的瘢痕形成程度。
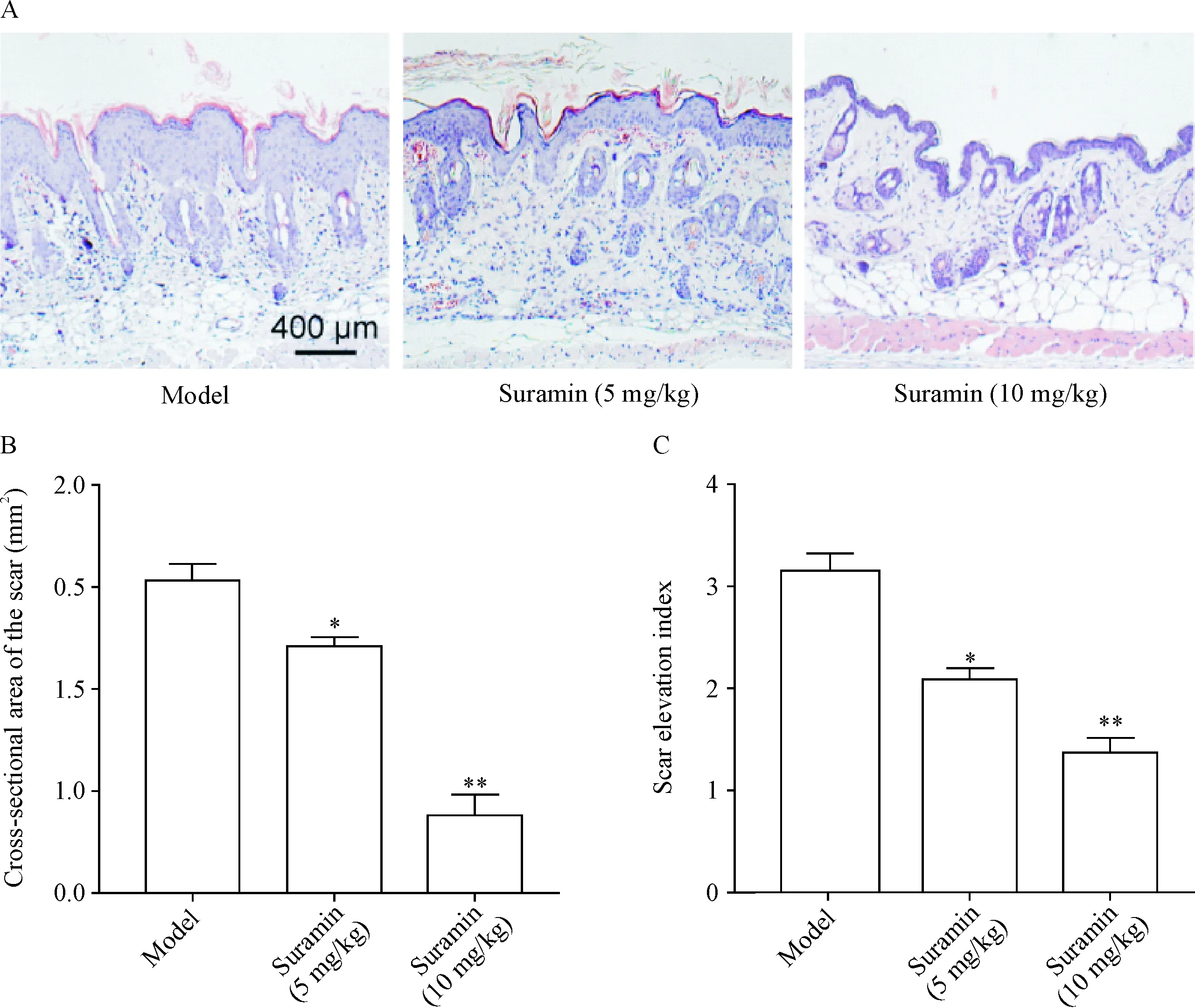
Figure 2.The scar cross-sectional area and scar elevation index of HPS mice were decreased after suramin treatment. A: representative HE staining images of scar tissues in HPS model mice; B: the statistical data of cross-sectional area of scars in different groups; C: the statistical data of scar elevation index in different groups. The scale bar=400 μm. Mean±SD.n=8.*P<0.05,**P<0.01vsmodel group.
图2 苏拉明处理后,HPS小鼠瘢痕横截面积减少,瘢痕抬高指数降低
3 苏拉明抑制瘢痕组织中α-SMA表达
与未用苏拉明的HPS小鼠(模型组)相比,低、高剂量苏拉明治疗组瘢痕组织中α-SMA阳性细胞比例显著降低(P<0.05或P<0.01),见图3A,α-SMA mRNA表达水平(P<0.05或P<0.01)和蛋白表达水平均显著降低(P<0.05或P<0.01),见图3B、3C。
4 苏拉明抑制瘢痕组织中IL-6与TGF-β1表达
免疫组化结果显示,与未用苏拉明的HPS小鼠(模型组)相比,低、高剂量苏拉明治疗组瘢痕组织中TGF-β1阳性细胞数和IL-6阳性细胞数均显著降低(P<0.01),见图4。该结果表明,苏拉明能减少瘢痕组织中IL-6与TGF-β1的表达。
5 苏拉明降低瘢痕组织中炎症因子含量
ELISA结果显示,与未用苏拉明的HPSs小鼠(模型组)相比,低、高剂量苏拉明治疗组瘢痕组织中IL-6、IL-10、TNF-α和TGF-β1含量均显著降低(P<0.01),见图5。
讨 论
30%~90%的患者能发生HPS,其特征是真皮病理性过度纤维化和伤口愈合异常[1,10]。除畸形的外观和显著的功能障碍外,还可能出现红斑、色素沉着不足或过多、瘙痒,灼热和溃疡等症状表现[11]。目前对HPS的治疗仍是一个棘手的问题,现有的治疗策略包括压力疗法、放射疗法和皮质类固醇激素治疗,然而,这些方法都有其自身的局限性。一项荟萃分析的结果显示,压力疗法并未改善瘢痕总体评分[12],原因与压力衣的不适感造成患者依从性低有关[13];皮质类固醇激素治疗也会导致高复发率和预后不良[10];放射治疗虽是一种有效的治疗方法然而对机体产生的副作用也较强[14]。因此,寻找一种安全且有效的药物来减少HPS发生成为亟待解决的问题。近期一项对青光眼滤过性手术后抗瘢痕化治疗的研究显示[15],苏拉明是一种抗瘢痕化效率高、副作用少、安全性好的治疗药物,提示苏拉明具有较好的抗瘢痕效果,因此本研究选取苏拉明作为研究抗瘢痕效果的药物。
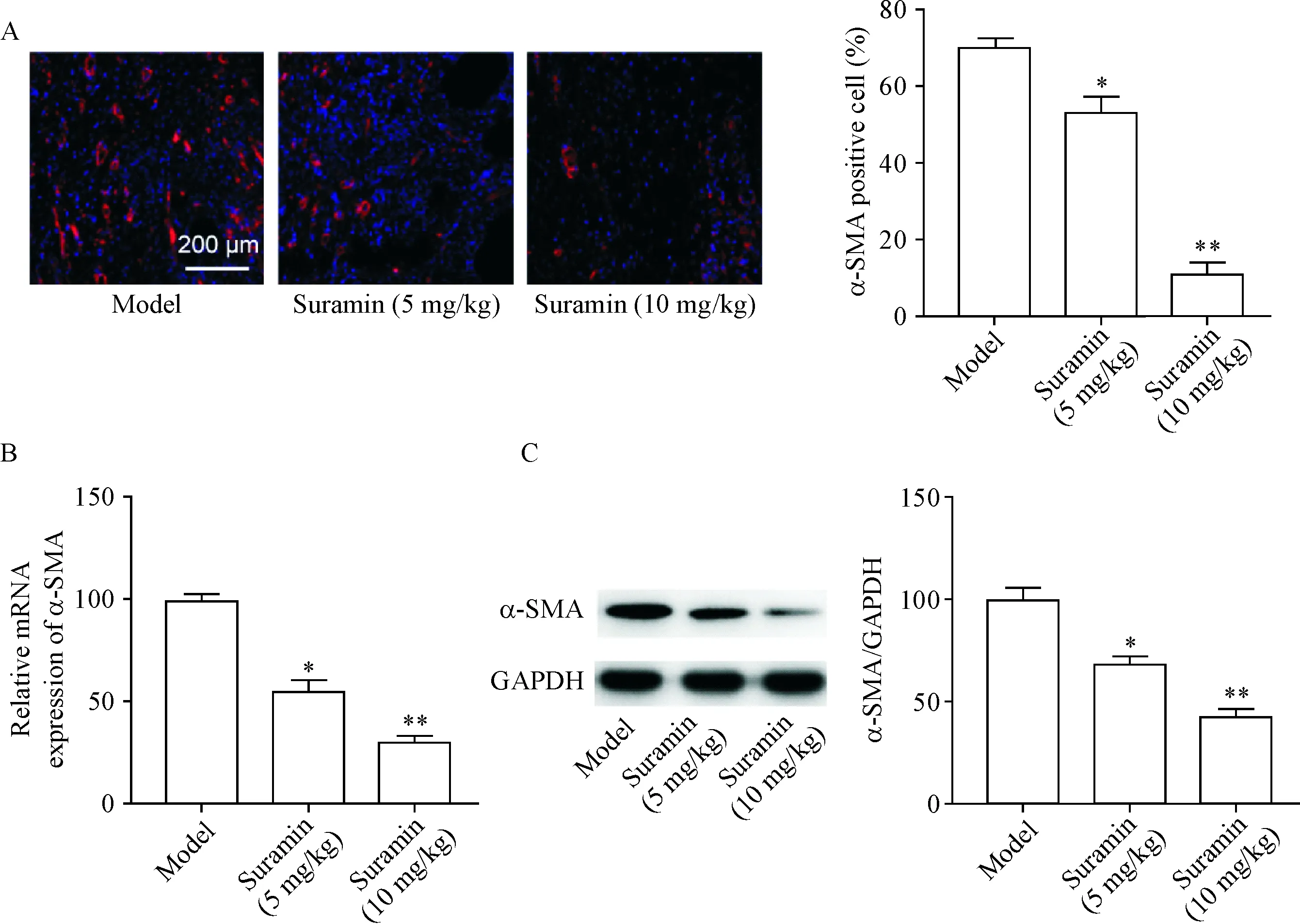
Figure 3.The expression of α-SMA in scar tissues of HPS mice was decreased after suramin treatment. A: the expression of α-SMA was detected by immunofluorescence staining; B: the mRNA expression of α-SMA was detected by RT-qPCR; C: the protein expression of α-SMA was detected by Western blot. The scale bar=200 μm. Mean±SD.n=8.*P<0.05,**P<0.01vsmodel group.
图3 苏拉明处理后HPS小鼠瘢痕组织中α-SMA表达降低
在这项研究中,我们发现在机械负荷诱导的小鼠模型中局部应用苏拉明能显著减少瘢痕总表面积、瘢痕横截面大小和降低瘢痕抬高指数,表明苏拉明能显着抑制HPS的形成。成纤维细胞的过度增殖与机体炎症反应的过度激活是HPS形成重要的病理生理基础[16]。成纤维细胞的异常增殖将导致瘢痕肥大[17],而活化的成纤维细胞会过度表达α-SMA。α-SMA是成纤维细胞标记物,与瘢痕挛缩密切相关。以往的研究显示,随着增生性瘢痕的增生和减退过程中,α-SMA的表达量明显呈由强至弱的变化,二者之间有较强的关联性[18],因此α-SMA的表达量可间接反映成纤维细胞的增殖情况。本研究结果表明,苏拉明可抑制疤痕组织中α-SMA表达,提示苏拉明可抑制成纤维细胞的活性。过度的炎症反应已被证实在过度瘢痕形成中起主导作用,伤口部位的角质形成细胞可分泌大量的细胞因子,导致瘢痕肥大[1]。以往关于苏拉明对角质形成细胞影响的研究也表明,苏拉明可使参与炎症反应的基因表达产物减少[19],我们的研究结果也提示苏拉明可能通过减少细胞分泌炎症因子来抑制HPS的形成。TGF-β1是与伤口愈合和组织纤维化密切相关的促纤维细胞因子,广泛参与成纤维细胞增殖、活化和细胞外基质(extracellular matrix,ECM)合成[20-21]。IL-6可通过诱导Th1细胞反应将急性炎症转变为更慢性的促纤维化状态,从而导致组织修复受损[22]。鉴于此,本研究进一步检测TGF-β1和IL-6的存在来明确苏拉明对瘢痕形成过程中炎症反应的影响。我们的研究结果显示,苏拉明以剂量依赖的方式显著降低HPS模型小鼠中TGF-β1和IL-6的水平,表明苏拉明可抑制促纤维化炎症因子的产生来抑制瘢痕的过度增生。此外,以往的研究也曾显示 TNF-α和IL-10在慢性炎症纤维化中发挥重要的作用[23-24],为了进一步探究苏拉明在瘢痕形成过程中与炎症反应的关系,本研究检测TNF-α和IL-10水平,结果显示,使用苏拉明可降低HPS模型中TNF-α和IL-10水平,且苏拉明给药剂量越高时降低幅度越大,提示苏拉明可能通过降低炎症因子的水平,从而起到延缓纤维化过程的作用。
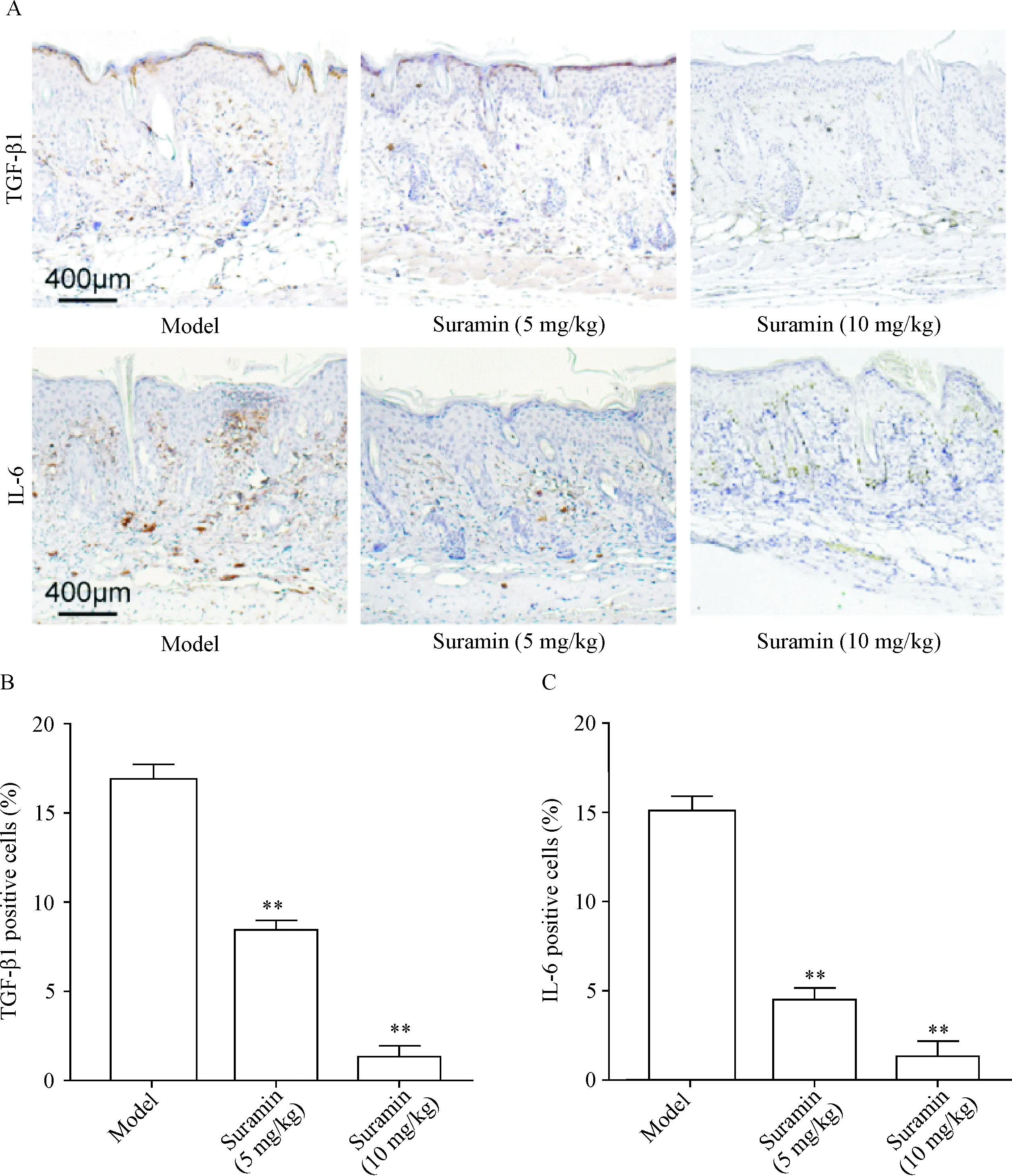
Figure 4.The expression of TGF-β1 and IL-6 in scar tissues of HPS mice was decreased after suramin treatment. A: the representative immunohistochemical staining images of TGF-β1 and IL-6 in scar tissues; B: the statistical data of TGF-β1 positive cells; C: the statistical data of IL-6 positive cells. The scale bar=400 μm. Mean±SD.n=8.**P<0.01vsmodel group.
图4 苏拉明处理后HPS小鼠瘢痕组织中TGF-β1和IL-6表达降低
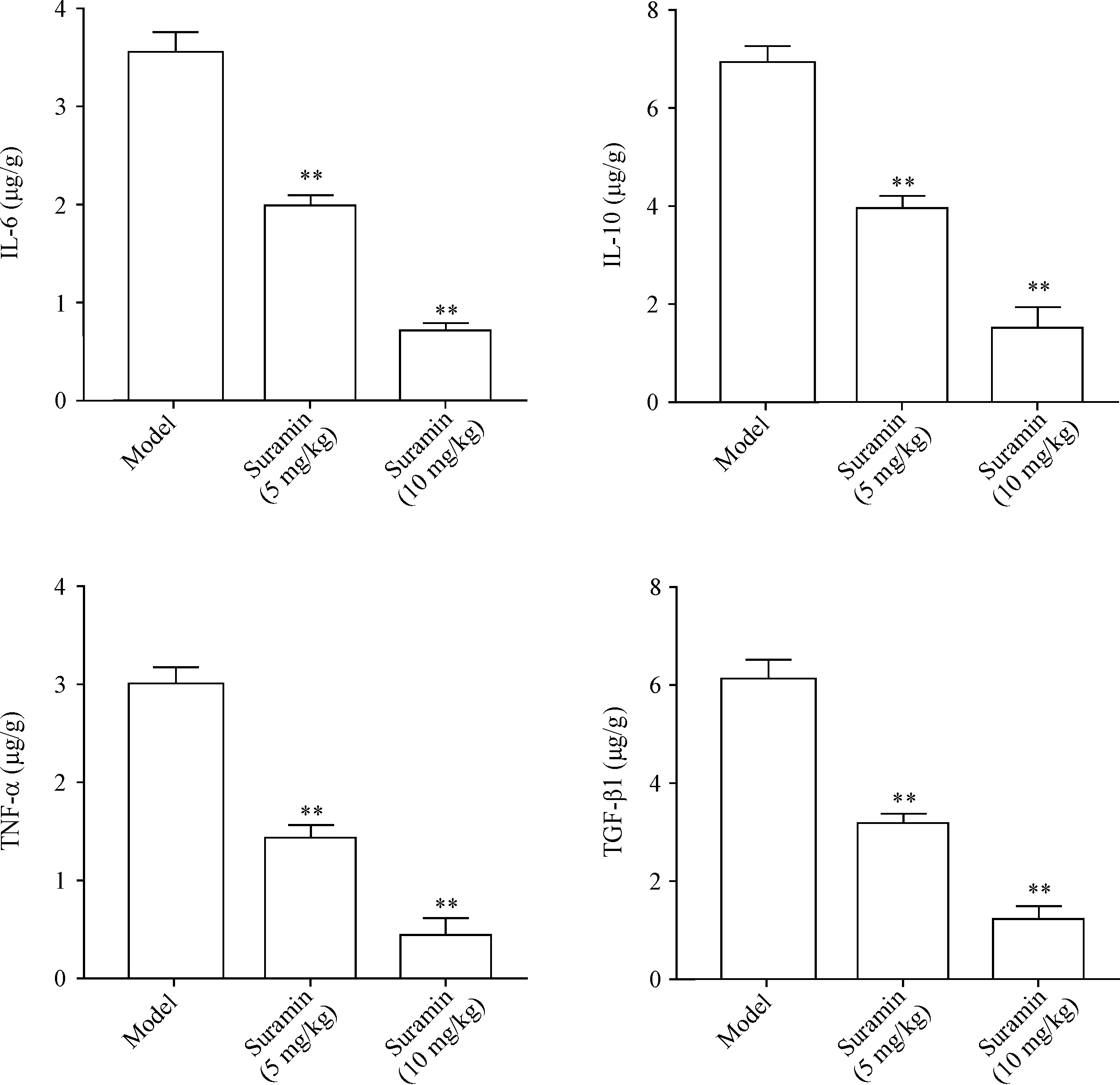
Figure 5.The levels of IL-6, IL-10, TGF-β1 and TNF-α in the scar tissues of the HPS mice were reduced after suramin treatment. Mean±SD.n=8.**P<0.01vsmodel group.
图5 苏拉明处理后,HPS小鼠瘢痕组织中IL-6、IL-10、TGF-β1和TNF-α的含量减少
综上所述,本研究表明苏拉明可通过抑制α-SMA表达来减缓纤维增生,并通过降低炎症因子的水平来抑制炎症的发生,从而抑制由机械牵拉所致的增生性瘢痕形成。本研究结果对其他纤维化疾病也具有一定的参考意义,但有待未来更多的研究来说明。

