细胞自噬在Aβ25-35损伤SH-SY5Y细胞中的作用*
杨 依, 唐晓丽, 刘 悦, 方 芳
(北京中医药大学中药学院, 北京 102488)
阿尔茨海默病(Alzheimer disease, AD) 是一种神经退行性疾病,其发病率随年龄增长,临床表现为渐进性记忆减退和认知功能障碍,生活自理能力下降,精神人格出现异常等[1]。β-淀粉样蛋白(amyloid β-protein,Aβ)沉积是AD可能的发病机制之一,体内外实验均有研究证明[2-3],一定剂量以上的Aβ具有神经损伤作用,能对动物行为和认知功能产生影响,导致或加速神经细胞凋亡,常用于模拟AD模型。生物体内Aβ的生成、代谢降解过程都与细胞自噬密切相关[4]。正常生理状态下,经自噬产生的Aβ含量不足以发生聚集[5];当自噬功能出现障碍,可能导致毒性片段产生增多或已形成的Aβ代谢清除异常,Aβ沉积,进而造成神经元损伤[6-7]。细胞自噬稳态、Aβ及AD的发病存在复杂多向的相互影响,探究其间的关系与机制具有重要意义。本研究以SH-SY5Y细胞为研究对象,旨在探索Aβ25-35诱导的神经细胞损伤是否与调节细胞自噬相关,并基于蛋白激酶B(protein kinase B, PKB/Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路对其作用机制进行初步探究。
材 料 和 方 法
1 实验材料
人神经母细胞瘤SH-SY5Y细胞株由中国人民解放军总医院药理药学研究室培养赠送。
2 药物和试剂
雷帕霉素(rapamycin,Rapa,M1768)和3-甲基腺嘌呤(3-methyladenine,3-MA, M2296)购自AbMole;胎牛血清(fetal bovine serum,FBS)购自CORNING;青-链霉素(penicillin/streptomycin,P/S)和Aβ25-35购自Sigma;聚偏二氟乙烯(PVDF)膜(FFP24)购自上海碧云天生物技术有限公司;BCA蛋白定量试剂盒(AR0146)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(0793,噻唑蓝,MTT)、anti-GAPDH(DE0621)和羊抗小鼠IgG-HRP标记Ⅱ抗(DE0602)购自北京拜尔迪生物技术有限公司;anti-mTOR(#2972)和anti-p-mTOR(#2971)购自Cell Signaling Technology (CST);anti-akt(ab8805)、anti-p-Akt(ab38449)和anti-LC3B(ab48394)购自Abcam;辣根酶标记山羊抗兔IgG(ZB-2301)购自北京中杉金桥生物技术有限公司。
3 实验仪器
酶标仪[赛默飞世尔科技(中国)有限公司];恒温水浴锅(北京长安科学仪器厂);低速离心机(北京京立离心机有限公司);二氧化碳培养箱(G.S.);凝胶成像分析仪(上海天能科技有限公司)。
4 实验方法
4.1SH-SY5Y细胞培养 SH-SY5Y细胞自超低温冰箱中取出立即投入37 ℃温水浴中,使冻存液快速融化,将细胞液转移至离心管中,加入等量DMEM完全培养液(含10% FBS,1% P/S),离心,重悬后转移至25 cm2细胞培养瓶中,于37 ℃、5%CO2的培养箱中培养。观察细胞密度达到约80%以上时进行传代培养,传至2~3代细胞生长状态稳定后进行后续实验。
4.2实验分组 Aβ25-35与SH-SY5Y 细胞共孵育实验分成6组,分别为空白对照(control)组(不含Aβ25-35)及5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L和25 μmol/L Aβ25-35组。 Aβ25-35加入适量超纯水充分溶解,配制至1 000 μmol/L,放置在37 ℃恒温培养箱中孵育7~14 d后取出,-80 ℃超低温保存备用。
自噬诱导剂(Rapa)、抑制剂(3-MA)和Aβ25-35联用,与SH-SY5Y 细胞共孵育的实验共分成6组,分别为空白对照(control)组(不含Aβ25-35,不含自噬抑制剂及诱导剂)、模型(model)组(25 μmol/L Aβ25-35)、Rapa(10 nmol/L)组、3-MA(5 mmol/L)组、Aβ25-35+Rapa组和Aβ25-35+3-MA组。
4.3MTT法检测细胞活力 选取传代后生长状态稳定的SH-SY5Y细胞,计数调整细胞密度为5×108/L,接种至96孔板,每孔100 μL,每组5个复孔,细胞贴壁后按各自分组给药培养,放入37℃培养箱中孵育24 h,100倍光学显微镜下观察细胞形态,拍照,加入MTT试剂,4 h后在490 nm波长检测吸光度(A)值,各组A值与空白对照组相比即为该组细胞的相对活力。
4.4Western blot法检测蛋白表达 BCA蛋白定量试剂盒进行细胞总蛋白提取及测定后,采用蛋白SDS-PAGE分离,湿法转膜将蛋白转至PVDF膜, 5% 脱脂牛奶在室温下封闭1 h,TBST洗涤膜3次,稀释Ⅰ抗(1∶1 000)4 ℃孵育过夜。TBST洗涤膜3次,每次15 min,Ⅱ抗室温孵育1 h,TBST 洗涤膜3次,每次10 min,ECL发光试剂1:1混匀,室温条件下避光显色,凝胶成像系统曝光。
5 统计学处理
各项实验得到的数据采用SAS 8.2统计软件进行分析,结果以均数±标准差(mean±SD)的形式表示,组间比较采用独立样本t检验或单因素方差分析,以P<0.05表示差异有统计学意义。
结 果
1 镜下观察不同浓度Aβ25-35对SH-SY5Y细胞形态影响
结果可见,与正常对照组比较,Aβ25-35与SH-SY5Y细胞共孵育24 h后,各组细胞均有不同程度突触减少、胞体回圆现象,团簇状聚集细胞团出现,且随Aβ浓度增大,损伤细胞与细胞团数量有增多趋势,其中25μmol/L Aβ25-35损伤组中畸形和损伤细胞数目较多,视野下观察损伤程度最为严重,见图1。
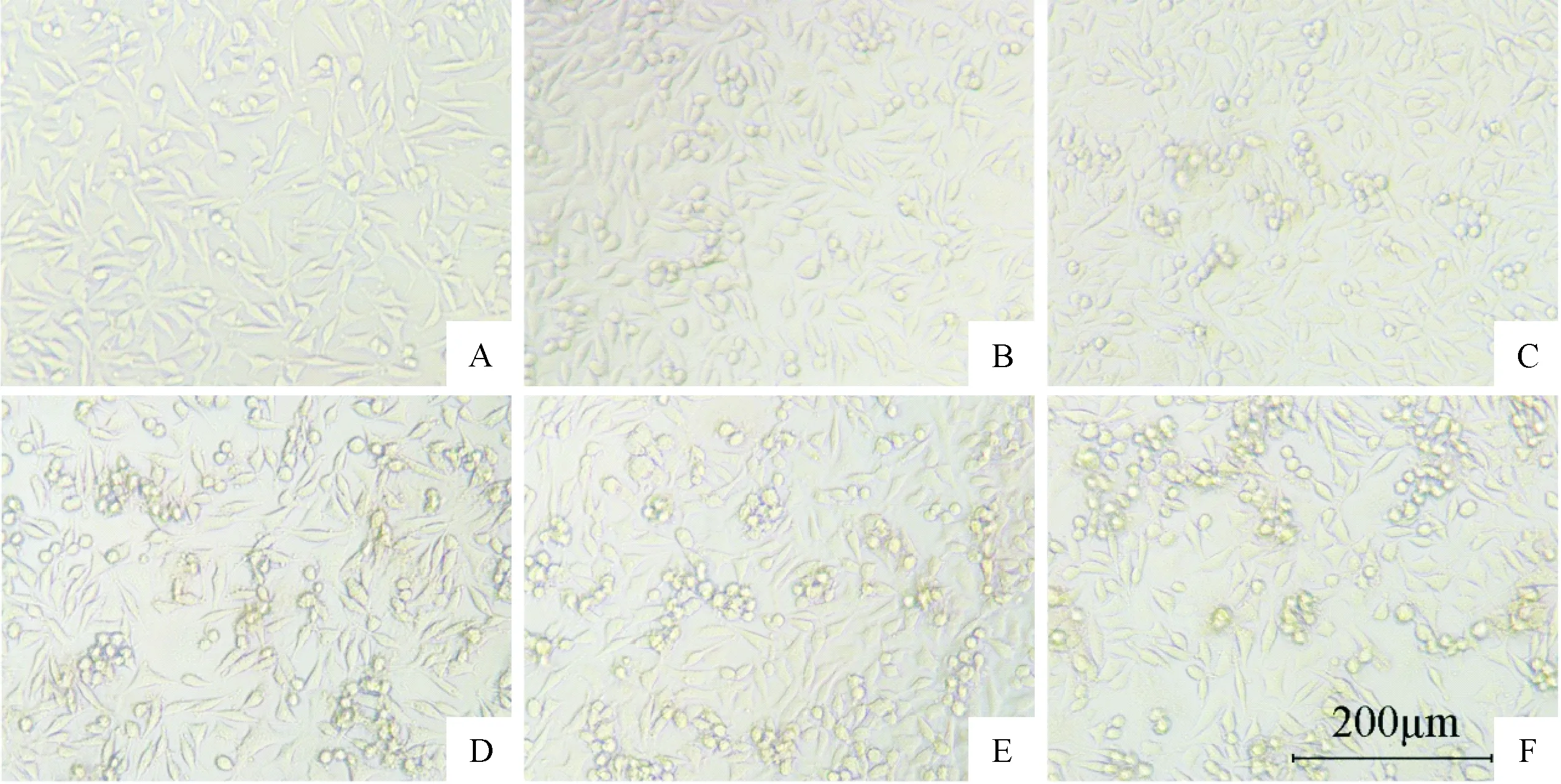
Figure 1.The effects of different concentrations of Aβ25-35on the morphological changes of SH-SY5Y cells were observed under optical microscope (×100). A: control group; B: 5 μmol/L Aβ25-35group; C: 10 μmol/L Aβ25-35group; D: 15 μmol/L Aβ25-35group; E: 20 μmol/L Aβ25-35group; F: 25 μmol/L Aβ25-35group.
图1 光学显微镜下观察不同浓度Aβ25-35对SH-SY5Y细胞形态的影响
2 MTT法检测不同浓度Aβ25-35对SH-SY5Y细胞活力的影响
由表1结果可以看出,与空白对照组比较,Aβ25-35与SH-SY5Y细胞共孵育24 h后,各组细胞的活力明显降低(P<0.05),其中25 μmol/L Aβ25-35损伤组细胞活力降低最为显著,损伤最明显。
3 Western blot法检测不同浓度Aβ25-35对SH-SY5Y细胞自噬相关蛋白及Akt/mTOR通路蛋白表达的影响
与空白对照组相比,除5 μmol/L Aβ25-35组外,其余各组细胞中LC3-II蛋白表达水平均有显著提升(P<0.05);20 μmol/L和25 μmol/L Aβ25-35组LC3-II/LC3-I水平明显提高(P<0.05);各浓度组p-Akt/Akt蛋白表达水平均显著降低(P<0.05);除5 μmol/L Aβ25-35损伤组外,其余各组p-mTOR/mTOR表达水平明显降低(P<0.05),见图2。
4 镜下观察3-MA、Rapa及二者分别与Aβ25-35联用对SH-SY5YS细胞形态的影响
与空白对照组比较,模型组细胞密度明显下降,出现团簇状细胞聚集;Rapa组细胞未见明显细胞回圆现象,视野下狭长形态细胞增多;3-MA组细胞形态略有变化,部分细胞胞壁破损;Rapa+Aβ25-35组细胞密度明显降低,突触减少,回圆细胞较多,但其回圆细胞数目及簇集程度较模型组少;3-MA+Aβ25-35组细胞密度下降,与模型组相比细胞密度相接近,破损细胞较多,见图3。
5 MTT法检测3-MA、Rapa及二者分别与Aβ25-35联用对SH-SY5YS细胞活力的影响
与空白对照组比较,模型组、Rapa+Aβ25-35组、3-MA组和3-MA+Aβ25-35组细胞存活率显著降低(P<0.05);与模型组相比,Rapa组和3-MA组细胞活力更高(P<0.05),联合用药的Rapa+Aβ25-35和3-MA+Aβ25-35组未见显著性差异;与Rapa组相比,Rapa+Aβ25-35组细胞活力显著下降(P<0.05);与3-MA组相比,3-MA+Aβ25-35组细胞活力明显降低(P<0.05),见表2。
6 Western blot法检测3-MA、Rapa及二者分别与Aβ25-35联用对SH-SY5Y细胞自噬相关蛋白及Akt/mTOR通路蛋白表达的影响
与空白对照组相比,模型组、Rapa组和Rapa+Aβ25-35组LC3-II蛋白表达水平及LC3-II/LC3-I水平均有明显上升(P<0.05),3-MA组LC3-II表达水平明显下降(P<0.05);与模型组相比,Rapa组LC3-II蛋白表达有上升趋势但未见统计学差异,而LC3-II/LC3-I水平明显增加(P<0.05),Rapa+Aβ25-35组LC3-II、LC3-II/LC3-I水平均明显上升(P<0.05),3-MA组LC3-II、LC3-II/LC3-I水平显著下调(P<0.05),见图4。
与空白对照组比较,各组p-Akt/Akt和p-mTOR/mTOR水平均有不同程度下降(P<0.05);相比于模型组,Rapa组p-Akt/Akt水平显著上调(P<0.05),3-MA+Aβ25-35组显著下调(P<0.05),3-MA组p-mTOR/mTOR水平显著上调(P<0.05),Rapa+Aβ25-35组显著下调(P<0.05);相比于Rapa组,Rapa+Aβ25-35组的p-Akt/Akt和p-mTOR/mTOR水平均显著下调(P<0.05);相比于3-MA组,3-MA+Aβ25-35组p-Akt/Akt和p-mTOR/mTOR水平均显著下调(P<0.05),见图4。
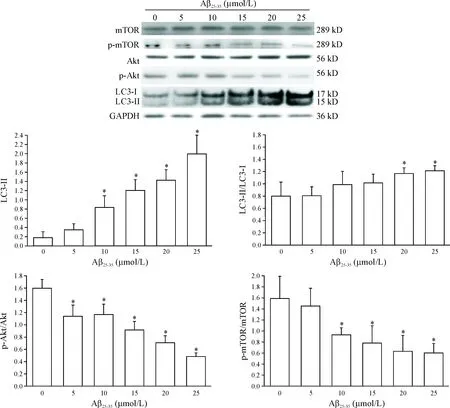
Figure 2.The expression level of autophagy-and Akt/mTOR pathway- related proteins in the SH-SY5Y cells incubated with different concentrations of Aβ25-35. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图2 不同浓度Aβ25-35与SH-SY5Y细胞孵育后,细胞内自噬和Akt/mTOR通路相关蛋白的表达水平
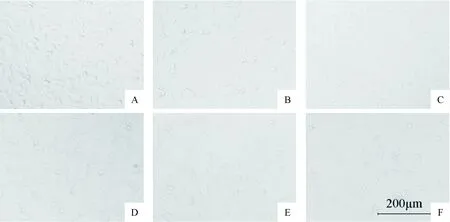
Figure 3.Effects of Rapa, 3-MA and their respective combination with Aβ25-35on the morphological changes of SH-SY5Y cells under optical microscope (×100). A: control group; B: model group; C: Rapa group; D: 3-MA group; E: Rapa+Aβ25-35group; F: 3-MA+Aβ25-35group.
图3 光学显微镜下观察Rapa、3-MA及分别联用Aβ25-35对SH-SY5Y细胞形态的影响
表1 不同浓度Aβ25-35对SH-SY5Y细胞活力的影响
Table 1.Effects of different concentrations of Aβ25-35on the viability of SH-SY5Y cells (Mean±SD.n=5)
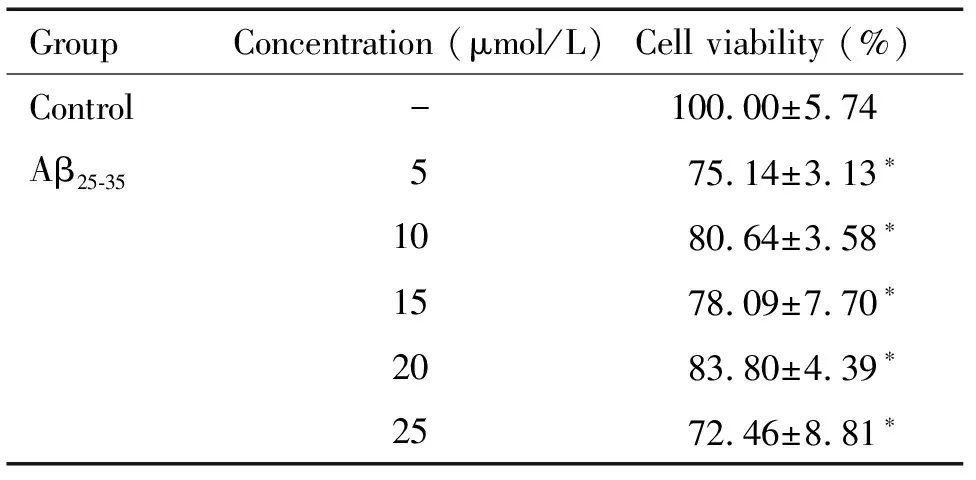
GroupConcentration (μmol/L)Cell viability (%)Control-100.00±5.74Aβ25-35575.14±3.13∗1080.64±3.58∗1578.09±7.70∗2083.80±4.39∗2572.46±8.81∗
*P<0.05vscontrol group.
表2 Rapa和3-MA对正常及Aβ25-35损伤的SH-SY5Y细胞活力影响
Table 2.Effects of Rapa and 3-MA on the viability of normal SH-SY5Y cells and the cells damaged by Aβ25-35(Mean±SD.n=5)
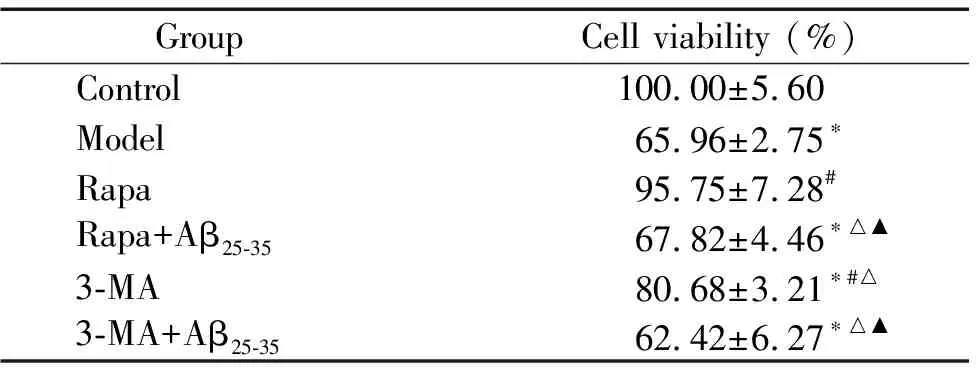
Group Cell viability (%)Control100.00±5.60Model65.96±2.75∗Rapa95.75±7.28#Rapa+Aβ25-3567.82±4.46∗△▲3-MA80.68±3.21∗#△3-MA+Aβ25-3562.42±6.27∗△▲
*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vsRapa group;▲P<0.05vs3-MA group.
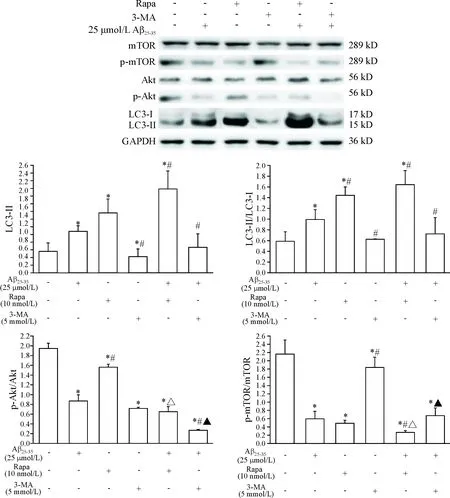
Figure 4.The expression of autophagy- and Akt/mTOR pathway-related proteins in SH-SY5Y cells treated with 3-MA, Rapa and their respective combination with Aβ25-35. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsmodel group;△P<0.05vsRapa group;▲P<0.05vs3-MA group.
图4 3-MA、Rapa及二者与Aβ25-35联用处理SH-SY5Y细胞后,细胞内自噬和Akt/mTOR通路相关蛋白的表达水平
讨 论
淀粉样蛋白假说认为,Aβ在脑内过量产生或清除出现障碍,其沉积产生毒性,进而对神经系统造成损伤破坏,是AD发病的重要因素之一[8]。有研究表明[9-10],相较于积聚形成的老年斑(senile plaque,SP),Aβ的寡聚体可能拥有更强的神经毒性,在近年得到越来越多的认可与关注,本研究所选用即为其可人工合成的有效毒性片段Aβ25-35,经老化折叠后进行细胞共孵育,结果显示,实验所选取各浓度Aβ25-35均可对正常SH-SY5Y细胞造成损伤,视野下观察可见聚集形成簇状的细胞团,损伤严重组可见细胞密度明显下降,MTT结果中,各损伤组细胞存活率均显著性下降,其中25 μmol/L Aβ25-35组的细胞损伤作用明显,细胞存活率最低。
自噬是真核细胞更新细胞器、降解代谢蛋白、产生能量和维持系统稳态的重要途径[11],主要分为大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autopahgy,CMA),分类依据为底物进入溶酶体的方式不同;其中,先形成自噬体、底物经自噬体包裹转运至溶酶体的大自噬最为常见。微管相关蛋白1轻链3-I(MAP1LC3-I,LC3-I)和微管相关蛋白1轻链3-II(MAP1LC3-II,LC3-II)在细胞自噬的检测中最为常用,被称为自噬标志蛋白,是自噬起始过程中的重要指标。LC3-I主要存在于胞浆内,当细胞自噬发生时,LC3-I与磷脂酰乙醇胺(phosphatidylethanolamine, PE)经酯化反应结合转变为LC3-II[12],LC3-II自生成便稳定结合于自噬体内、外膜上,其表达水平与自噬体含量呈正相关[13],LC3-II/LC3-I比值即表示LC3-I向LC3-II的转化程度,多用于判断细胞自噬形成所处状态。Western blot结果中,10 μmol/L、15 μmol/L、20 μmol/L和25 μmol/L Aβ25-35损伤组LC3-II蛋白表达水平均有明显增高(P<0.05),即表明在该组中细胞内自噬体含量增多,其中25 μmol/L Aβ25-35损伤组上调最为显著;20 μmol/L和25 μmol/L Aβ25-35损伤组LC3-II/LC3-I水平相对空白对照组明显上调(P<0.05),说明在以上两组中细胞自噬呈现诱导状态。
mTOR是自噬启动环节的关键调控位点,对自噬膜的形成十分重要,mTOR活化程度上升,对细胞自噬起到显著抑制作用[14],Rapa是其特异性抑制剂,有研究证明[15],当神经细胞通过自噬途径实现自我保护时,Rapa可能通过促进自噬增强其保护作用。Akt在细胞增殖、细胞凋亡调控等功能中具有重要地位[16],在Akt/mTOR通路中作为mTOR上游靶点,能直接或间接[17]影响mTOR活性。本研究发现,Aβ25-35对细胞内Akt和mTOR蛋白磷酸化水平有不同程度下调,25μmol/L Aβ25-35下调作用最显著。
选取损伤作用及对细胞自噬诱导作用均较强的25 μmol/L Aβ25-35与自噬诱导剂Rapa和自噬抑制剂3-MA联合应用,进一步观察细胞自噬状态的变化。结果提示,Aβ25-35与Rapa联用后,细胞自噬水平得到进一步促进,而对细胞存活率未见显著影响;Aβ25-35与3-MA联用后,有减弱Aβ25-35诱导的细胞自噬水平趋势,但无明显统计学差异,细胞存活率有下降趋势,但未见显著差异。由于3-MA自身对正常细胞也存在一定损伤作用,与Aβ25-35合用后,加重3-MA的损伤。由于Rapa与3-MA对Aβ25-35诱导细胞自噬的影响趋势相反,但二者的加入均未能显著改善Aβ25-35对SH-SY5Y细胞的损伤作用,由此推测细胞自噬在正常生理状态下处在相对稳定的状态,Aβ25-35对其造成损伤后,细胞处于应激性威胁中,可能引发代偿性的自我保护作用[18],诱导自噬以促进Aβ25-35的降解代谢。当Rapa联用后,细胞自噬虽得到进一步促进,可能仍不足以清除过量的Aβ25-35,无法改善其损伤或过度促进自噬同样可能破坏自噬平衡,产生损伤。3-MA对于磷脂酰肌醇3-激酶(phosphatidylinositol 3- kinase,PI3K)有特异性抑制作用[19-20],有研究表明[21],PI3K活性下调可能导致细胞凋亡的发生或促进,3-MA本身对于SH-SY5Y细胞的损伤作用可能与此机制相关;3-MA联用Aβ25-35后其自噬抑制作用也可能阻碍Aβ25-35的清除,导致细胞损伤仍较严重。
综合以上结果,自噬的稳态在维持细胞正常生长中具有重要意义,Aβ25-35可能通过下调Akt/mTOR蛋白的磷酸化水平,对SH-SY5Y细胞造成损伤并使细胞自噬呈诱导状态。本研究中所选取自噬抑制剂及自噬诱导剂未能明显减轻Aβ25-35的损伤作用,因此调整抑制剂和诱导剂浓度并稳定自噬平衡可能会有所改善。目前关于Aβ对细胞损伤作用的靶点尚不明确,其损伤作用可能通过多种通路或途径共同调节实现,对细胞自噬途径进一步探究,结合细胞凋亡、线粒体等方向进行综合考量,对进一步了解其损伤作用机制具有重要意义。

