不同疗程医用臭氧关节内注射对兔膝骨关节炎疗效比较*
薛 艳 庞晓林 何 军 杨永涛 关 圆 张东亚
(1清华大学临床医学院麻醉疼痛学,北京100083;2清华大学第一附属医院麻醉疼痛科,北京100016)
膝关节骨关节炎(knee osteoarthritis, KOA)是以关节的疼痛、僵硬肿胀,甚至功能丧失为临床表现的一种慢性退行性疾病,其危险因素包括老年、肥胖、创伤、过度使用及遗传易感性等[1~3]。我国目前骨关节炎总患病率已达到27.18%[4],其中KOA的患病率约为 18%,并且女性 KOA 患病率显著高于男性[5]。该疾病为患者带来了极大的痛苦和不便,严重降低其生活质量[6],因此,防治KOA是社会必要的需求,具有重要的社会价值。大多数研究认为医用臭氧关节腔内注射治疗KOA疗效显著,且治疗时间为4周[7],但未有研究表明是否治疗时间越长,其治疗效果越好。目前,国内外文献中未见通过对臭氧治疗不同时间进行分组治疗KOA的研究。本实验通过拟用不同治疗疗程的医用臭氧关节腔内注射对KOA家兔进行干预,观察不同治疗时间医用臭氧关节腔内注射治疗KOA,对关节液中SOD及关节软骨的影响,探讨臭氧治疗时间与KOA疗效的关系。
方 法
1.实验动物及分组
30只健康新西兰实验家兔(普通级),体重2.0~2.5 kg,购自芳元缘实验动物有限公司[许可证号:SCXK(京)2014-0012]。进入实验室后适应性喂养3天,单笼单兔喂养,保持室温23~25℃,相对湿度40%~60%,通风。利用抽签法将家兔随机分为正常组对照组(N)、模型组对照组(M)、2周臭氧治疗组(O3-2)、4周臭氧治疗组(O3-4)、6周臭氧治疗组(O3-6),每组6只。
2.实验仪器
臭氧生成仪(CHY-31T,山东淄博悦华医疗器械有限公司);兔子双足平衡支撑力测量仪(YLS-11A,北京众实迪创科技发展有限责任公司);超氧化物歧化酶(Superoxide Dismutase, SOD)试剂盒(北京方程生物科技有限公司)。
3.实验方法
N组正常饲养,不做模型手术;M组、O3-2组、O3-4组及O3-6组采用经典Hulth改良法[8]制作KOA模型:麻醉后,于兔左侧膝关节中内侧做长约1 cm的纵行皮肤切口,摘除内侧半月板、切断内侧副韧带及前交叉韧带。术中避免损伤关节软骨面,术后连续三天抗生素抗感染治疗,术后一周开始驱赶动物活动30 min,连续12周。3个月后O3-2组、O3-4组及O3-6组兔左膝关节腔内注射20 μg/ml臭氧,每次2 ml,每周1 次,分别注射2周、4周及6周。
4.取材
N组与M组3个月后麻醉药物过量处死家兔,O3-2组、O3-4组及O3-6组分别于末次治疗后3天处死。处死后,抽取1ml生理盐水注入家兔左膝关节腔,充分活动膝关节后抽取关节灌洗液,测定SOD OD值。再解剖左膝关节,首先观察软骨形态学变化,然后切开取股骨内侧髁软骨及软骨下骨,标本进行固定、脱钙、石蜡包埋及切片后,行HE及甲苯胺蓝(Toluidine blue, TB)染色,并且行Mankin's评分[9]。
5.检测和评价兔膝关节功能变化
每次取材前观察并记录局部疼痛刺激反应、步态改变、关节活动度、关节肿胀程度。用“测定双足平衡设备”检测臭氧治疗前(即第一次注射臭氧前)与治疗后(即处死前)兔双侧后足分别承重情况[10]。
6.病理观察及Mankin's评分
肉眼观察关节软骨表面是否光滑,有无糜烂、溃疡及骨赘形成;HE染色观察软骨表面是否光滑,软骨细胞排列是否规则、软骨细胞数量变化、软骨表层纤维成分变化、潮线是否完整等;TB染色观察ECM的着色深浅。使用Mankin's评分评估软骨损伤情况,分数越高说明软骨损伤越重。
7.Elisa法检测关节液SOD的表达
每份关节灌洗液稀释后,分别采用黄嘌呤氧化酶法测定SOD OD值,根据试剂盒提供的说明书进行操作。
8.统计学分析
应用SPSS 22.0软件对数据进行处理并做统计分析,统计描述以均数±标准差()表示,SOD OD值测量及Mankin's评分采用单因素方差分析(ANOVA)检验,双足平衡支撑力测量组间比较采用ANOVA检验,组内采用配对样本t检验。P< 0.05为差异具有统计学意义。
结 果
1.外部观察评价兔膝关节功能
N组正常活动,无明显跛行及关节肿胀;M组与O3-2组均出现明显跛行、关节活动度明显受限、关节肿胀及局部疼痛刺激较为强烈;O3-4组与O3-6组患肢局部对疼痛刺激反应弱,轻微肿胀,活动时轻度跛行。
2.双足平衡支撑力评价兔膝关节功能
治疗前O3-6、O3-4、O3-2、M与N组相比,差异有显著统计学意义(P< 0.01);O3-6组治疗前后相比差异具有显著统计学意义(P< 0.01),O3-4组治疗前后比较,差异有统计学意义(P< 0.05),O3-2组治疗前后比较,差异无统计学意义(P> 0.05);治疗后O3-6、O3-4与O3-2组比较,差异有显著统计学意义(P< 0.01),但治疗后O3-6、与O3-4组比较,差异无统计学意义(P> 0.05)。医用臭氧治疗KOA至少4周以上,但不能表明治疗时间越长,效果越好(见表1)。
3.病理观察及Mankin's评分
肉眼观:N组,关节软骨表 面光滑,无裂纹、糜烂及溃疡形成,软骨边缘无骨赘形成;M组,关节软骨表面粗糙,可见糜烂及溃疡形成,内侧髁边缘可见骨赘形成;O3-2组,关节软骨表面可见糜烂及溃疡形成,软骨边缘可见骨赘形成;O3-4组与O3-6组大体观察:软骨表面尚光滑,少见糜烂、溃疡,骨赘形成。
表1 各组兔治疗前后左膝关节支撑力占双下肢的比例(n = 6,)

表1 各组兔治疗前后左膝关节支撑力占双下肢的比例(n = 6,)
**P < 0.01,与 N 组相比较;#P < 0.05,##P < 0.01,与同组治疗前相比较;&&P < 0.01,与治疗后O3-2组相比较
组别 左下肢支撑力比例(%)治疗前 治疗后O3-6 33.59±3.63## 47.70±1.03##&&O3-4 35.09±2.21** 45.31±2.61**#&&O3-2 37.10±3.47** 39.91±2.83 M 37.10±3.47**N 50.36±0.90
光镜下HE染色:N组(见图1A),软骨表面光滑,细胞排列整齐,软骨四层结构清晰,无裂隙;M组(见图1B)软骨表面粗糙不规则,四层结构紊乱,软骨层变薄,软骨细胞显著减少、排列不规则,可见大量纤维软骨细胞及成簇样细胞形成,细胞外基质分解,潮线不完整,大量血管翳形成;O3-2组(见图1C),软骨表面粗糙不规则,软骨四层结构严重紊乱,大量纤维软骨细胞形成,细胞外基质分解,未见明显潮线,可见血管翳形成;O3-4组(见图1D),软骨表面较规则,四层结构尚清晰,软骨细胞数量减少,细胞排列较整齐,可见细胞轻度增生,软骨纤维成分均较模型组及O3-2组少,少量软骨细胞增生,潮线基本完整;O3-6组(见图1E),软骨表面较光滑,四层结构较清楚,软骨细胞数量轻微减少,少量软骨纤维细胞形成,潮线较完整。
光镜下TB染色:N组(见图2A),ECM着色正常,且均匀着色;M组(见图2B),ECM着色中至重度降低,着色不均匀或部分不着色;O3-2组(见图2C),ECM着色明显降低,且着色不均匀,部分不着色;O3-4组(见图2D),ECM着色轻度降低,着色较不均;O3-6组(见图2E),ECM着色较正常,着色较均匀。
根据关节软骨病理切片HE及TB染色行Mankin's评分,M组与O3-2组软骨细胞明显分裂增生,细胞排列紊乱,潮线模糊,甚至可见血管通过,Mankin's评分差异无统计学意义;O3-4与O3-6组软骨细胞排列稍紊乱,轻度分裂增生,潮线不完整,无明显血管通过及血管翳形成,Mankin's评分差异无统计学意义,且较接近正常(N组);O3-6和O3-4组与O3-2组相比差异具有显著统计学意义(P< 0.01,见表2)。
4.医用臭氧治疗后关节灌洗液SOD OD值
O3-6与N组比较,差异有显著统计学意义(P< 0.01);O3-4与N组相比,差异有统计学意义(P< 0.05);O3-2与N组比较,差异有显著统计学意义(P< 0.01),但O3-2较N组明显降低;M与N组比较,差异无统计学意义(P> 0.05)。O3-6与M组比较,差异有显著统计学意义(P< 0.01);O3-4与M组比较,差异无统计学意义(P> 0.05);O3-2与M组比较,差异有显著统计学意义(P< 0.01),但O3-2较N组明显降低。O3-6和O3-4与O3-2组比较,差异有显著统计学意义(P< 0.01),O3-6与O3-4组比较,差异有统计学意义(P< 0.05)。医用臭氧治疗KOA至少4周以上且治疗时间越长,该结果表明治疗时间越长,SOD生成越多(见表3)。
讨 论
KOA是最常见的慢性退行性疾病,已严重威胁老年人的健康,其致残率高,导致患者日常活动明显受限。传统的治疗方法如康复锻炼、止痛、消炎、理疗、针灸等,都只能暂时缓解疼痛症状,不能控制疾病的进展[11,12]; Skou和柯雪茹等[13,14]研究表明,人工全膝关节置换术后大约20%~30%的患者在疼痛、残疾及生活质量方面几乎或根本没有改善,相当一部分患者甚至会患上慢性疼痛。而注射治疗因其全身副作用小较多应用于临床。常见的注射治疗法包括玻璃酸钠和医用臭氧注射治疗,玻璃酸钠注射治疗效果显著,但其价格昂贵,治疗周期较长。近几年来医用臭氧作为一种非药理性的治疗方法已广泛应用于KOA的临床治疗[7,15~17],且疗效确切。
KOA患者的正常力学轴位发生改变,使关节的最大压力承受部位由外侧胫骨平台转移至内侧胫骨平台,导致内侧关节软骨所承受压力剧增,再加上去除内侧半月板,使关节软骨面之间失去缓冲,直接接触相互摩擦,从而使软骨发生变形损伤。本实验应用经典Hulth改良法,通过改变膝关节的正常力学轴位而制模,该法制模稳定性好[8]。本实验结果显示臭氧关节腔内注射治疗KOA可缓解疼痛、改善膝关节功能。医用臭氧关节腔内注射治疗4周及6周后,关节的双足平衡支撑力、关节软骨病理变化及Mankin's评分均无显著性差异,提示臭氧治疗4周及6周疗效相当。但与臭氧治疗2周及模型组相比,差异具有统计学意义,且臭氧治疗2周与模型组相比无显著差异,提示臭氧治疗2周疗效差,至少治疗4周以上才有显著疗效。
KOA的发病因素很多,而细胞外基质(Extracellular Matrix, ECM)的合成与分解代谢的失平衡是OA产生的主要原因之一[12,18]。膝关节是由软骨、软骨下骨、韧带、滑膜、肌肉等许多不同的组织组成的生物力学器官,这些组织的ECM提供了他它们的结构和形式,并定义了他们的生物力学特性[19]。KOA患者关节软骨及滑液中含有大量的细胞因子[20],当中性粒细胞受到免疫复合物、补体等攻击时,释放出活性氧(ROS)、NO及超氧化物阴离子(O2-)等氧自由基,这些氧自由基含有未配对的电子,形成活泼的羟自由基[21],打破机体氧化系统与抗氧化系统平衡。羟自由基可激活金属蛋白酶(Metal Matrix Proteinase, MMP),同时 IL-1、TNF-α 等炎性细胞因子也可通过刺激软骨细胞和滑膜成纤维细胞产生MMP,MMP通过降解ECM的重要成分蛋白多糖、骨黏连蛋白、胶原蛋白及软骨基底膜聚糖,加速软骨细胞的衰老与凋亡,导致细胞不能有效地对正常的负荷机制作出反应[22]。但有研究表明,KOA可通过刺激机体产生抗氧化酶,如SOD、过氧化氢酶和谷胱甘肽等[11],对抗大量氧自由基,以减轻氧自由基对软骨的损伤。医用臭氧不仅可以对抗白细胞产生的细胞因子引发的炎症反应,也可通过诱导合成SOD、过氧化氢酶等抗氧化酶抑制氧化应激反应[16],从而改善膝关节功能,延缓病情的进展。这一机制符合关节自我修复过程,并能促进修复。

图1 关节软骨病理切片HE染色
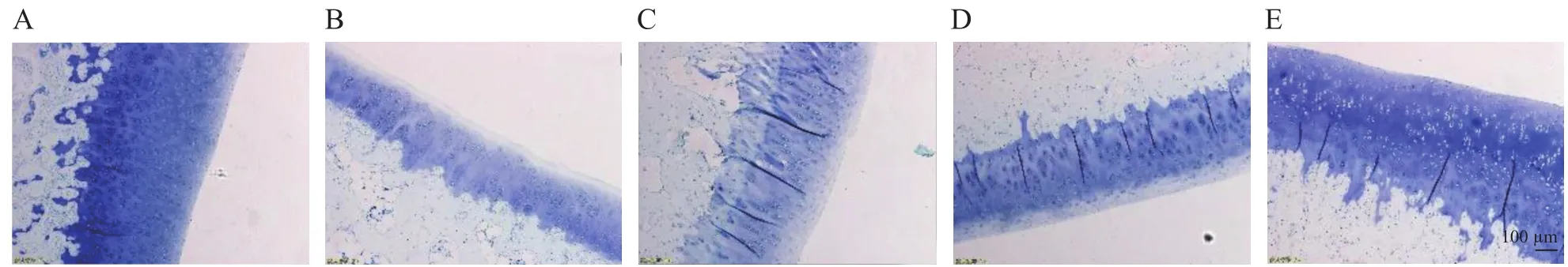
图2 关节软骨病理切片TB染色
表2 各组兔关节软骨Mankin's评分(n = 6,)

表2 各组兔关节软骨Mankin's评分(n = 6,)
*P < 0.05,与 O3-2组相比较
组别 Mankin's评分O3-6 4.00±0.63*O3-4 4.33±0.52*O3-2 12.67±1.37 M 12.83±0.98
表3 各组兔关节灌洗液SOD OD值(n = 6,)

表3 各组兔关节灌洗液SOD OD值(n = 6,)
**P < 0.01,与N组相比较; ##P < 0.01,与M组相比较;&&P < 0.01,与O3-2组相比较;△△P < 0.01,与O3-4组相比较;
images/BZ_32_365_2129_502_2193.png)O3-6 0.303±0.013**##&&△O3-4 0.283±0.012*&&O3-2 0.196±0.026**##M 0.262±0.010 N 0.250±0.016组别 SOD OD值(
本研究结果表明,医用臭氧关节腔内注射治疗4周及6周后,关节液SOD显著较M组升高,说明医用臭氧可激活机体抗氧化系统,诱导SOD抗氧化酶的生成,对抗KOA产生的过多的氧自由基,减少细胞质胶原蛋白裂解,抑制MMP的形成,进而减少对膝关节软骨的损伤,同时也可以使间质细胞和关节软骨合成增多,刺激软骨进而纤维原细胞增殖,起到一定的修复作用,与先前研究结果一致[21]。且O3-6组较O3-4组升高(P< 0.05),说明臭氧治疗时间越长,疗效越显著。M组关节液SOD含量较正常组升高,但医用臭氧治疗2周后关节液SOD含量较M组显著降低,导致出现该结果的原因可能是正常膝关节液含有少量SOD,KOA的形成可短期内诱导SOD抗氧化酶产生以对抗氧自由基,臭氧治疗2周可能无法有效激活机体抗氧化系统,并且随着病程延长SOD逐渐消耗,同时氧自由基不断增多,激活更多的MMP[11],因此会出现臭氧治疗2周时关节液SOD反而下降的现象;另外,臭氧本身也属于一种强氧化剂,也可能因为短时间臭氧治疗对软骨的损伤作用大于治疗作用。
从目前研究得出,短疗程医用臭氧治疗KOA未见明显治疗效果,是否具有损伤作用需进一步研究,下一步可通过在正常家兔膝关节注射臭氧,评估臭氧对关节软骨是否有损伤作用。臭氧治疗KOA应不少于4周,并且我们认为随着治疗时间越长效果可能会越好,但从O3-6组与O3-4组的Mankin's评分及双足平衡支撑力占比的结果比较,两组间差异无统计学意义,分析原因可能因为样本量较小所致,下一步可通过增加样本量或延长治疗时间探讨医用臭氧治疗时间对KOA的影响。
综上所述,医用臭氧关节腔内注射治疗KOA不少于4周时,对修复关节损伤、改善膝关节功能具有显著疗效,在临床上对医用臭氧注射治疗KOA的最佳疗程具有指导意义。

