磁共振动脉质子自旋标记成像在梗阻性肾病-肾纤维化中的实验研究
胡根文,刘宝良,钟淑媛,魏晓婷,邹锦森,史凯宁,杨忠*
1.深圳市人民医院(暨南大学第二临床医学院)放射科,广东深圳 518000;2.深圳市龙岗区第三人民医院放射科,广东深圳518000;3.飞利浦医疗科技,北京 100600; *通讯作者 杨忠 80250306@qq.com
梗阻性肾病是一种临床综合征,由于尿道结构和(或)功能的改变而阻碍尿液排出,从而引起肾实质病变和肾功能损害。肾间质纤维化是梗阻性肾病最终的共同转归及主要的病理基础[1]。啮齿类动物单侧输尿管梗阻(unilateral ureteral obstruction,UUO)是肾间质纤维化的标准模型,已越来越多地应用于研究[2]。磁共振动脉质子自旋标记(arterial spin labeling,ASL)是一种非侵袭性功能MRI方法,已广泛应用于神经系统疾病研究,并显示出良好的稳定性。然而,因存在腹腔多器官所致的磁敏感伪影及呼吸运动伪影,ASL在肾脏的研究及应用仍受到较大限制。
本研究通过分析梗阻性肾病-肾纤维化进程中基于磁共振ASL的肾血流量(renal blood flow,RBF)变化,探讨磁共振 ASL技术在早期检测和评估梗阻性肾病-肾纤维化的应用价值。
1 材料与方法
1.1 实验动物 48只雄性 SD大鼠由南方医科大学实验动物中心提供[动物许可证编号:SCXK(粤)2011-0015],体重(200.0±20.5)g。保持室温 18~20℃、湿度60%~70%、12 h昼夜交替的条件。使用蒸馏水和标准大鼠饮食喂养,实验过程中不限制饮用水和食物,定期记录实验动物情况。所有研究人员均严格遵循动物实验的伦理规定。
采用数字表法将大鼠随机分为 6组,分别为梗阻前组及梗阻后1、2、3、4、5 d组,每组8只。模型组参考文献[3]采用经典UUO造模方法梗阻左侧输尿管及肾脏,以右肾作为对照组。模型制备方法:适应性喂养1周后,大鼠以3%戊巴比妥钠2 ml/kg腹腔注射麻醉后行左侧腹部切口打开腹腔,钝性分离左侧输尿管,于中上1/3处以4-0丝线双重结扎,分层缝合关闭腹腔。梗阻前组及梗阻后各组按预定时间麻醉后行MRI检查。
1.2 MRI检查 应用Philips Ingenia 3.0T TX超导型MR扫描仪,以动物线圈为接收线圈(线圈通道:4独立通道;高分辨率成像范围:F/H 80 mm、R/L 47 mm、A/P 47 mm)。大鼠以3%戊巴比妥钠2 ml/kg腹腔注射麻醉后,头先进、俯卧位,使用腹带以限制大鼠腹式呼吸。采用三维定位法定位。常规横断位扫描序列采用快速自旋回波序列(turbo spin echo,TSE),扫描范围覆盖肾脏。轴位TSE-T1WI:TR 400 ms、TE 10 ms、视野(FOV)60 mm×60 mm;矩阵120×93、层厚 4 mm;轴位TSE-T2WI:TR 1080 ms、TE 120 ms、FOV 60 mm×60 mm、矩阵120×88、层厚4 mm。
ASL序列采用基于回波平面成像的交替反转恢复(flow-alternating inversion-recovery,FAIR)序列,自由呼吸,采集对照图和标记图数据,参数:TR 3000 ms、TE 35 ms、TI 1200 ms、FOV 60 mm×60 mm、矩阵76×58、层厚4 mm、NSA 10。使用后处理工作软件获得灌注图。由2名放射科主治医师手动绘制肾脏感兴趣区(ROI),独立测量双肾RBF 2次,取平均值。
1.3 肾脏组织病理学检查 MRI检查结束后处死大鼠并取出双侧肾脏。使用甲醛溶液固定、石蜡包埋,连续切片,进行 HE、Masson及 α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)免疫组化染色检查。由病理诊断专业主治医师在不知MRI结果的情况下使用病理专用显微镜拍照评估。随机选取大血管外的肾实质视野(×200),釆用Image-Pro Plus v6.0图像分析软件分析α-SMA阳性染色所占视野面积的百分比[4]。
1.4 统计学方法 采用SPSS 20.0软件,计量资料以±s表示。梗阻后各时间点左肾(梗阻侧)与右肾(健侧)计量资料比较采用配对t检验;左肾(梗阻侧)RBF与α-SMA阳性面积的相关性采用Pearson相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果 梗阻前双侧肾脏及梗阻后各组右肾(健侧)肾小球大小均匀,形态正常,肾小管结构清晰,α-SMA阳性表达仅存在于肾动脉血管平滑肌细胞;肾小球、肾小管及肾间质均未见表达。基底膜及肾间质见极少量Masson染色(图1)。
梗阻后1 d组梗阻侧肾脏可见部分肾小管上皮细胞肿胀;梗阻后3 d组梗阻侧肾脏肾小管扩张、肿胀更为明显,可见炎症细胞浸润,肾小管上皮细胞出现空泡变性,肾间质见少量Masson染色;梗阻后5 d组梗阻侧肾脏可见部分肾小管萎缩、塌陷,肾间质增宽,炎症细胞浸润,基质成分增加,纤维化形成,肾间质纤维见较多Masson染色(图1)。
梗阻后3 d组梗阻侧肾脏肾间质中α-SMA可见阳性染色。随着梗阻时间的延长,肾间质中阳性染色逐渐增多。梗阻后5 d组梗阻侧肾脏肾小管上皮细胞可见α-SMA表达。梗阻前组及梗阻后1 d组左、右两侧肾脏 α-SMA阳性面积占比差异均无统计学意义(P>0.05);梗阻后2、3、4、5 d组各组两侧肾脏α-SMA阳性表达差异均有统计学意义(P<0.05)。见图1、表1。
2.2 磁共振 ASL-RBF变化趋势 梗阻前组两侧肾脏RBF差异无统计学意义(P>0.05)。左肾(梗阻侧)RBF均随梗阻时间延长而逐渐下降。梗阻后1 d组左肾(梗阻侧)RBF较右肾(健侧)明显减低;梗阻5 d组梗阻侧RBF均值相当于对侧的29.3%。梗阻后1、2、3、4、5 d组两侧肾脏RBF差异均有统计学意义(P<0.05)。见表1。
2.3 RBF与α-SMA阳性表达面积的关系 α-SMA阳性表达随梗阻时间延长而逐渐升高。梗阻后5 d组左肾(梗阻侧)α-SMA阳性面积比为(9.37±2.26)%,对侧为(0.19±0.03)%,差异有统计学意义(P<0.01)。左肾(梗阻侧)RBF与α-SMA阳性表达面积呈负相关(r=-0.72,P<0.01)。
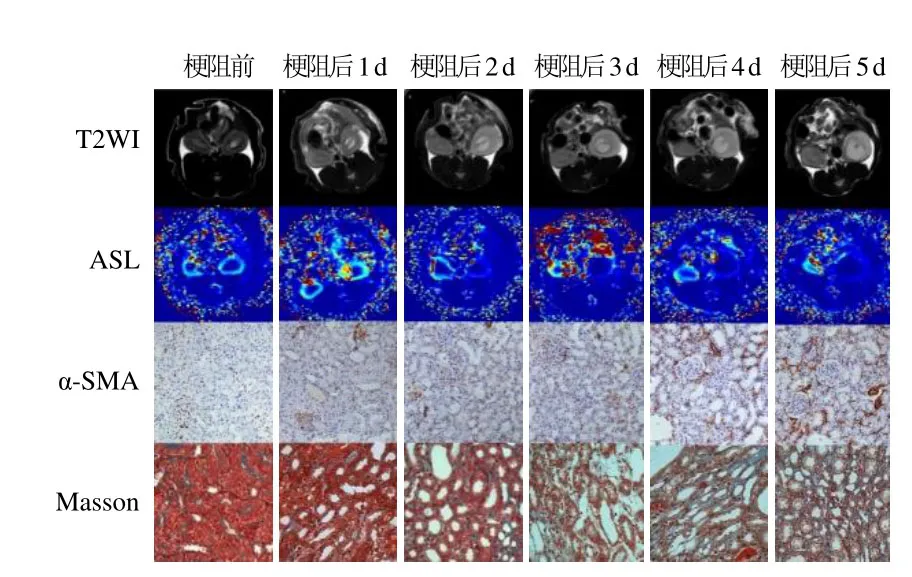
图1 梗阻前组及梗阻后1、2、3、4、5 d组大鼠磁共振T2WI、ASL及病理学α-SMA染色、Masson染色图(×200),梗阻后各组的左肾(梗阻侧)逐步增大,且ASL显示左肾(梗阻侧)RBF逐步减低
表1 梗阻前组及梗阻后1、2、3、4、5 d组大鼠双侧肾脏磁共振ASL-RBF参数及病理学α-SMA阳性表达面积比的比较(±s)
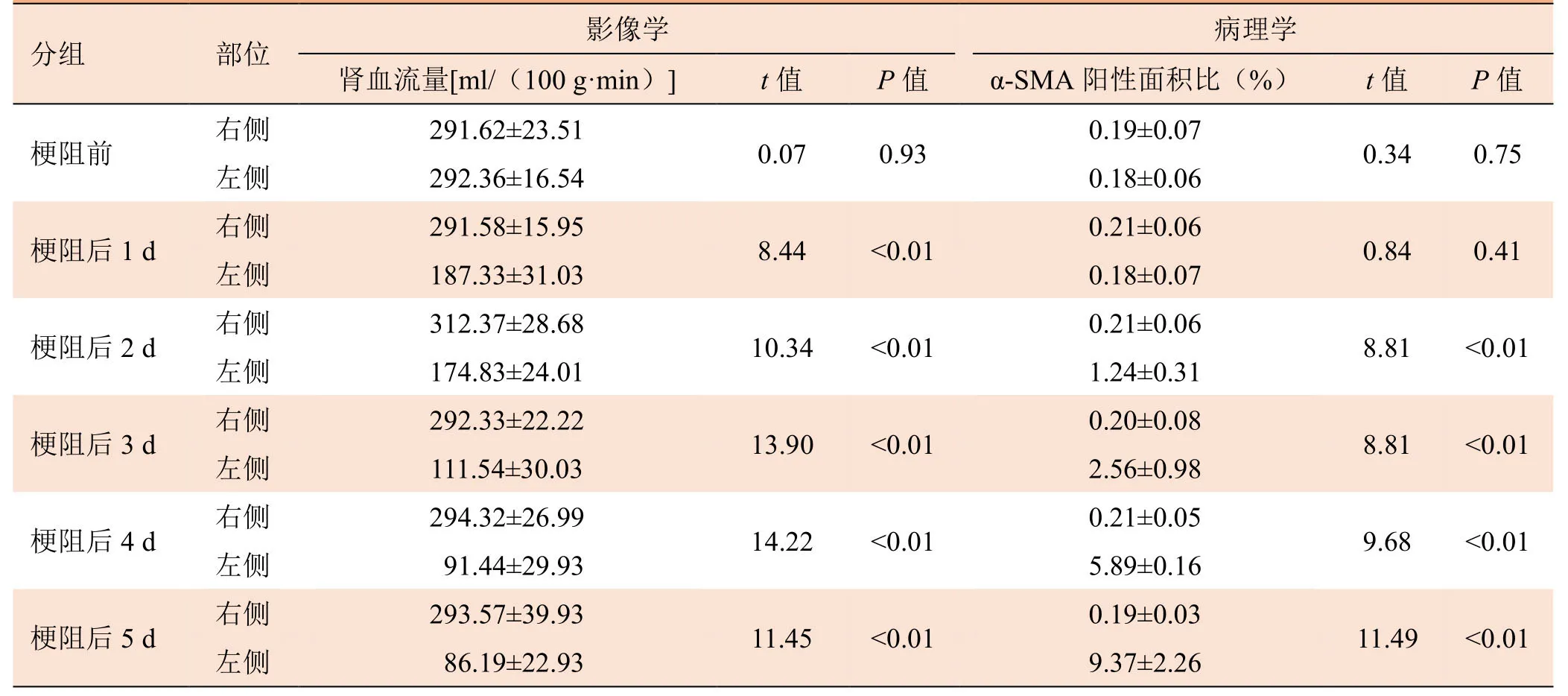
表1 梗阻前组及梗阻后1、2、3、4、5 d组大鼠双侧肾脏磁共振ASL-RBF参数及病理学α-SMA阳性表达面积比的比较(±s)
分组 部位 影像学病理学肾血流量[ml/(100 g·min)]t值P值 α-SMA阳性面积比(%)t值P值梗阻前 右侧291.62±23.510.070.930.19±0.070.340.75左侧292.36±16.540.18±0.06梗阻后1 d 右侧291.58±15.958.44<0.010.21±0.060.840.41左侧187.33±31.030.18±0.07梗阻后2 d 右侧312.37±28.6810.34<0.010.21±0.068.81<0.01左侧174.83±24.011.24±0.31梗阻后3 d 右侧292.33±22.2213.90<0.010.20±0.088.81<0.01左侧111.54±30.032.56±0.98梗阻后4 d 右侧294.32±26.9914.22<0.010.21±0.059.68<0.01左侧91.44±29.935.89±0.16梗阻后5 d 右侧293.57±39.9311.45<0.010.19±0.0311.49<0.01左侧86.19±22.939.37±2.26
3 讨论
UUO模型是研究梗阻性肾病-肾间质纤维化的常用模型。该模型通过阻塞导致肾积水、肾盂压力增加,从而降低肾灌注。一方面,肾小管供血减少,细胞缺氧,释放大量氧自由基,加重上皮细胞的氧化损伤;另一方面,肾血流量减少导致肾小球滤过率降低,引起肾素-血管紧张素系统活化,促使间质细胞增殖及巨噬细胞与单核细胞浸润,导致肾小管萎缩,最终导致小管间质纤维化。这一过程与人类肾脏间质纤维化的过程类似。
病理学中,α-SMA常作为肾纤维化进展的关键指标。α-SMA是细胞内6种肌动蛋白亚类之一,在所有真核细胞中的表达高度保守。它们沿微管组成细胞骨架的主要成分,代表血管平滑肌细胞表型转化,是肌成纤维细胞形成的标志[5]。本研究采用 α-SMA 作为肾纤维化的指标。
梗阻性肾病-肾纤维化病理分期可分为炎症反应期、纤维化形成期和瘢痕形成期。炎症反应期和纤维化形成早期经过积极干预可延缓甚至逆转患者向慢性肾衰竭的进展,故早期诊断对指导临床治疗、改善患者肾功能、提高生活质量具有重要意义[6]。
目前在临床工作中,肾纤维化的诊断方法主要包括肾穿刺病理学活检、血清学检查及影像学检查。肾穿刺活检是诊断肾纤维化的“金标准”,但其为有创性检查,不便于重复检查及动态观察[7]。目前血清学标志物的特异性和敏感性较低,限制了其在临床上的常规应用。常规影像学检查在肾纤维化的诊断中价值有限。
随着MRI硬件及技术的不断发展和完善,MR功能成像受到越来越多的关注。扩散加权成像、ASL以及磁共振血氧水平依赖成像等功能性磁共振成像在肾脏病领域的研究具有良好的临床应用前景[8-9];但其结果的准确性仍有争议[10]。
ASL通过磁化标记内源性血液有效量化评估器官的血流灌注信息。该技术既往应用于神经系统的研究;但在腹部,特别是在肾脏的应用仍有一定的限制。其原因主要为肾脏呼吸运动,多次采集数据可能出现运动位移而影响拟合的准确性。此外,腹部器官对磁场均匀度的影响减低了图像信噪比。
本研究采用ASL-FAIR的标记方法是以成像层面为中心进行射频激发,通过非选择性脉冲将较大区域内的血液进行翻转,起到标记动脉血的效果。对照图则采用选择性绝热脉冲将局部区域内的血液进行翻转,经过合理的TI,反转血流被未反转的新鲜血流完全代替而流出成像层面。最后将标记图像和对照图像代入相应的模型中进行计算,获得相应平面的灌注图像,并测量得到RBF参数[11]。FAIR标记法可较好地解决信噪比低及运动位移的情况。
目前在急性肾损伤、慢性肾病及移植肾中的研究,ASL均表现出与肾血流灌注及纤维化有较强的相关性[12-14]。本研究中,右肾(健侧)RBF保持稳定的趋势,表明基于FAIR序列的ASL所获得的肾脏RBF具有较好的稳定性。而UUO梗阻后,肾脏RBF随梗阻时间的延长逐渐减低。这符合梗阻后肾脏的病理生理改变。同时,梗阻侧的 RBF与病理学肾纤维化标志物α-SMA阳性表达具有较好的相关性。另外,梗阻后1 d组两侧肾脏RBF即有显著差异,而此时病理学α-SMA尚未显示差异,表明ASL可早期敏感地探测血流变化,有望应用于各种肾脏病变的早期观察及疗效评估。
本研究的局限性为:因同位素检查的限制,ASL所获得的 RBF未能与“金标准”同位素检查进行对照;但既往研究表明,ASL所得RBF与参照标准具有良好的相关性[15]。本研究仅测量肾门水平的 ASL信号,未能获得肾脏上下极的数据。
总之,无创性磁共振 ASL灌注成像可以在不引入对比剂的条件下,在梗阻性肾病-肾纤维化疾病早期即显示出较好的敏感性和稳定性;但其在肾脏疾病中的应用仍需进一步深入研究。

