机器学习在MRI 图像脑肿瘤分割中的研究进展
包星星,赵 璨,饶家声,2*
(1.北京航空航天大学生物与医学工程学院生物材料与神经再生北京市重点实验室,北京100083;2.北京航空航天大学生物医学工程高精尖创新中心,北京100083;3.北京航空航天大学仪器科学与光电工程学院测控与信息技术系,北京100083)
0 引言
脑肿瘤源于大脑中异常细胞的癌变,可以分为良性和恶性两类。良性肿瘤有神经胶质瘤和脑膜瘤等,通常呈膨胀式生长,生长速度较慢,包膜和边界清晰;恶性肿瘤包括胶质母细胞瘤、星形细胞瘤和髓母细胞瘤等,通常沿着正常脑组织呈浸润式生长,生长速度较快,边界较为复杂[1]。临床中,脑肿瘤位置、形状、尺寸和边界状态等信息的准确确定能够为脑肿瘤的诊断、监测和治疗提供特别大的帮助,因此,从影像学结果中准确识别并分割脑肿瘤以获取上述信息对于临床诊疗而言具有重要意义。
MRI 具有无损伤、高分辨力、高对比度以及多成像序列等特点,这使得它成为了非侵入式鉴别脑肿瘤的重要技术之一[2-5]。虽然MRI 技术在检测脑肿瘤方面的应用已十分普及,但是肿瘤组织的识别和分割仍然是制约量化结果获取的主要障碍,尤其是恶性肿瘤。图1 为高级别脑胶质瘤多模态MRI 图像,感兴趣区域包括水肿区域、坏死区域及活性区域,呈现了较为复杂的特点[6],传统的识别算法难以得到较高的准确率,而人工分割则需要花费大量的时间。近年来,机器学习方法在脑肿瘤检测中表现优异,已成为了脑肿瘤识别研究的热点方法之一[5]。机器学习模拟人脑的思考学习模式,通过对已知事物的分析和归纳,形成新的知识或是得出某种模型,并以此对未知事物做出符合实际的判断和预测[7]。由于机器学习是基于数据驱动的,理论上只要有足够的数据样本和/或优秀的数据质量,即可获得准确率较高的预测模型,这对于拥有海量数据的临床而言具有极大优势。机器学习的方法有很多种,其中传统的模糊C 聚类(fuzzy C-mean,FCM)、支持向量机(support vector machine,SVM)、随机森林(random forest,RF)和新兴的深度学习方法(deep learning,DL)在图像识别领域具有较大的优势。本文对这4 种较为典型的机器学习方法在MRI 图像脑肿瘤识别与分割中的应用展开综述。

图1 高级别脑胶质瘤多模态MRI 图像[6]
1 传统机器学习方法检测脑肿瘤
在信息迅速膨胀的时代,传统机器学习发挥着从海量数据中挖掘有用信息的作用,这使得传统机器学习被应用于许多领域,尤其是含有海量复杂信息的医学影像领域。脑肿瘤疾病的发病率较高,而传统机器学习方法能从MRI 脑肿瘤图像中识别损伤区域,很大程度上提高了脑肿瘤疾病的诊断准确率和诊断效率。本节将对传统机器学习中具有代表性的3 种方法——FCM、SVM 和RF 方法在MRI 图像脑肿瘤检测中的应用和改进进行详细阐述。
1.1 传统机器学习方法在脑肿瘤检测中的应用
FCM 属于传统机器学习中的无监督式学习方法,是在对目标函数优化基础上的一种数据聚类,源自于传统K 均值(K-means)硬划分算法的一种改进[8]。FCM 因算法简单、收敛速度快以及易于应用计算机实现而被广泛关注,成为医学图像处理技术中常用的方法之一[9]。Gupta 等[9]利用超像素和FCM 聚类概念进行MRI 图像脑胶质瘤分割,首先采用简单线性迭代聚类的方法从MRI 图像中提取超像素,随后将超像素中所有像素强度的平均值输入FCM 分类器实现分割,最后从已分割的图像中提取集中模式的运行长度特征并利用朴素贝叶斯模型进行分类。结果显示,MRI 图像脑胶质瘤分割Jaccard 指数和圆盘相似系数分别达到了91%和89%,证明了应用FCM 机器学习方法识别MRI 脑肿瘤图像的优越性。大部分情况下,MRI 图像脑肿瘤的分割与识别不是简单地应用FCM,而是将FCM 与其他算法进行结合。例如,Jayanthi 等[10]针对MRI 图像中脑肿瘤边缘轮廓的不确定性以及强度的不均匀性,将活动轮廓模型与FCM 结合,利用FCM 确定活动轮廓模型的初始轮廓,减少了人工干预,取得了较为良好的脑肿瘤分割效果。Ahammed 等[11]将K-means 和FCM 方法相结合得到K-FCM 方法,通过对脑膜瘤、肉瘤及胶质瘤等多种类型的脑肿瘤MRI 图像进行识别与分割,证明相较于单纯使用FCM 方法而言,K-FCM 表现出更好的准确性。
SVM 和RF 属于传统机器学习中的监督式学习方法。近年来,有关监督学习的脑肿瘤识别研究大多数集中于该类算法所采用的最佳图像特征集的选取,以期更好和更全面地反映脑肿瘤的特点。通常被选取为特征的参数包括脑肿瘤及周边组织图像信号强度的最大值、最小值、平均值、熵等一阶统计特征[12-14],灰度共生矩阵特征和灰度游程矩阵特征等二阶纹理特征[13-16],局部二值模式[12]、形状特征[13-14,17]、小波变换特征[18]以及基于超像素提取的脑肿瘤区域特征(统计特性、纹理特性和结构特性)[14-15]等。针对最优图像特征集的选取,目前主要的研究方向为:(1)充分利用机器学习的优势,通过复杂高维的特征代替简单低维的特征,以适应脑肿瘤在MRI 图像中的复杂表现;(2)设计获取最佳特征集的算法,以削弱主观经验对特征集选取的影响[19]。
SVM 是根据统计学理论提出的一种机器学习分类方法,其主要原理是在高维空间中寻找最优间隔超平面将不同的类别集合分开,因其在非线性和高维特征下的优秀表现在图像分割领域被广泛应用[20]。早期的研究多选取脑肿瘤的图像信号强度值作为单一特征来对其进行识别和分割,由于脑肿瘤在MRI 图像中的复杂表现,这类研究往往难以得到理想的结果。Zöllner 等[21]利用患者脑胶质瘤内相对血容量与对侧正常组织存在差异这一特点,选取相对血容量的最大比值作直方图来提取MRI 图像特征,随后采用多种改进的SVM 方法进行识别与分割,结果显示不论是低级别还是高级别的胶质瘤,其识别准确率均低于83%。后续的研究则通过挖掘脑肿瘤图像信号强度的变化特点或综合利用多种类型的特征,大幅度地提升了SVM 方法的准确性。Bhaskarrao 等[22]通过选取伯克利小波变换特征,准确地从良性胶质瘤和恶性胶质母细胞瘤的MRI 图像中识别和分割出脑肿瘤组织,研究结果显示综合准确率达到了90.54%。而当作者综合使用伯克利小波变换特征和灰度共生矩阵特征时,定位和分割脑肿瘤的准确率上升到了96.51%。针对最佳特征集生成问题,有研究采用主成分分析法(principal component analysis,PCA)[12,18]、熵度量法[13]及元启发式方法[23]等来选取最佳特征集。例如,Shil 等[24]设计了从脑肿瘤分割(Brain Tumors Segmentation,BRATS)2017 数据库(https://www.smir.ch/)及BRATS 2013 数据库中获取的T2加权图像中检测和分割肿瘤的自动化方案,通过对MRI 图像进行大津法二值化和K 均值聚类分割后再采用离散小波变换提取特征,利用PCA 方法降低特征维数以构建最佳特征集用于SVM 分类,研究结果显示该方案的灵敏度、特异度及准确度均可达到99%以上。
RF 是一种简单的分类技术,它能有效地在大数据集上运行,能处理数千个输入变量而不删除变量。RF 算法实现简单,能实现数据的并行处理且不易产生过拟合现象,这在医学图像处理中具有一定优势[1]。虽然RF 自身能估计分类的重要特征,但以简单低维的特征集作为输入数据仍然不能适应脑肿瘤MRI图像的复杂表现。例如Pinto 等[25]选取脑胶质瘤MRI成像的T1加权图像、T2加权图像、T1对比图像和液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)成像结果中的强度特征以及通过图像非线性转换计算的基于上下文的特征,并利用RF 对损伤区域进行识别与分割,获取的完整肿瘤、肿瘤核心及增强区域的Dice 系数分别仅有83%、78%及73%。而Soltaninejad 等[16]采用与Pinto 等[25]不同的更复杂高维的特征类型——强度统计、文本和曲率特征对脑胶质瘤FLAIR 成像结果进行识别,取得的完整肿瘤的Dice 系数达到了88%,证明若RF 模型能获取更适宜的复杂高维初始特征集表征脑肿瘤MRI 图像,即使仅从单一MRI 模态中提取数据,也能够得到更加鲁棒的结果。对于最适宜特征集的生成,RF存在利用高维数据导致在未运行决策树的每个节点上产生冗余项的问题,这无疑会降低RF 对MRI 图像脑肿瘤的识别准确率并增加算法计算时间。针对该问题,Cho 等[26]采用最小冗余最大相关算法,对从脑胶质瘤MRI 成像的三维数据中提取包括形状特征、灰度共生矩阵特征及图像强度大小区域矩阵特征等在内的468 个放射特征进行筛选,构建能够区分高级别和低级别胶质瘤的最佳特征集。最后作者将对脑肿瘤的识别具有最显著贡献的4 个特征数据(形状特征中的球比例和紧凑度、T1对比模态的灰度共生矩阵特征中的对比度以及FLAIR 成像结果的灰度共生矩阵特征中的相关性)输入到SVM 和RF分类器模型中进行训练和测试,结果显示,SVM 和RF 对胶质瘤级别的识别准确率分别达到了88.66%及92.13%。
1.2 传统机器学习方法在检测脑肿瘤中的改进
除了关注最佳图像特征集的选取之外,还有另一方面的研究主要关注传统机器学习方法的改进。MRI 图像脑肿瘤的大小、形状和对比度的不规则性使得传统FCM 聚类方法无法达到研究人员所期望的分割准确度。因此,近年来研究人员不断提出改进的FCM 算法以提高MRI 图像脑肿瘤的识别与分割鲁棒性。例如,Bal 等[17]提出粗糙模糊C 均值(roughfuzzy C-means,RFCM)算法有效地解决了重叠分区问题和自动确定聚类质心方法;Ren 等[27]提出加权核模糊聚类(weighted-kernel-fuzzy C-means,WKFCM)算法动态调整数据集中不同类的权重,Shanmugapriya 等[28]采用多核技术改进核模糊聚类(kernel-fuzzy C-means,KFCM)算法等,这些方法应用于MRI 图像脑肿瘤的识别与分割,相较于传统FCM 至少提高了3%的分割准确率。
SVM 方法是根据分离超平面的邻近点来进行分类的,因此需要较长的计算时间来解决由此形成的线性或二次问题[1]。在这种情况下,尽可能降低SVM 的时间复杂度可以提高SVM 方法在脑肿瘤识别中的实用性。例如,Vaishnavee 等[29]利用一种改进的近端支持向量机(proximal support vector machine,PSVM)方法对来自马萨诸塞州综合医院的网络脑分割存储库的T1加权脑图像进行肿瘤的自动检测与分级。与SVM 不同的是,PSVM 方法将SVM 中基于建立最大间隔平面原理的不等式约束变为了等式约束,通过求解一次线性方程组问题代替了原来的求解凸二次规划问题。计算结果显示,SVM 方法的准确度低于83%,而PSVM 方法的准确度则超过了92%,同时具有更低的时间成本。除了对SVM 方法本身进行改进之外,也有研究通过减少输入SVM 的数据量来缩短SVM 算法的运行时间。例如Rehman 等[15]采用基于超像素的分割方法来对原发性的神经胶质瘤MRI图像进行处理。相较于像素水平的方法而言,超像素的数量在一张图像中远小于像素的数量,可以很大程度上减少计算量,从而降低SVM 的计算成本。
RF 是通过对多棵决策树的输出实行等权投票得出分类结果,然而RF 的每棵决策树对数据的分类能力不一,等权投票机制无疑会降低RF 对数据的分类准确性。针对RF 投票机制存在的缺陷,Selvathi 等[30]提出利用AdaBoost 方法改善RF 投票机制的方法对BRATS 2013 数据库的MRI 图像脑肿瘤数据进行分类,在训练过程中提高被错分的样本权重,降低被正确分类的样本权重,同时根据分类器的分类准确率赋予其投票权重,使得每一决策树的权重与其分类能力呈正相关,最后将强度特征和原图利用曲线变换和小波变换后提取的多重分形维数特征作为RF 和改进的RF 的输入。结果显示,改进的RF 较原始RF 对MRI 图像脑肿瘤的识别准确率提高3%以上。
2 DL 方法检测脑肿瘤
DL 是一种新兴的机器学习方法,它通过挖掘图像、文本或声音等的底层特征信息并组合成抽象的和本质的高层特征信息来解释数据。DL 是当前机器学习算法中的重点研究对象之一,而卷积神经网络(convolutional neural network,CNN)则是DL 应用于图像处理领域的经典模型。自AlexNet 出现以来,CNN 在图像分类中具备了令人印象深刻的性能[31-33]。CNN 具有很强的模拟人脑学习的能力,会自动选取最有利于图像识别和分割的特征,避免了人为选取特征对分割结果的影响,因此在MRI 图像脑肿瘤分割研究中占据着重要地位。Hussain 等[34]通过CNN方法从脑胶质瘤患者的MRI 图像中识别和分割脑肿瘤组织,结果显示该方法在识别肿瘤核心和肿瘤增强核心方面的特异性系数均达到了82%以上。而Hoseini 等[35]同样通过构建CNN 方法利用BRATS 2015 数据库和BRATS 2016 数据库对MRI 图像中的脑肿瘤进行识别和分割,来自于这2 个数据库的图像分割结果的Dice 系数分别为89%和85%。
传统CNN 的卷积网络的末端是全连接层,故对图像的识别是通过逐像素地抽取周围像素对中心像素进行分类来完成的[36],这种计算方式的存储量大,执行效率低,限制了感知区域。同时,CNN 的池化层使得位置信息发生丢失,因而无法很好地给出物体的轮廓,也无法指出每个像素的具体归属,难以做到精确的分割[36]。针对这些问题,Long 等[36]提出了全卷积神经网络(fully convolutional networks,FCN)的方法,试图从抽象的特征中恢复出每个像素所属的类别(即实现语义分类)。与CNN 相比,FCN 有2 个明显的优点:一是可以接受任意大小的输入图像;二是避免了使用像素块而带来的重复存储和计算卷积问题[36]。Shreyas 等[37]通过FCN 方法利用BRATS 2015数据库,实现了220 例恶性肿瘤(包括星形细胞瘤和多形性胶质母细胞瘤)在多模态MRI 图像下的分割,展示了FCN 方法在准确性和计算速度方面相比于传统的CNN 更加具有优势。
然而,FCN 也有明显的缺点:(1)上采样倍数较小,导致上采样的结果比较模糊和平滑,缺乏图像细节;(2)忽略了通常的基于像素分类的分割方法中使用的空间规整步骤,缺乏空间一致性[38]。为了解决FCN 方法存在的问题,Ronneberger[39]提出了一种U-net 网络,相较于FCN 减少了训练的次数,同时增加了上采样层的层数,由此缩短了算法的计算时间,同时提高了输出图像的分辨力。由于MRI 脑肿瘤图像表现为区分度低及边界模糊的特点,为了提升对脑肿瘤图像识别与分割的鲁棒性,近年来研究人员基于U-net 网络提出了许多扩展版[40-43]。例如,Badrinarayanan 等[40]提出了一种SegNet 构架,基于此,Iqbal 等[41]进一步发展出IntNet、SkipNet 和SENet 3个构架(如图2 所示),并比较了上述构架对MRI 图像中脑肿瘤的检测效果,实验数据全部来自BRATS 2015 数据库中的274 例胶质母细胞瘤患者(包括良性54 例和恶性220 例)。结果证明,3 种网络结构在特异性评估系数下存在明显差异,其中SENet 构架在识别肿瘤核心区域、活性区域及肿瘤增强核心方面的特异性系数均达到了83%以上,而IntNet 和SkipNet 的特异性系数则集中在60%~73%,其建议在不同的层使用SE 板块结构或几种构架的加权组合有可能得到更理想的结果。Chen 等[42]提出的密集初始资源网结构(dense-resinception net,DRINet)实现了对MRI 图像上的多级脑肿瘤分割,结果显示DRInet在识别肿瘤核心和增强核心方面Dice 系数相较于U-net 有所提高,其中DRInet 的Dice 系数分别达到了73.21%和64.94%,而U-net 构架的Dice 系数分别为71.30%和63.05%。
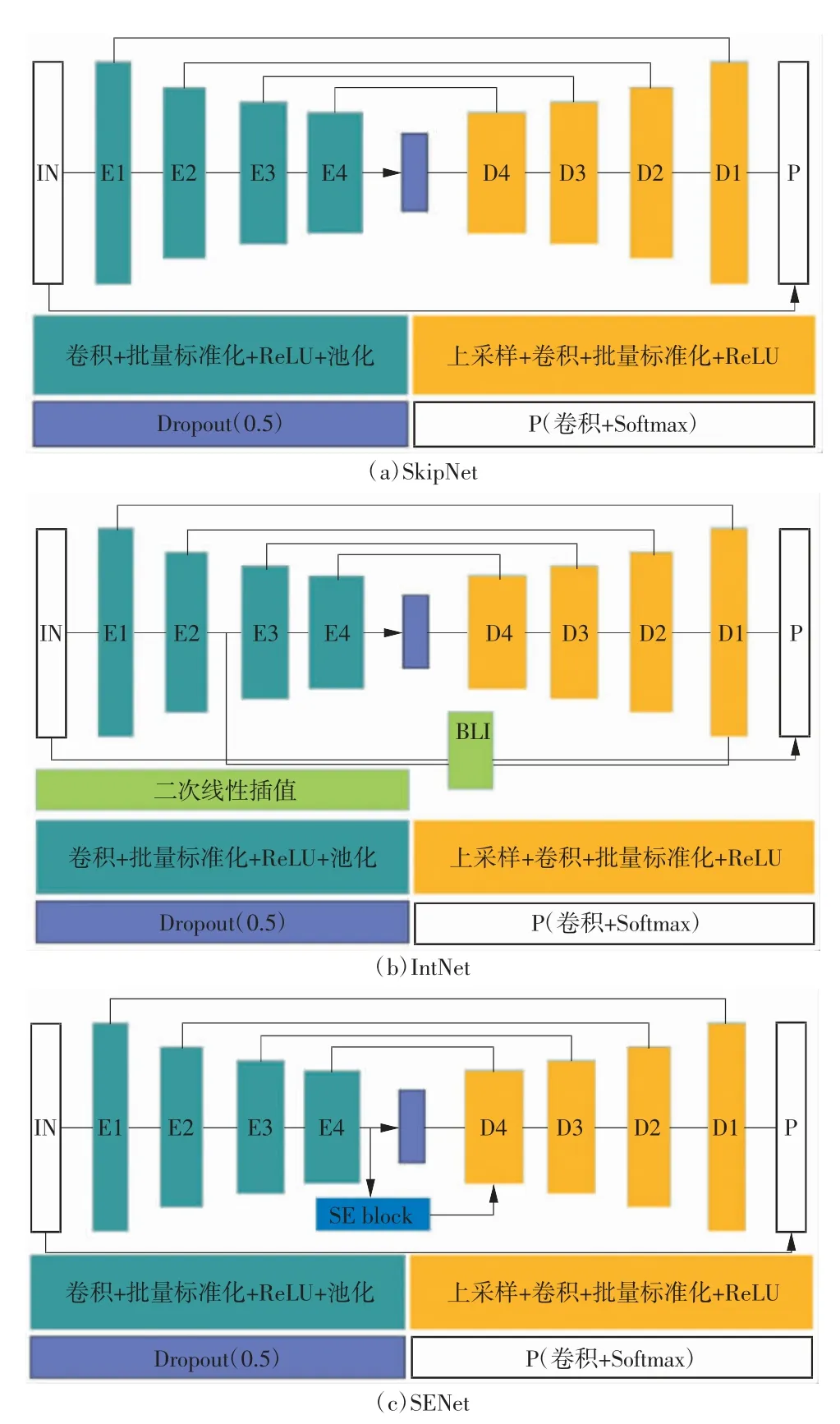
图2 SkipNet、IntNet 和SENet 结构示意图[41]
3 FCM、SVM、RF 和DL 4 种方法的比较
4 种机器学习方法各自的优缺点见表1。从表1可以得出当实验数据样本量较小的情况下,传统机器学习比DL 可得到较为鲁棒的结果,并且可避免DL 较长的训练时间。而拥有海量数据的研究采取DL 方法可得到较高的识别和分割准确率。随着时间的推移,具体某一种脑肿瘤数据量不断积累,这将推动DL 在MRI 图像脑肿瘤识别与分割中的应用,从而实现获取更为理想的分割结果。传统机器学习方法中,特征维数影响分类器的分类性能,SVM 较RF更适用于较低维度特征数据,具体研究中应根据提取的特征维数选择合适的分类器。而对于FCM,适合用于无法获取训练样本的情况。

表1 FCM、SVM、RF 和DL 方法的特点比较
4 结语
尽管现阶段机器学习在脑肿瘤识别和分割研究中已有了许多应用,但是仍然面临着不少挑战:(1)在MRI 图像中,恶性脑肿瘤的边界模糊、形状和大小不一,使用形状、灰度等构成的简单低维特征作为传统机器学习方法的输入数据难以获得理想的结果;而高维特征则会导致数据冗余,增加传统机器学习算法的复杂度和信息处理时间。(2)对于DL 方法而言,构造更深层次的网络可以获取脑肿瘤MRI 图像中更丰富的信息,但是这将进一步放大神经网络费时且极度需要海量数据的问题。
未来应用机器学习进行脑肿瘤识别和分割的研究应向更加多模态、高自动度、低复杂度、高鲁棒性和自适应性以及深度挖掘图像信息的方向发展,具体如下:(1)应用多模态MRI 数据,全面反映脑肿瘤的图像特征;(2)减少人工干预,实现全自动的图像特征集构建或选取;(3)减少计算成本,实现算法复杂度的降低和优化;(4)开发新的算法,提高对不同种类脑肿瘤识别和分割的鲁棒性与自适应性;(5)优化人工神经网络构架,在获取图像更深层次信息与降低时间复杂度方面达到平衡。随着计算机性能的不断提升以及数据信息的不断丰富,机器学习方法必将进一步发展,从而大大地推进临床脑肿瘤诊疗技术的进步。

