二氧化钛纳米颗粒的肝细胞毒性及分子机制研究
洪鸿翔,陈劲宇,邓宏健,孙郁雨,袁 锟,王祥宇,崔志明
目前,老龄化已成为世界范围公认的社会问题,衰老导致人体骨量下降、骨质疏松、关节炎症、关节退变,并由此引起重要关节部位疾病、甚至功能的丧失。骨骼问题引起的疾病是最普遍存在的人类健康问题,而生物医用金属材料成为解决这些问题的重要方法之一。二氧化钛(TiO2)是一种具有耐化学腐蚀性、光化学催化特性的无机化工材料,被广泛用于医药、日化、化妆品、食品中。研究表明[1]TiO2能够通过呼吸、消化等途径进入体内,并且在特定部位富集,从而对机体产生毒性。文献报道[2],TiO2在肝中沉淀最多,随着TiO2浓度的升高,肝功能受到明显损害,并导致抗氧化系统、免疫系统衰竭、全身出现炎症反应等一系列综合征。PD-1/PD-L1信号通路是动物体中较为保守的信号通路,对机体免疫调控起着重要的作用[3]。本研究从PD-1/PD-L1信号通路入手,探讨TiO2对小鼠肝细胞的毒性作用,从而为了解TiO2毒性及其防治提供理论依据。
1 材料与方法
1.1 实验动物及主要试剂与设备 清洁级ICR小鼠由南通大学实验动物中心提供,合格证号:SYXK(苏)20020022;TiO2购自上海医药集团;兔抗小鼠 PD-1、 兔抗小鼠 PD-L1、Rat anti-mouse-CD19-FITC、Rat anti-mouse-CD4-FITC、Rat anti-mouse-CD8-PE、兔抗GAPDH及山羊抗兔IgG购自美国abcam公司;IL-6、IL-10、TNF-α、CRP 试剂盒购自上海西唐生物科技有限公司;生化自动分析仪(日本日立,型号:7170),高速冷冻离心机(德国eppendorf,型号:5180),电泳槽(北京六一仪器厂,型号:DYY-Ⅲ),凝胶成像系统(美国 Bio-Rad,型号:GEL DOC2000)。
1.2 模型构建和分组处理 实验前小鼠适应性饲喂5 d,然后随机分为4组,每组30只,分别为空白组、TiO2(低、中、高剂量)组,TiO2组每天分别尾部静脉注射10、50、150 mg/kg的TiO2, 空白组注射10 ml/kg生理盐水,连续注射2 w。
1.3 检测指标
1.3.1 体重及肝脏系数 注射给药2 w后,称量实验小鼠体重后,麻醉、处死,取肝脏,吸水纸吸干水分,准确称量肝脏重量,肝脏系数=肝脏湿重(mg)/体重(g)。
1.3.2 肝功能 上述小鼠处死后,采用摘眼球取血法采集血液,25000 r/min离心10 min分离血清,采用全自动生化分析仪检测谷丙转氨酶(ALT)、天冬氨酸转氨酶(AST)、亮氨酸氨酸肽酶(ALP)、乳酸脱氢酶(LDH)水平。
1.3.3 血清炎症因子含量 采用上述血清标本,检测白细胞介素 -6(IL-6)、IL-10、肿瘤坏死因子(TNF-α)、C-反应蛋白(CRP)水平。
1.3.4 肝组织抗氧化酶活性 小鼠处死后,取新鲜肝组织研磨,加入1%聚乙稀吡咯烷酮,5000 r/min离心30 min,取上清液,测定超氧化物歧化酶(SOD),过氧化氢酶(CAT),抗坏血酸过氧化物酶(APx),谷胱甘肽过氧化物酶(GSHPx)活性。
1.3.5 检测PD-1、PD-L1蛋白表达水平 称取200 mg肝组织,加入裂解液,超声裂解30 s,12000 r/min、4℃离心10 min,收集上清,BCA检测蛋白浓度;待测样品与Loading buffer混合,加入至制备好的SDS-PAGE 凝胶上样孔中,25 μl/孔,4 ℃转膜 1.5 h,采用5%脱脂奶粉封闭PVDF膜2 h,分别加入一抗兔抗小鼠PD-1或兔抗小鼠PD-L1,4℃过夜;TBST洗膜后,加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2 h,ECL显影,以GAPDH作为内参,采用蛋白免疫印迹法检测PD-1和PD-L1蛋白水平。
1.4 统计学方法 应用SPSS 16.0统计软件分析,计量数据以±s表示,组间比较采用方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TiO2对小鼠肝脏系数的影响 空白组、低剂量TiO2组、中剂量TiO2组和高剂量TiO2组的肝脏系数分别为(39.87±4.32)、(51.12±4.78)、(63.81±5.04)和(72.95±5.29)mg/kg,各 TiO2组肝系数均显著高于空白组(P<0.05),且随着剂量增加,肝脏系数逐渐增大(P< 0.05)。
2.2 TiO2对小鼠肝功能的影响 各TiO2组血清ALT、AST、ALP、LDH 水平均明显高于空白组(P<0.05), 且剂量越大,ALT、AST、ALP、LDH 水平越高(P< 0.05,表 1)。
2.3 TiO2对肝组织抗氧化酶活性的影响 各TiO2组肝组织抗氧化酶活性均明显低于空白组(P<0.05),且剂量越大,肝组织抗氧化酶活性越低(P<0.05,表 2)。
2.4 TiO2对小鼠血清炎症因子含量的影响 各TiO2组血清炎症因子含量均明显高于空白组(P<0.05),且剂量越大,炎症因子含量越高(P<0.05,表3)。
2.5 TiO2对小鼠肝组织PD-1、PD-L1蛋白表达的影响 与空白组比较,各TiO2组肝组织PD-1、PD-L1蛋白表达水平明显升高,且呈剂量效应依赖关系(P<0.05,图 1)。
3 讨论
随着TiO2的广泛应用,其安全性越来越受重视。TiO2可以通过口腔、鼻腔、皮肤等途径进入机体,通过血液循环、淋巴转运在机体的各器官中沉积,如肝肾等,并对器官产生毒性作用。研究表明[4],静脉注射TiO21 w后,肝脏明显肿大,肝组织细胞损伤变性,AST和ALT活性上升。本研究采用TiO2构建小鼠肝损伤模型,结果也显示,TiO2能够明显提高肝脏系数,ALT、AST、ALP、LDH 活性明显升高,且剂量越大,ALT、AST、ALP、LDH 水平越高。

表1 各实验小鼠肝功能比较(n=30)
正常情况下,机体内ROS产生和清除处于动态平衡,而TiO2会打破平衡,造成ROS大量积累,进而导致过氧化损伤[5]。研究表明[6],TiO2在肝细胞中的积累导致ROS和Cyp1a1的表达水平增加,并抑制CAT等多种过氧化物酶的活性,进而导致肝脏的氧化损伤。本研究结果发现,各TiO2组肝组织抗氧化酶活性均明显低于空白组(P<0.05),且剂量越大,肝组织抗氧化酶活性越低,提示TiO2能够使肝脏抗氧化系统遭受破坏,其毒性效果与剂量呈正相关。

表2 各组肝组织抗氧化酶活性比较(n=30)

表3 各组血清炎症因子含量比较(n=30)
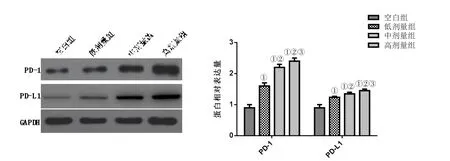
图1 各组PD-1、PD-L1肝组织PD-1、PD-L1蛋白表达水平比较
文献报道[7],肝内炎症反应会导致肝功能障碍,同时还会加重肝脏重构。既往研究结果显示[8-9],TiO2能显著激活 MIF、TNF-a、IL-6、IL-1β、CRP、IL-4 和 IL-10等细胞炎症因子 mRNA和蛋白表达水平。本研究结果也显示,TiO2会引起 TNF-α、IL-6、IL-10、CRP水平升高,且剂量越大,炎症因子含量越高,证实TiO2会引起小鼠机体炎症反应。
文献报道[10],PD-1/PD-L1信号通路在T细胞活化、增殖、免疫细胞和炎症因子产生的过程中起重要的作用,该信号通路激活会抑制免疫系统功能,促进免疫耐受。经典的PD-1/PD-L1信号通路活化表现为PD-1在细胞质中增多,进而调节Th1细胞Th2的反应。本研究结果显示,与空白组比较,各TiO2组肝组织PD-1、PD-L1蛋白表达水平明显升高,且呈剂量效应依赖关系,提示TiO2对肝细胞的毒性作用可能是通过调节PD-1/PD-L1信号通路实现。
综上所述,TiO2可能通过PD-1/PD-L通路对小鼠肝细胞产生毒性作用,且其毒性具有剂量效应关系。

