白细胞介素-33和II型固有淋巴细胞在慢性阻塞性肺疾病发病中的作用机制
姜 敏,王 晶,张洪平,田 戈,伊合帕尔·吐依洪,丁剑冰
(1.新疆医科大学附属中医医院国家中医临床研究基地,新疆呼吸病研究重点实验室,新疆 乌鲁木齐 830000; 2.新疆医科大学公共卫生学院,新疆 乌鲁木齐 830011;3.新疆医科大学基础医学院,新疆 乌鲁木齐 830011)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是常见的慢性炎症性呼吸系统疾病,其特征是持续性的气流受限,通常呈进行性发展,其发生、发展与呼吸道和肺对有害颗粒(或气体)的慢性炎性反应增强相关[1-2]。大量研究数据表明,免疫反应在COPD的慢性炎症过程中起不可忽视的作用[3-6]。白细胞介素-33(interleukin-33,IL-33)是IL-1家族的细胞因子,与细胞膜上的生长刺激表达基因2蛋白和白细胞介素-1受体辅助蛋白组成的复合受体结合,能诱导复杂的免疫反应[7]。研究证实, IL-33来源于支气管上皮细胞,在COPD 重症患者肺组织中选择性地高表达,并且其表达水平与白细胞介素13(interleukin-13,IL-13)和黏蛋白基因表达水平相关,炎性因子和呼吸道黏液的产生可导致COPD症状加重[8-9]。II型固有淋巴细胞(type 2innate lymphoid cells,ILC2)是Th2型固有免疫系统的主体[10],在蠕虫感染、异位性皮炎及呼吸道炎症反应等过程中起重要作用[11-13]。研究证实,IL-33是人类ILC2细胞的主要诱发因素[10]。本研究通过检测COPD患者和健康人群外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中ILC2比例变化,IL-33体外刺激后ILC2细胞相关因子前列腺素D2受体/表达在Th2细胞上的趋化因子受体同源分子(chemoattractant receptor homologous molecule expressed on Th2 cell,CRTH2)、GATA结合因子3(GATA-binding factor 3,GATA3)、IL-33受体生长刺激表达基因2蛋白(growth stimulation expressed gene 2,ST2)mRNA表达水平及IL-33刺激后IL-5、IL-13水平,旨在探讨IL-33、ILC2在COPD发病中的免疫作用机制,以期为COPD 的防治提供依据。
1 资料与方法
1.1 一般资料选择2017年11月至2018年5月于新疆医科大学附属中医医院门诊和住院治疗的COPD患者50例为研究对象(COPD组)。所有患者符合COPD诊断标准[14],其中男28例,女22例,年龄62~80(64.5±8.9)岁;第1秒用力呼气容积(forced expiratory volume in 1 second,FEV1)占预计值百分比为(52.3±9.2)%,FEV1/用力肺活量 (forced vital capacity,FVC)为(54.1±6.6)%。另选取同期至新疆医科大学附属中医医院体检的健康志愿者46例为健康对照组,其中男29例,女17例,年龄60~80(66.2±6.9)岁;FEV1占预计值百分比为(90.6±12.9)%,FEV1/FVC为(79.0±5.2)%。 2 组患者性别、年龄比较差异均无统计学意义(P>0.05),本研究经新疆医科大学附属中医医院伦理委员会批准后执行。
1.2 主要试剂与仪器小鼠抗人流式抗体Lineage-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)抗体包括CD3 (UCHT1)、CD19 (HIB19)、CD123(7G3)、CD11b (M1/70)、CD11c (B-ly6)、CD8 (RPA-T8)、FceRI [AER-37 (CRA-1) ]、CD14 (M5E2)、CD4(RPA-T4)、CD56 (B159)、别藻蓝蛋白(allophycocyanin,APC)-CY7-CD45 (2D1)、多甲藻黄素-叶素-蛋白质复合物(peridinin-chlorophyll-protein complex,PerCP)-CY5.5-CRTH2(BM16)、藻红蛋白(p-phycoerythrin,PE)-CY7-IL-7Rα(HIL-7R-M21)均购自美国BD公司,RPMI1640培养基购自美国Hyclone公司,淋巴细胞分离液购自天津生物科技股份有限公司,TRIzol购自国Invitrogen公司,反转录试剂盒、SYRB®Green试剂盒购自TaKaRa公司,人重组IL-33细胞因子、ST2/IL-33R 中和抗体购自美国R&D公司;流式细胞分析仪购自美国Beckman 公司,荧光定量聚合酶链反应(polymerase chain reaction,PCR)分析仪购自美国Bio-Rad 公司,热恒温培养箱购自上海精宏实验设备有限公司。
1.3 流式细胞术检测2组受试者外周血PBMC中ILC2比例2组受试者均于清晨8点采集空腹肘静脉血5 mL,肝素抗凝,上下颠倒混合均匀后送实验室。使用淋巴细胞分离液分离各组外周血PBMC,经磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤后重悬于300 μL含体积分数10%胎牛血清的RPMI1640培养基中,将细胞浓度调整为1×106L-1。将调整浓度后的细胞分别置入流式管中,加入流式抗体CD45-APC-CY7、Lineage-FITC、PerCP-CY5.5-CRTH2、CD127-PE-CY7,于室温避光孵育30 min,PBS洗涤2次后重悬,使用流式细胞仪检测ILC2的比例。
1.4 人重组细胞因子IL-33体外刺激PBMC将2组受试者分离并调整好浓度的PBMC分别接种于24孔板内,分别给予PBS、IL-33刺激、IL-33中和抗体阻断等干预措施;PBS干预细胞培养基中加入PBS,IL-33刺激细胞每孔加入50 μg·L-1重组IL-33细胞因子,于37 ℃、体积分数5% CO2培养箱中培养 48 h;IL-33中和抗体阻断细胞使用IL-33中和抗体处理1 h后,加入50 μg·L-1人重组IL-33细胞因子,于37 ℃、体积分数5% CO2培养箱中培养 48 h。1 500 r·min-1离心5 min,分别收集培养基上清液和细胞,培养基上清液于-80 ℃冰箱保存;细胞直接用于RNA的提取。
1.5 双抗体夹心酶联免疫吸附法检测各组细胞培养基上清液中IL-5和IL-13水平采用双抗体夹心酶联免疫吸附法检测“1.4”项下培养基上清液中IL-5和IL-13水平,检测步骤按试剂盒说明书操作规程进行,通过标准品吸光度值绘制标准曲线,然后计算各样本的值。
1.6 实时荧光定量PCR法检测各组细胞中CRTH2、GATA3和ST2 mRNA 的相对表达量应用TRIzol法提取细胞总RNA,反转录使用禽成髓细胞瘤病毒(avian myeloblastosis virus,AMV) 反转录体系,将cDNA置于-80 ℃冰箱保存备用。根据GenBank 中基因的序列号CRTH2(NM_004778.2)、GATA3(NM_001002295.1)、ST2(NM_001282408.1)、GAPDH(NM_002046)设计引物,CRTH2上游引物序列为5′-CGCCACACTGAAGCCACTCTG-3′,下游引物序列为5′GCGTGGTCGATGTAGCGGATG-3′;GATA3上游引物序列为5′-GTGCATGACTCACTGGAGGAC TTC-3′,下游引物序列为5′-CATGTGGCTGGAGTGGC TGAAG-3′;ST2上游引物序列为5′-CTTCACGGTC AAGGATGAGCAAGG-3′,下游引物序列为5′-CACAG GACGGCAGCCAAGAAC-3′;GAPDH上游引物序列为5′-CAGGAGGCATTGCTGATGAT-3′,下游引物序列为5′-GAAGGCTGGGGCTCATTT-3′。实时荧光定量PCR反应体系按照美国Invitrogen公司Platinum®SYBR®Green qPCR SuperMIX试剂盒说明进行。将混合均匀的样品加入反应管中后放入Bio-Rad CFX96中,反应条件为: 95 ℃ 10 s,95 ℃ 30 s,60 ℃ 30 s,共40个循环,结果使用E-△△Ct相对定量法分析。

2 结果
2.1 2组受试者PBMC中ILC2比例比较结果见图1。COPD组患者PBMC中ILC2的比例为(3.64±1.84)%,健康对照组受试者PBMC中ILC2的比例为(0.69±0.28)%。COPD组患者PBMC中ILC2的比例高于健康对照组,差异有统计学意义(t=5.252,P<0.001) 。

A1、A2:淋巴细胞;B1、B2:固有淋巴细胞;C1、C2:ILC2细胞。
图1 2组受试者PBMC中ILC2的比例
Fig.1 Proportion of ILC2 in PBMC of subjects in the two groups
2.2 IL-33体外刺激后各组细胞培养基上清液中IL-5和IL-13水平比较IL-33刺激后,2组受试者PBMC培养基上清液中IL-5、IL-13水平高于PBS干预后,差异有统计学意义(P<0.05,P<0.01);IL-33中和抗体阻断后,2组受试者PBMC培养基上清液中IL-5、IL-13水平低于IL-33刺激后,差异有统计学意义(P<0.01)。经PBS干预、IL-33刺激、IL-33中和抗体阻断后,COPD组患者PBMC培养基上清液中IL-5、IL-13水平均高于健康对照组,差异有统计学意义(P<0.01)。
表1 体外培养干预后2组受试者细胞培养基上清液中IL-5和IL-13水平比较
Tab.1 Comparison of the levels of IL-5 and IL-13 in the supernatant of cell culture medium between the two groups after culture interventioninvitro
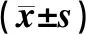

组别nIL-5/(ng·L-1)IL-13/(ng·L-1)健康对照组46 PBS干预28.09±9.724.82±2.89 IL-33刺激41.40±4.66a6.44±2.23b IL-33中和抗体阻断20.70±0.09c4.21±0.83cCOPD组50 PBS干预38.50±9.34d6.36±2.03 d IL-33刺激48.95±12.95be9.79±1.46be IL-33中和抗体阻断22.90±4.26cf4.36±1.57cf
注:与同组PBS干预比较aP<0.05,bP<0.01;与同组IL-33刺激比较cP<0.01;与健康对照组PBS干预比较dP<0.01;与健康对照组IL-33刺激比较eP<0.01;与健康对照组IL-33中和抗体阻断比较fP<0.01。
2.3 IL-33体外刺激后各组细胞中GATA3、CRTH2、ST2 mRNA相对表达量的比较结果见表2。经PBS干预、IL-33刺激、IL-33中和抗体阻断,健康对照组受试者PBMC中GATA3、CRTH2、ST2 mRNA相对表达量比较差异无统计学意义(P>0.05)。经PBS干预后,COPD组患者PBMC中GATA3、CRTH2、ST2 mRNA相对表达量低于IL-33刺激后,差异有统计学意义(P<0.001)。经IL-33刺激后,COPD组患者PBMC中GATA3、CRTH2、ST2 mRNA相对表达量较健康对照组升高,差异有统计学意义 (P<0.001) ;加入IL-33中和抗体阻断后,COPD 组患者PBMC中GATA3、CRTH2、ST2 mRNA相对表达量显著低于经IL-33刺激后,差异有统计学意义 (P<0.001) 。
表2 体外培养干预后2组受试者细胞中GATA3、CRTH2、ST2 mRNA相对表达量比较
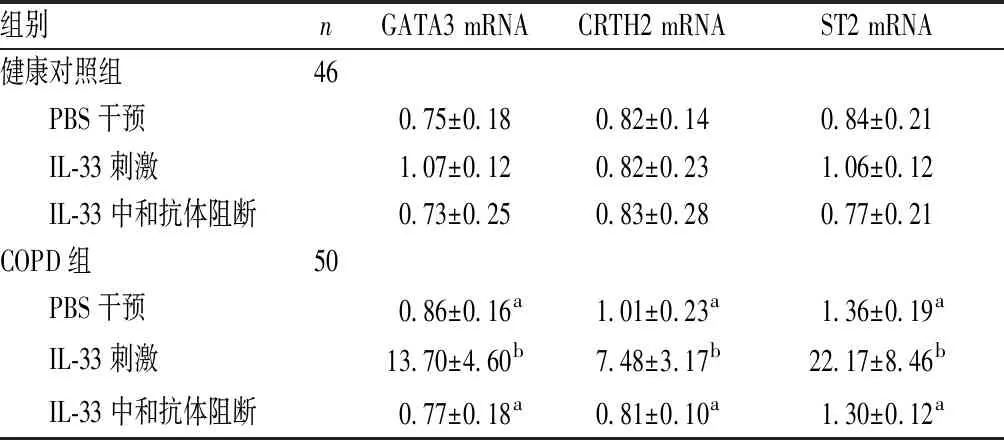
组别nGATA3 mRNACRTH2 mRNAST2 mRNA健康对照组46 PBS干预0.75±0.180.82±0.140.84±0.21 IL-33刺激1.07±0.120.82±0.231.06±0.12 IL-33中和抗体阻断0.73±0.250.83±0.280.77±0.21COPD组50 PBS干预0.86±0.16a1.01±0.23a1.36±0.19a IL-33刺激13.70±4.60b7.48±3.17b22.17±8.46b IL-33中和抗体阻断0.77±0.18a0.81±0.10a1.30±0.12a
注:与COPD组IL-33刺激比较aP<0.001;与健康对照组比较bP<0.001。
3 讨论
COPD是一种慢性炎症性呼吸道疾病,对环境中有害因子的异常免疫反应通常被认为是导致其发病的主要原因[15]。通过对实验动物模型和人体受试者的研究,越来越多的证据表明,先天免疫系统的反应对于COPD的发展至关重要[16-18]。
研究发现,COPD的发病过程可能存在ILC2细胞的参与[19-20]。本研究结果发现,COPD患者外周血中ILC2比例显著高于健康对照组,这与WU等[21]的研究结果相一致,ILC2细胞的占比反映了其在炎症过程中功能活化情况。研究表明,ILC2可由肺上皮细胞及其他结构细胞和免疫细胞释放的IL-33、IL-25、胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)等炎性介质激活,促进肺部的病理性炎症反应[22-24]。本研究对IL-33体外刺激ILC2细胞的检测结果显示,IL-33体外刺激后COPD组患者ILC2相关因子CRTH2和核转录因子GATA3 mRNA表达水平均显著高于健康对照组,COPD组患者IL-33受体ST2 mRNA表达水平也显著高于健康对照组,同时检测到IL-33体外刺激后COPD组患者Th2型细胞因子IL-5和 IL-13高表达。研究表明,转录因子GATA3对ILC2细胞的功能是不可或缺的[25],在GATA3缺失的情况下,淋巴样祖细胞不能发育成为ILC2,当GATA3表达减少时,ILC2会降低对IL-25、IL-33和TSLP的反应,相应地细胞因子分泌也减少[26]。KLEIN WOLTERINK等[27]在胎儿和成人肺中检测到ILC2,并证实IL-33可刺激ILC2细胞高表达CRTH2,并促进IL-13的产生,这表明人呼吸道ILC2也可能对IL-33发生反应。ST2的表达水平可间接反映IL-33的生物学效应。
本研究结果提示,在COPD进程中ILC2发挥了生物学作用。COPD患者外周血ILC2细胞可经IL-33刺激,高表达IL-5和IL-13等细胞因子,从而引起持续的炎症反应进而参与COPD的发病过程。深入探讨IL-33与ILC2细胞在COPD疾病中的作用机制,有望为COPD疾病中免疫反应过程提供新的理论,可能为COPD细胞免疫治疗新靶点的选择提供新的基础参考。

