不同林型红松林土壤真菌群落组成和多样性*
陈秀波 朱德全 赵晨晨 张路路 陈立新 段文标†
(1 东北林业大学林学院,哈尔滨 150040)
(2 贵州财经大学艺术学院,贵阳 550025)
(3 佳木斯大学理学院,黑龙江佳木斯 154007)
(4 佳木斯大学中-乌农林技术开发与应用国际联合实验室,黑龙江佳木斯 154007)
红松(Pinus koraiensis)是我国东北地区珍贵针叶树种,以红松为建群种的混交林是该地区最具代表性的地带性顶级植被类型,也是我国温带针阔混交林带内最典型、最多样和最重要的森林生态系统,具有极高的生产力和生态地位。该区域气候寒冷、土壤潮湿、有岛状永久性冻土存在,属于全球气候变化敏感区域[1]。从19世纪开始,大量的原始红松林被砍伐,使其遭到严重破坏,除了少数保护区外,原始红松林已基本消失[2]。
欲保护和维持红松林生态系统的稳定性,需要分析原始红松林对环境的适应、重要物质循环和能量流动的过程及规律。土壤真菌作为分解者存在于森林生态系统中,参与物质循环、能量流动和信息的传递[3-4]。它们在分解森林凋落物、转变有机质、改善土壤环境和为树木根系提供营养等方面扮演着重要角色[5]。真菌群落组成和多样性特征的研究对于红松林保护,食品和医药工业的真菌资源开发具有重要意义。
近些年对红松林土壤微生物的研究主要是采用稀释平板法和Biolog-ECO微平板检测法。虽然有晁开瑞[6]、吴庆禹[7]、董爱荣[8]等对椴树红松林、枫桦红松林、红松人工林等林型土壤真菌的组成和多样性进行了报道,但都是基于培养手段进行研究的。森林土壤真菌数量巨大,种类繁多。传统的分离培养方法不能覆盖土壤中绝大多数真菌,难以反映真菌群落多样性全貌[9]。目前,对同一物种或不同物种的不同菌株间进行真菌分类鉴定或系统发育等方面的研究,通常利用核糖体转录间隔(Internal transcribed spacer,ITS)序列的差异进行比较分析[10]。以Illumina公司为代表的Miseq二代测序技术,具有通量高、重复性好、价格便宜、读长合适等优点。ITS较rDNA转录区的变异率高,能有效区分亲缘关系比较相近的菌株[11],已广泛应用于环境[12-13]和医疗等相关研究领域。
不同林型的红松林由于植被组成不同,土壤理化性质各异,可能会引起真菌群落组成和多样性的不同。本研究选取黑龙江省伊春市凉水国家级自然保护区内两种典型原始红松混交林(云冷杉红松林和椴树红松林)、红松人工林和红松天然次生林四种林型,采用Illumina MiSeq测序技术,分析这四种林型土壤真菌群落组成和多样性特征,以便为红松林的保护、人工植被恢复和真菌资源的开发利用提供依据。
1 材料与方法
1.1 研究区概况
研究样地位于小兴安岭凉水国家级自然保护区内,地处黑龙江省伊春市带岭区。地理坐标为东经128°53′20″,北纬47°10′50″。该区地带性植被类型是以红松为主的混交林,土壤为山地暗棕色森林土,母质是坡积或冲积母质上发育的腐殖质沼泽土或泥炭腐殖质沼泽土。研究区域具有明显的温带大陆性季风气候特征,年均最高气温7.5 ℃,最低气温-6.6 ℃,平均-3℃,年均地温1.2 ℃。年均降水量667 mm,年均相对湿度78%。在该区域内,选取两种典型的原始红松林(云冷杉红松林和椴树红松林)、红松人工林和红松天然次生林四种林型为研究对象。在每种林型的阳坡上,设置四块面积为25 m×25 m的样地。四种林型中乔木均以红松作为建群树种,各样地基本信息见表1。红松人工林植物群落相对比较单一,乔灌木种类少并且高度矮于其他三种林型。四种林型中的藤本植物主要为狗枣猕猴桃(Actinidia kolomikta)和忍冬(Lonicera japonica)。草本植物主要以鳞毛蕨(Dryopteris)、猴腿蹄盖蕨(Athyrium multiden tatum)、蚊子草(Filipendula Palmata)为主。
1.2 土壤样品采集和理化因子的测定
选择微生物活动最为活跃的7月份采集土壤样品。在每个样地,沿“S”形曲线随机设置5个取样点,小心移去每个取样点土壤表面凋落物,使用内径为5 cm的土钻和100 cm3环刀,采集0~20 cm表层土壤样品,每个样地重复采样3次,将其混合均匀后装入无菌自封袋,分两份保存。其中一份用于测定土壤真菌群落多样性,-80 ℃冰箱中保存;另一份土壤风干去杂质后过筛,用于土壤理化性质的测定。
根据土壤常规分析方法测定土壤理化性质[14]。使用pH计测定土壤pH;使用环刀法测定土壤容重和土壤孔隙度;采用烘干法测定土壤含水量和凯氏定氮法测定全氮;有机碳含量测定采用重铬酸钾氧化法;采用钼锑抗比色紫外分光光度法测定全磷含量。每份样品各项指标重复测定3次。
1.3 土壤微生物DNA提取及ITS基因测序
称取0.5 g新鲜土样,采用Fast®DNA SPIN Kit(MP Biomedicals,CA,USA)提取土壤微生物的总DNA,然后采用PowerClean®DNA Clean-up Kit (MoBio, CA, USA)对提取的DNA进行纯化,经琼脂糖凝胶电泳定性检测后,再采用Nanodrop 2000(Thermo,USA)测定其浓度及纯度,最后置于-20 ℃冰箱中保存备用。对每份样品,采用引物ITS1/ITS2(ITS1:5-TCCGTAGGTGAACCTGCGG-3),ITS2:5-GCTGCGTTCTTCATCGATGC-3)扩增ITSI片段[15]。PCR步骤按试剂盒说明书进行操作,用2%的琼脂糖电泳检测相同样本混合后的PCR产物,使用Axy Prep DNA 凝胶回收试剂盒切胶回收PCR产物。利用Quant-iT PicoGreen dsDNA Assay Kit对PCR产物在Microplate reader(BioTek, FLx800)上进行定量,然后按照每个样品所需的数据量进行混样,构建Miseq文库。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。根据该试剂盒的说明书进行操作,纯化富集后的文库经过2%琼脂糖凝胶电泳检测大小,对文库进行最终的片段选择与纯化。
表1 四种林型样地基本信息Table 1 Basic information of the sampling sites in the four types of Pinus koraiensis forests
1.4 高通量测序及下机数据处理
依据PCR产物浓度,将所有扩增成功的PCR产物等量混合,采用Illumina Miseq平台进行双末端250 bp测序。数据下机后,根据barcode标签序列和前引物序列筛选出有效序列,去除Reads接头和barcode序列,同时用FLASH软件对原始数据进行过滤,去掉含有不确定碱基的序列、平均质量小于Q20、最终长度小于50 bp的序列以及去除含N碱基的reads。根据PE reads之间的overlap关系,将成对reads拼接成一条序列,最小overlap长度为10 bp。采用Usearch(vsesion 7.0 http://drive5.com/uparse/)去除嵌合体序列,并对有效序列进行数据统计。
1.5 生物信息学分析
使用QIIME软件,调用UCLUST这一序列比对工具[16],对获得的高质量序列,按97%的序列相似度进行归并和OTU(Operational taxonomic units,OTU)划分,并选取每个OTU中丰度最高的序列作为该OTU的代表序列。随后,根据每个OTU在每个样本中所包含的序列数,构建OTU在各样本中丰度的矩阵文件(即OTU table)。在QIIME软件中使用默认参数,通过将OTU代表序列与真菌ITS数据库Unite(Release 6.0 http://unite.ut.ee/index.php)的模板序列相比对,获取每个OTU所对应的分类学信息。另外将丰度值低于全体样本测序总量0.001%的OTU去除,并以OTU丰度矩阵中最小样本的序列数进行抽平,去除稀有OTU的OTU丰度矩阵用于后续分析。
使用QIIME软件,对OTU丰度矩阵中每个样本的序列总数在不同深度下随机抽样,以每个深度下抽取到的序列数及其对应的OTU数绘制稀疏曲线。根据OTU划分和分类地位鉴定结果,使用QIIME软件,可以获得每个样本在各分类水平(界、门、纲、目、科、属、种)的具体组成,并通过柱状图进行表示。根据获得的OTU丰度矩阵,使用R软件计算各样本(组)共有或特有的OTU数量,并采用韦恩图展示。同时使用R软件,绘制门水平和属水平群落Bar图。使用QIIME软件分别对每个样本计算四种α多样性指数:Chao1丰富度估计指数、Ace 丰富度估计指数、香农指数(Shannon index)和辛普森指数(Simpson index)。通过R软件,对四种林型的真菌群落组成进行基于UniFrac距离算法PCoA分析(principal coordinate analysis)和ANOSIM(Analysis of similarities)分析,通过对样本间距离判断样本差异大小。通过在线LEfSe(LDA Effect Size)软件对四种林型的差异真菌进行分析,找出不同林型中具有显著性差异的真菌物种,设置LDA(Linear Discriminant Analysis)score的阈值为2。采用典范对应分析(Canonical correspondence analysis,CCA)和Spearman相关性进行土壤理化因子和真菌群落组成的关联分析,本研究所涉及的统计分析采用SPSS v16.0软件进行分析。
2 结 果
2.1 四种林型红松林的土壤理化性质
两种原始红松林的土壤理化性质除水分含量和总孔隙度差异显著外,pH、总有机碳、全氮、全磷、土壤容重均无显著差异(表 2)。红松天然次生林与其他三种林型之间多数土壤理化因子(pH、总有机碳、全氮、全磷)差异显著。

表2 四种林型红松林的土壤理化性质Table 2 Physicochemical properties of the soil under the four types of Pinus koraiensis forests
2.2 土壤样品测序结果及测序深度评估
通过对土壤真菌的ITS片段测序,16个土壤样品一共获得534 359条有效序列,经过优化过滤低质量序列得到505 299条优质序列。供试土壤样品序列经拆分、去冗余后在97%的相似度下进行OTU聚类,四种林型一共获得1 316个OTUs。如图1所示,16个土壤样品稀释曲线基本趋于平缓,测序深度基本能反映四种林型土壤真菌群落。
不同林型土壤环境中真菌OTU数目的Venn图可以看出(图2a),云冷杉红松林获得的OTU数目最多(629),其次是椴树红松林(544)和红松人工林(392),红松天然次生林最低(302)。并且四种林型土壤共有的OTU数目较少(59个),然而在纲水平的Venn图显示,四种林型样地共有真菌17纲(图2b)。
2.3 四种林型红松林土壤真菌群落α多样性
本试验采用体现真菌群落丰富度的Chao1指数和Ace指数,真菌群落多样性的香农指数和辛普森指数以及群落覆盖度的Coverage指数,α多样性指数的统计结果见表 3。
由表 3中看出,云冷杉红松林的Chao1指数和Ace指数>椴树红松林>红松人工林>红松天然次生林(其中椴树红松林和云冷杉红松林的Ace指数、Chao1指数与红松天然次生林差异显著,P<0.5)。体现群落多样性的香农指数和辛普森指数:椴树红松林>云冷杉红松林>红松人工林>红松天然次生林,但差异不显著。本次测序的覆盖率均在99%以上,进一步证实测序结果较好的代表土壤样本中真菌群落组成的真实情况。
2.4 四种林型红松林土壤真菌群落组成及差异物种

图1 每个土壤样品的稀释曲线Fig.1 Rarefaction curve of each soil sample

图2 四种林型红松林土壤真菌韦恩图Fig.2 Venn diagram of the soil fungi of four types of Pinus koraiensis forests

表3 不同林型红松林土壤真菌α多样性指数Table 3 Alpha diversity index of the soil fungi in different types of Pinus koraiensis forests
四种林型16个土壤样品的OTU代表序列经比对鉴定得到7门、25纲、79目、166科、290属、441种的土壤真菌物种信息。四种林型土壤真菌群落门水平上主要属于5个类群(图3),主要包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、分类地位未鉴定真菌(unclassified-k-Fungi)、接合菌门(Zygomycota)和罗兹菌门(Rozellomycota)。根据LEfSe分析的LDA判别分值(表4)也发现:在门分类水平上,椴树红松林土壤中担子菌门与其他三种林型差异显著。此外,罗兹菌门只在红松人工林中检测到,而在云冷杉红松林、椴树红松林和红松天然次生林中未被检测到。

图3 四种林型红松林土壤真菌门水平上的群落丰度Fig.3 Abundance graph of the soil fungal community of four types of Pinus koraiensis forests at phylum level
在属分类水平上,去除相对丰度小于0.02%的其他菌属后,四种林型包含23属土壤真菌(图4),各种林型均含有大量未被鉴定的真菌,相对丰度在15.20%~29.22%。同时根据LEfSe分析的LDA分值(表4),在属分类水平上,四种林型一共有19个差异真菌属,其中椴树红松林土壤中显著性差异的真菌属最多(10个),红松天然次生林中最少(1个)。
2.5 四种林型红松林土壤真菌群落β多样性
对四种林型土壤真菌群落在OTU水平上进行基于unweighted UniFrac距离算法的主坐标分析(图5)显示:椴树红松林的土壤真菌群落可以与其他三种林型距离较远,可以分开。同时结合ANOSIM分析四种林型土壤真菌群落的相似性,结果显示:在考虑真菌物种丰度和系统发育进化距离的情况下,OTU水平四种林型红松林土壤真菌群落组成差异显著(R=0.537,P=0.001),但两种原始林(云冷杉红松林和椴树红松林,P=0.064)、人工林和天然次生林之间(P=0.181)组成相近,差异不显著。
2.6 四种林型红松林土壤真菌群落与土壤因子的相关性
采用CCA分析探究影响四种林型土壤真菌群落组成的环境因子。选择7个对微生物群落有显著作用的土壤理化因子(pH、水分含量、土壤总孔隙度、土壤容重、总有机碳、全氮、全磷)结合OTUs表格进行分析。分析发现全氮、总有机碳、pH、水分含量和土壤总孔隙度5个理化因子对土壤真菌群落组成有显著性影响(P<0.05)。同时根据各环境因子在第一轴的投影显示,土壤全氮可能是影响四种林型土壤真菌群落组成的主要因子,其次为总有机碳(图 6)。

图4 四种林型红松林土壤真菌属水平上的群落丰度Fig.4 Abundance graph of the soil fungal community of four types of Pinus koraiensis forests at the genus level

表4 四种林型红松林土壤显著性差异真菌门和属的LDA分值Table 4 LDA scores of fungal phyla and genera with significant difference in soil of four types of Pinus koraiensis forests

图5 四种林型红松林土壤真菌群落基于unweighted UniFrac距离的主坐标分析Fig.5 PCoA analysis of soil fungal community in four types of Pinus koraiensis forests based on unweighted uniFrac distance
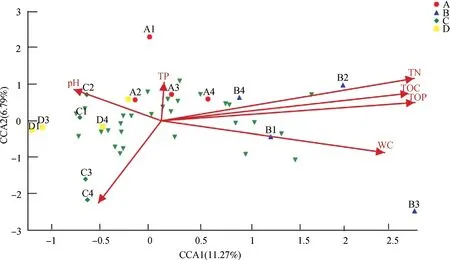
图6 四种红松林土壤真菌群落组成与土壤理化因子间的典范对应分析(CCA)Fig.6 Canonical correspondence analysis (CCA) between soil physicochemical factors and soil fungal community composition of four types of Pinus koraiensis forests
同时采用Spearman相关性系数分析不同土壤理化因子与丰度前20的土壤真菌属相对含量之间的相关性,相关性热图见图7。从图7中可以看出,土壤pH与马拉色氏霉菌属的相对含量显著正相关,与unclassified-o-Archaeorhizomyces显著负相关。土壤水分含量与Sebacina和unclassifiedf-Thelephoraceae显著正相关。土壤总孔隙度与红菇属和乳牛肝菌属显著正相关。土壤全磷与unclassified-o-Archaeorhizomyces显著负相关。土壤总有机碳含量与四个菌属显著相关。土壤全氮与六个菌属显著相关。
3 讨 论
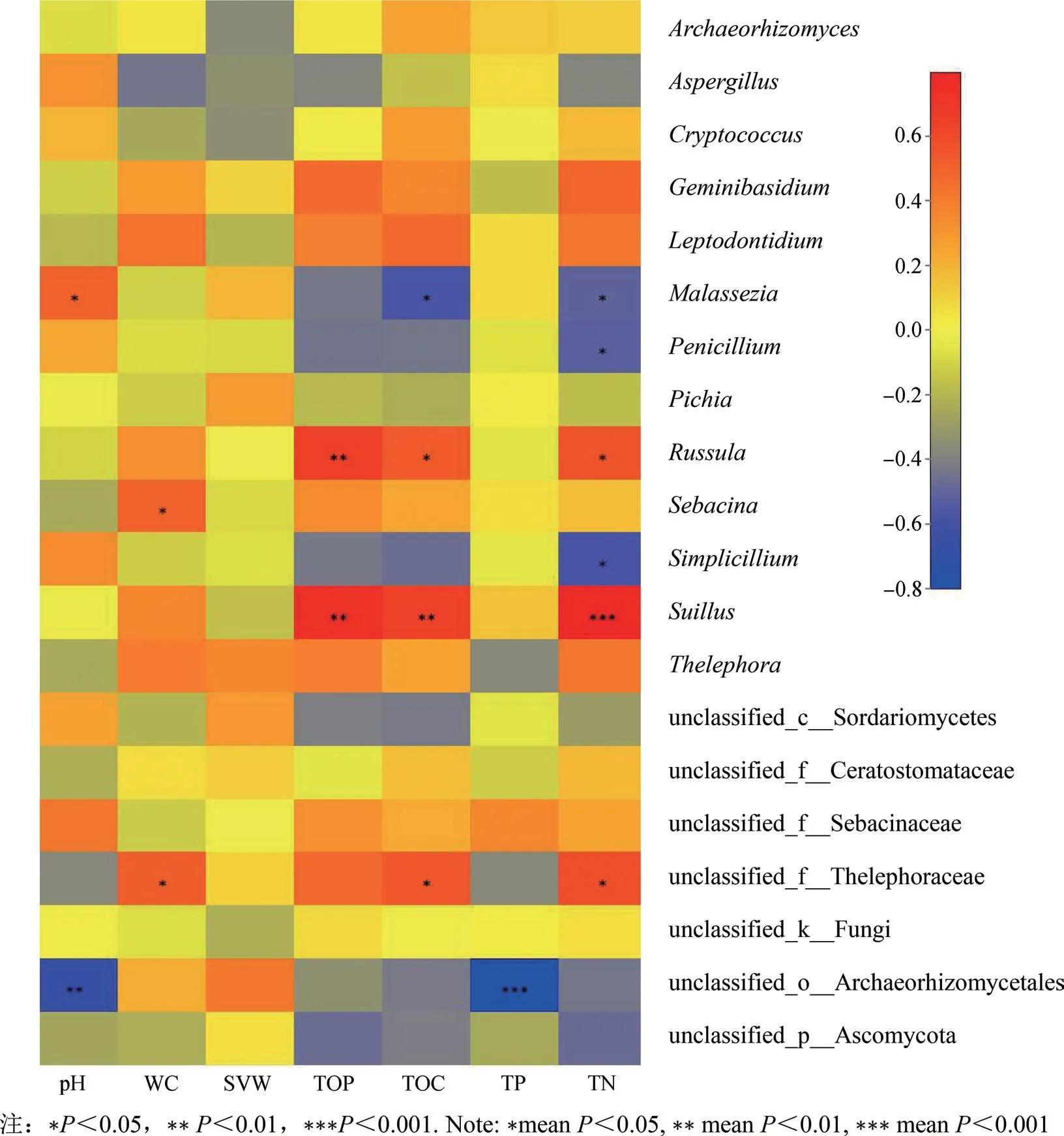
图7 四种红松林土壤因子和真菌群落组成相关性热图Fig.7 Correlation heatmap of soil physicochemical factors and composition of soil fungal community of four types of Pinus koraiensis forests
Illumina MiSeq高通量测序技术的发展提供了一个强大高效的平台,可以迅速有效地分析微生物的群落结构组成[17]。有学者认为,微生物群落的整体组成在不同生境中的差异可能较大,但优势菌群基本相似。本研究也发现四种林型土壤真菌优势菌门为子囊菌门和担子菌门,两种类群的真菌含量超过70%,其中子囊菌门和担子菌门在各林型中的相对组成比例都超过70%为优势菌门,但两个菌门在四种林型中丰度各有差异,其中子囊菌门在红松人工林中的相对丰度最高(64.82%),红松天然次生林次之(58.00%),椴树红松林最低(35.09 %);担子菌门在椴树红松林的相对丰度最高(45.65%),云冷杉红松林次之(29.12%),红松天然次生林最低(11.81%)。两种优势菌门与以往的一些研究结果类似[13,18-19]。如乔沙沙等[18]利用Illumina高通量测序技术分析了关帝山庞泉沟自然保护区四种林型的5个土壤真菌群落,结果发现5个样地中共有7个真菌门和322个真菌属,其中子囊菌门和担子菌门相对丰度最大。
在属分类水平上,四种林型红松林土壤中均含有大量未鉴定的真菌菌属,在已经鉴定的真菌菌属中,按丰度高低依次为子囊菌门中未分类菌unclassified-p-Ascomycota、Leptodontidium、拟青霉属(Simplicillium)、Sebacina、粪壳菌纲中未分类菌(unclassifiedc-Sordariomycetes)、红菇属(Russula)、unclassified-O-Archaeorhizomycetales、青霉属(Penicillium)、隐球菌属(Cryptococcus)、Archaeorhizomycetales、Pichia酵母属(Pichia)、Telephora、乳牛肝菌属(Suillus)、Geminibasidium、马拉色氏霉菌属(Malassezia)等。其中以Leptodontidium、拟青霉属、Sebacina、红菇属、青霉属和隐球菌属为优势菌属,这与一些森林土壤中鉴定的真菌优势菌属有异同点。相同的是在一些森林土壤真菌研究中,青霉属都为主要的优势菌属,但含有其他不同的优势真菌属。如赵文静等[20]对额尔古纳国家级自然保护区内四种林型土壤真菌多样性研究发现,该地区土壤真菌孢霉属(Mortierella)和青霉属为各林型土壤真菌的优势菌属。孙璐等[21]研究长白山北坡森林土壤低温真菌的种群分布发现被孢霉属、毛霉属、青霉菌属和弯颈霉属为优势菌属。此外,董爱荣等[8]采用培养法发现在椴树红松林、枫桦红松林和红松人工林土壤真菌中被孢霉属、青霉属、木霉属及轮枝孢属为优势菌属。森林土壤真菌群落组成的差异,这既可能是分析鉴定方法的不同,也可能与不同土壤质地和植被类型相关。不同的森林类型由于植被组成不同、土壤养分[22-23]和土壤环境因子[13,23]存在差异,对森林土壤微生物群落产生影响[24-25],导致土壤微生物的群落结构发生变化[13,26]。本研究在四种林型土壤理化性质的测定结果中除两种原始红松林之间除水分含量和总孔隙度差异显著外,多数因子差异不显著,但其他林型之间多数土壤理化因子差异显著。
本研究四种林型土壤真菌α多样性指数分析表明,原始林(云冷杉红松林和椴树红松林)真菌群落丰富度指数(Ace和Chao1指数)高于成熟的红松人工林和红松天然次生林,该研究结果与其他以往的一些研究基本一致。如董爱荣等[8]采用稀释平板法和植物残渣法对小兴安岭凉水自然保护区椴树红松林、枫桦红松林、白桦林、人工落叶松林与人工红松林等林型的土壤真菌进行研究,发现土壤真菌同森林类型密切相关,椴树红松林和枫桦红松林土壤真菌数量和种类明显多于其他三种林型,这是由于椴树红松林和枫桦红松林林分结构复杂,红松占优势,阔叶树种类较多,林下乔灌木、藤本植物以及草本植物种类多,植物多样性远比其他三种林型高[7]。这是因为森林凋落物和土壤中真菌和细菌群落的组成在很大程度上是由优势树木决定的[27]。同样郭彦萃等[28]采用BIOLOG微平板法,研究发现小兴安岭凉水国家自然保护区内的原始阔叶红松林土壤微生物较原始针叶红松林及人工林土壤微生物具有更丰富的多样性。但本研究中红松人工林真菌的丰富度指数高于天然次生林,这与一些研究结果有所不同。如Nie等[29]在亚热带地区天然松林与人工林细菌和真菌群落比较中,天然松林真菌群落的Ace和Chao1指数高于人工松林。由于森林土壤真菌群落组成还与森林年龄[30]和发育阶段[31]有关,本研究中人工林选取的红松年龄都在60年以上,天然次生林中红松年龄在不足40年,这可能导致了人工林的丰富度指数高于次生林的原因。
林型不同、树种不同[32],土壤真菌所处的微环境[33]和可利用的凋落物资源的复杂程度也会不同[27],其真菌的群落结构也会有差异。植物通过影响土壤环境[34],进而影响土壤微生物的群落结构和多样性[13,26]。本研究在四种林型土壤优势真菌属与土壤理化因子的CCA分析结果中pH、水分含量、土壤总孔隙度、总有机碳和全氮5个理化因子对土壤真菌群落有显著性影响,其中全氮是影响四种林型土壤真菌群落的主要因子,其次为土壤总有机碳含量。这与优势真菌属与土壤理化因子的Spearman相关性分析结果中有所体现,土壤全氮含量与六个优势菌属显著相关(与红菇属、乳牛肝菌属和unclassified-f-Thelephoraceae的相对丰度显著正相关,而与马拉色氏霉菌属、青霉属和拟青霉属显著负相关。其次是有机碳含量与四个优势菌属显著相关(有机碳含量与红菇属、乳牛肝菌属和unclassified-f-Thelephoraceae的相对丰度呈显著正相关,与马拉色氏霉菌属显著负相关)。原始红松林物理性质保持了较好的原始状态,含水量较高,土壤通水透气状态良好,土壤肥力较高,为真菌的生长创造了良好条件。如原始红松林土壤中总有机碳、全氮显著高于红松天然次生林,同时影响微生物活性的总孔隙度和土壤水分含量也显著高于红松天然次生林。这可能也揭示了四种林型土壤真菌PCoA和ANOSIM分析结果:两种原始红松林的土壤真菌群落组成相近,差异不显著,但原始林与人工林和天然次生林型之间差异显著。本研究获得的四种林型红松林土壤真菌群落组成和多样性特征,将为原始红松林的保护和人工恢复提供依据,同时优势真菌属与土壤土壤理化因子的相关性分析结果具有一定的实践意义,这将为红松林土壤真菌资源的开发利用提供依据。此另外在四种林型中检测出大量未被鉴定的真菌ITS序列,这些序列还需要进一步的鉴定分析。
4 结 论
四种林型红松林土壤真菌群落优势菌为子囊菌门和担子菌门。在考虑真菌物种丰度和系统发育进化距离的情况下,四种林型红松林土壤真菌群落组成差异显著,但两种原始红松林和红松人工林与天然次生林之间群落组成无显著差异。原始红松林土壤理化性质优于红松人工林和红松天然次生林,导致土壤真菌群落丰富度高于红松人工林和红松天然次生林,其中土壤全氮、总有机碳、pH、水分含量和总孔隙度是显著影响四种林型土壤真菌群落组成的环境因子。

