高产2-苯乙醇酵母的筛选及其发酵条件优化
郭孝敬,郑晓吉,史学伟,王斌,陈欢,黄倩,徐振丽
(石河子大学 食品学院,新疆 石河子 832000)
苯乙醇(2-phenylethanol)是一种具有淡雅、细腻柔和玫瑰香型的高级芳香醇,对氧和碱的作用都比较稳定。天然存在于植物的叶、茎及玫瑰精油中,是多种香料风味的基础组分,具有协同增效的作用,其衍生物乙酸苯乙酯也是玫瑰香型主要成分[1],被广泛应用于乳制品和调味品的生产等领域,如是奶酪、谷氨酸发酵、醋和酱油发酵中悦人的重要风味组分[2-4],也是被国内外所认可的食品添加剂[5,6]。而以其为底物合成的苯乙醇苷具有抗肿瘤、抗病毒、抗菌和强心等作用[7]。2-苯乙醇无论作为调味品还是在医药领域都具有重要的研究价值。
目前市场上2-苯乙醇主要以苯、甲苯和苯乙烯为原料通过化学法合成,合成过程中产生的一些副产物具有致癌作用且难以去除,食用级别高纯度2-苯乙醇难以获得[8,9]。而天然和化学合成2-苯乙醇价格上的差距促使人们探寻天然合成2-苯乙醇的途径[10]。从植物中萃取2-苯乙醇工序繁琐、价格昂贵且受季节限制。根据相关法律规定,微生物以天然的前体转化合成的物质为天然产物[11]。随着微生物学的深入研究,越来越多的人关注研究微生物转化合成天然2-苯乙醇[12,13]。自然界中多种酵母能够通过艾氏途径转化L-苯丙氨酸合成2-苯乙醇的能力[14],例如:2017年酿酒酵母 AS2.516 通过紫外诱变筛选出一株2-苯乙醇浓度达3.55 g/L的菌株[15];2018年牛明福等筛选得到一株马克斯克鲁维酵母2-苯乙醇浓度达1.45 g/L的菌株[16];2019年富志磊等从酒曲中筛选得到一株耐高温季也蒙毕赤酵母合成2-苯乙醇浓度为1.66 g/L等[17]。
酵母菌生物转化合成2-苯乙醇产物抑制是目前生物转化合成2-苯乙醇的瓶颈[18],而2-苯乙醇和乙醇协同对酵母细胞的毒性大于其单个存在对细胞毒性的累加[19]。而筛选高耐受性且高产的菌株是从源头上解决问题的途径之一。本试验从奶酪中分离纯化酵母菌,通过菌株对2-苯乙醇的耐受性及转化合成2-苯乙醇的能力进行研究,以期筛选出一株耐受性强转化合成2-苯乙醇的能力高酵母,为其在发酵食品中的应用及提纯行业提供了菌株来源。
1 材料与方法
1.1 试验材料
1.1.1 奶酪样品
取自新疆哈密市巴里坤哈萨克自治县农户家的自制手工奶酪。
1.1.2 主要试剂
L-苯丙氨酸(BR)和2-苯乙醇标准品(GC≥99%):上海源叶生物科技有限公司;甲醇(GR):赛默飞世尔科技有限公司;葡萄糖(AR):北京奥博星生物技术有限责任公司。
1.1.3 主要仪器
LC-2010AHT型高效液相色谱仪 日本岛津公司;ZWYR-D2403型恒温培养振荡器 上海智城分析仪器制造有限公司;X7型多功能酶标仪 基因有限公司。
1.1.4 固体培养基
蛋白胨20 g/L、酵母膏10 g/L、葡萄糖20 g/L、琼脂20 g/L,121 ℃灭菌20 min。
1.1.5 种子培养基
蛋白胨20 g/L、葡萄糖20 g/L、酵母膏10 g/L,121 ℃灭菌20 min。
1.1.6 转化培养基
葡萄糖35 g/L、酵母浸粉1.8 g/L、L-苯丙氨酸7 g/L、MgSO4·7H2O 0.5 g/L、KH2PO45 g/L、pH 5.0,11 ℃灭菌20 min。
1.2 试验方法
1.2.1 酵母菌的分离
参考Wolfe等的方法[20],于无菌的条件下用灭过菌的工具从凝乳的奶酪表面取10 g样品。将样品放入含50 mL 0.9% NaCl溶液的灭菌管中,在振荡器上20 ℃下振荡30 min。在无菌的环境中将样品梯度稀释,每个稀释梯度3个平行,移取100 μL于含有200 mg/L氯霉素的YPD固体培养基上用涂布棒涂布均匀,在28 ℃培养2 d[21],从YPD平板上分离不同形态的酵母菌落纯化3次,置于含20%甘油的甘油管中于-80 ℃低温冰箱保存。
1.2.2 目标菌株的选择
据报道,酵母对2-苯乙醇的耐受性越好,其转化L-苯丙氨酸合成2-苯乙醇的能力越强[22]。从分离纯化冻藏的酵母菌甘油管中分别吸取100 μL于固体平板涂布均匀,置于30 ℃恒温培养箱中培养24 h。挑取单菌落于灭过菌冷却至室温含10 mL液体的培养基试管中,于30 ℃,100 r/min 恒温摇床中培养24 h,复接试管培养至对数期。通过生理盐水和血球计数板制备成同一浓度菌液。分别吸取等量菌液于含0,1,2,3,4,5 g/L的2-苯乙醇固体平板中,每个菌株3个平行,于恒温培养箱中培养36 h后观察。
耐受2 g/L及以上的2-苯乙醇酵母菌株,同上制备成同一浓度菌液,分别接种等量菌液于灭过菌冷却至室温含0,1,2,3,4,5 g/L 2-苯乙醇50 mL液体培养基的250 mL锥形瓶中,每个菌株3个平行。于30 ℃,240 r/min恒温摇床培养36 h,每隔8 h取样,以保存在4 ℃冰箱的接种后分别移取含有不同浓度2-苯乙醇的液体培养基为空白参比,用酶标仪测定OD660值 。
1.2.3 酵母菌的鉴定
筛选获得的高产2-苯乙醇耐受性菌株,以提取其基因组DNA为模板,使用引物NL1(NL15′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-TCCTCCGTCTATTGATATGC-3′)扩增26S rDNA基因的D1/D2结构域。PCR扩增条件:于95 ℃初始变性5 min;94 ℃ 40 s,55 ℃ 40 s,72 ℃ 300 s,36个循环;72 ℃延伸10 min。 扩增产物于1.2% (W/V)琼脂糖凝胶中进行电泳分离。使用Applied Bio Systems DNA Sequencer,mod获得序列。通过比较GenBank数据库中的序列(来自http://www.ncbi.nlm.nih.gov/BLAST的BLASTN免费软件)来鉴定菌株。
1.2.4 2-苯乙醇和乙醇能力的测定
由于2-苯乙醇和乙醇协同对酵母细胞的毒性大于其单个存在对细胞毒性的累加,考察了菌株产2-苯乙醇和乙醇的能力。从固体平板上挑取单菌落接入灭过菌的含50 mL液体培养基的250 mL锥形瓶中,在30 ℃,240 r/min条件下摇床培养24 h,复接锥形瓶后培养至对数期。用血球计数板计数计算菌液浓度,并按需要的接种量接入转化培养基中,于30 ℃,240 r/min 恒温摇床培养36 h后测定2-苯乙醇和乙醇的含量。
取6 mL转化液于4 ℃,6000 r/min下离心10 min后,吸取上清液经0.45 μm过滤器过滤后进行液相分析。2-苯乙醇含量测定的色谱条件: Agilent C18柱(4.6 mm×250 mm);柱温30 ℃;等梯度洗脱:甲醇∶超纯水(60∶40);流速1 mL/min,进样量20 μL,检测波长260 nm。
参照重铬酸钾-DNS比色法测定发酵液中乙醇含量[23]。
1.2.5 乙醇和2-苯乙醇对酵母菌生长的抑制
向液体培养基中加入一定量乙醇和2-苯乙醇,控制乙醇的浓度分别为0,50,100,150 mL/L,2-苯乙醇的浓度分别为0,1,2,3,4,5 g/L。在含有不同浓度乙醇和2-苯乙醇的转化培养基中接入等量同一浓度的菌悬液,各自取少量置于冰箱做空白参比。于30 ℃,240 r/min 恒温摇床培养6 h后,用酶标仪在660 nm处测定OD增长量。
1.2.6 酵母产2-苯乙醇培养基组分的优化
为最大限度提高酵母菌株产2-苯乙醇的量,考察培养基组分对转化合成2-苯乙醇量的影响。L-苯丙氨酸:1.5,2.5,3.5,4.5,5.5,6.5,7.5,8.5,9.5,10.5,11.5 g/L;葡萄糖:60,70,80,90,100,110,120 g/L;酵母浸粉:0.2,0.4,0.6,0.8,1.0,1.2 g/L;温度:24,27,30,33,36,39 ℃。以上均在240 r/min,30 ℃恒温摇床培养36 h,经高效液相色谱测定2-苯乙醇。采用Design Expert 8.0软件进行响应面试验设计和分析。
2 试验结果
2.1 目标菌株的选择
据报道,酵母对2-苯乙醇的耐受性越好,其转化L-苯丙氨酸合成2-苯乙醇的能力越强。为得到产量较高的出发菌株,对从奶酪中分离纯化的30株酵母菌进行2-苯乙醇固体耐受性的考察和比较,筛选出相对高耐受性的酵母菌株,再对2-苯乙醇液体的耐受性及转化产2-苯乙醇的能力进行考察和比较,选出其中转化能力和抗性最强的酵母菌株。
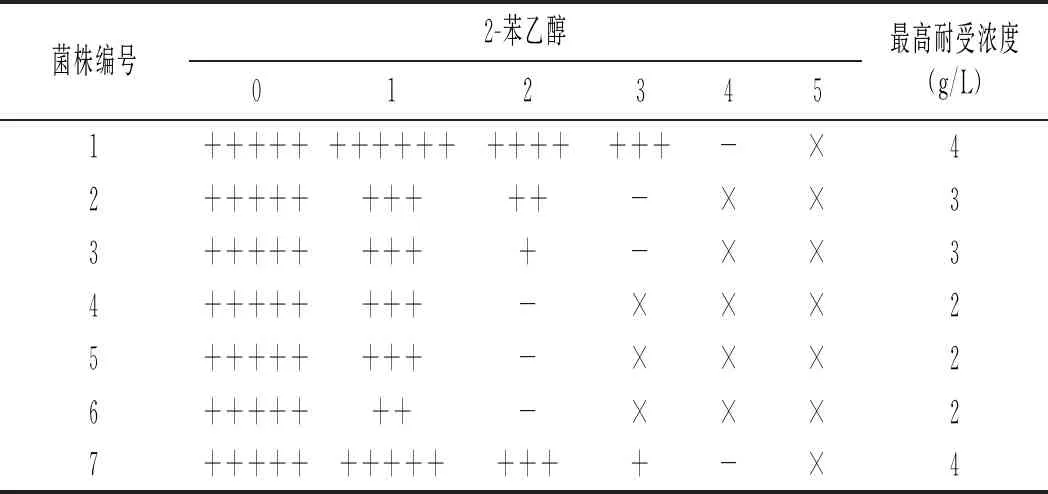
表1 耐受2 g/L及以上2-苯乙醇酵母固体平板生长情况
注:2-苯乙醇浓度单位为g/L,+代表菌株生长状况,-代表菌株耐受极限,×代表完全不生长。上表为菌株生长2 d的情况。
通过固体耐受性试验筛选得到7株能耐受2 g/L及以上2-苯乙醇浓度的菌株,由表1可知,菌株对2-苯乙醇的耐受性有较大差异。7株菌都能于1 g/L 2-苯乙醇固体培养基上生长,1号菌株生长明显优于对照菌株,可能少量2-苯乙醇促进了菌株的修复功能,更加刺激了菌株的生长。1号和7号菌株于2 g/L 2-苯乙醇固体培养基中生长良好,而2号和3号菌株生长明显受到抑制,4,5,6号菌株生长显著受到抑制。7号菌株于3 g/L 2-苯乙醇固体培养基中的生长明显受到抑制,而2号和3号菌株的生长完全受到抑制。
由表1可知,仅有1号和7号菌株能于4 g/L 2-苯乙醇固体培养基中生长。没有菌株能耐受5 g/L 2-苯乙醇。
2-苯乙醇标准品经高效液相色谱检测出峰时间约在7.5 min,目标菌株发酵合成2-苯乙醇液相色谱图见图1。
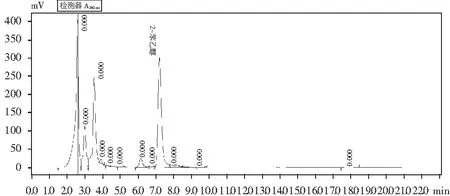
图1 菌株1转化液2-苯乙醇HPLC图谱
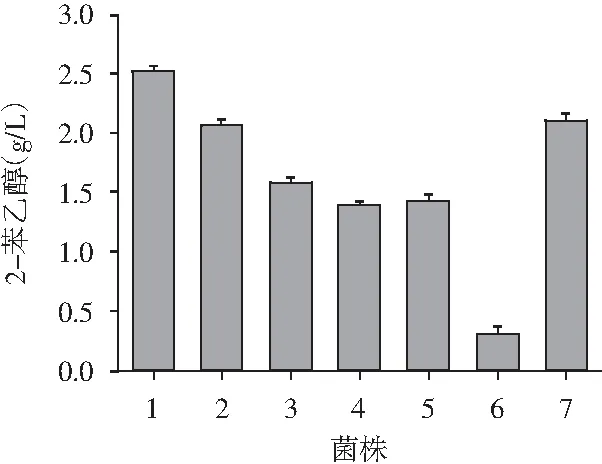
图2 菌株转化合成2-苯乙醇
由图2可知,菌株1转化合成2-苯乙醇浓度达2.51 g/L,明显高于其他菌株,其次7号菌株合成2-苯乙醇浓度为2.06 g/L。
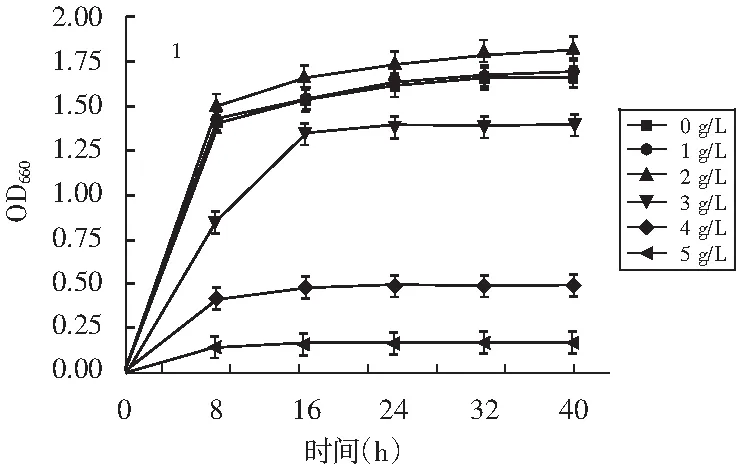

图3 菌株对2-苯乙醇液体耐受性
由图3可知,转化培养基中2-苯乙醇浓度大于3 g/L时,酵母菌株生长明显受到抑制,达到5 g/L时,生长基本完全受到抑制。转化培养基中2-苯乙醇浓度为3 g/L时,1,7号菌株分别抑制16.3%和22.8%细胞生长。2-苯乙醇浓度达4 g/L时,1,7号菌株分别有29.5%和21.1%细胞生长,通过固体和液体耐受性比较可以看出,1号菌株对2-苯乙醇的耐受性最好,2号菌株次之。因此,选择对2-苯乙醇耐受最强、转化合成能力最高的1号菌株作为后序试验的目标菌株。
2.2 菌株鉴定

图4 基于1号菌株26S rDNA基因构建的系统发育树
将PCR扩增产物送检获得的基因序列于GeneBank进行Blast比对,从中选择序列相似度最相近的参比菌株,使用MEGA 6.0软件构建系统发育树,由图4可知,该菌株经比对为库德里阿兹威氏毕赤酵母(Pichiakudriavzevii)。
2.3 目标菌株单因素优化
以L-苯丙氨酸为主要碳源转化合成2-苯乙醇的艾氏途径,是酵母转化合成2-苯乙醇的主要来源。适当的葡萄糖供给菌株充足的能量,避免产生过多乙醇与2-苯乙醇协同抑制细胞生长。适量的酵母浸粉能为细胞生长提供所需微量元素和维生素。合适的温度能保证转化合成2-苯乙醇所需酶的活力,促进菌株生长代谢和转化产物的合成。因此,考察了葡萄糖、L-苯丙氨酸、酵母浸粉和温度对转化合成2-苯乙醇的影响,试验结果见图5。
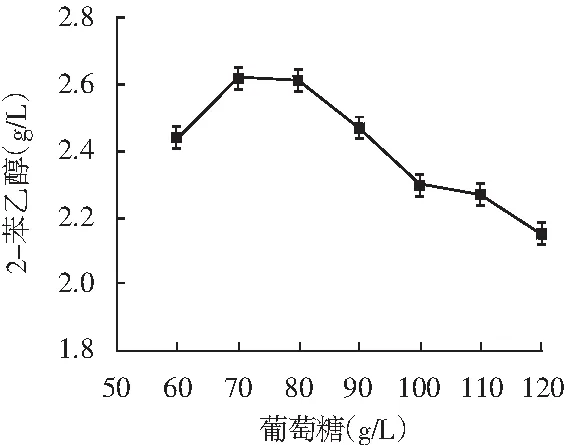
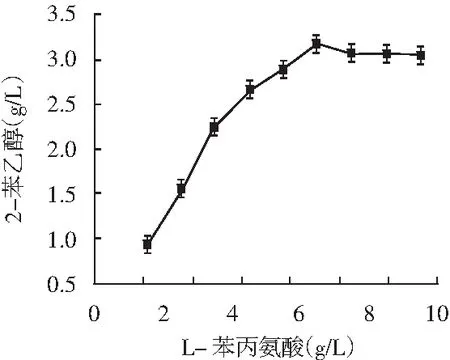
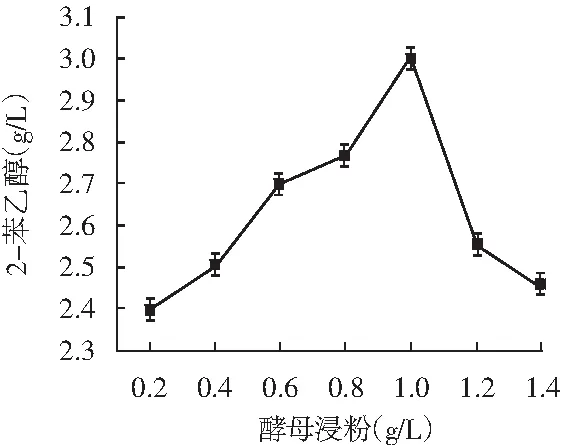
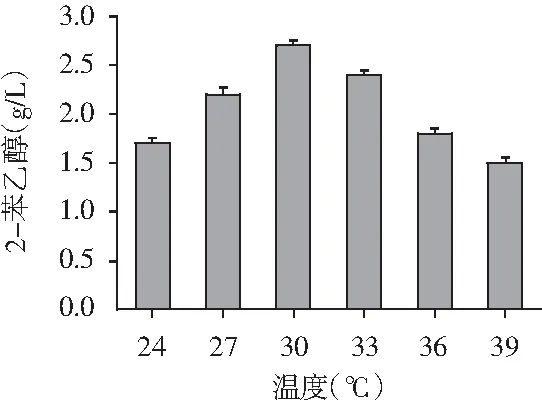
图5 葡萄糖、L-苯丙氨酸、酵母浸粉和温度对菌株1转化合成2-苯乙醇的影响
由图5可知,葡萄糖浓度为70 g/L,L-苯丙氨酸浓度为6.5 g/L,酵母浸粉为1 g/L,温度为30 ℃时,2-苯乙醇产量最高分别达2.62,3.17,3,2.7 g/L。通过单因素优化,2-苯乙醇的产量从最初的2.51 g/L提升了0.66 g/L,达3.17 g/L。菌株于39 ℃仍能转化合成1.5 g/L 2-苯乙醇,可见是一株耐热性菌株。
2.4 响应面试验设计及结果分析
2.4.1 响应面分析试验设计方案
在单因素试验的基础上,采用Box-Behnken中心组合设计,以对合成2-苯乙醇具有显著影响的葡萄糖、L-苯丙氨酸和酵母浸粉为自变量,以2-苯乙醇浓度为因变量设计三因素三水平响应面分析试验。试验因素与水平的选取见表2,响应面的试验设计及试验结果见表3。

表2 中心组合设计因素和水平
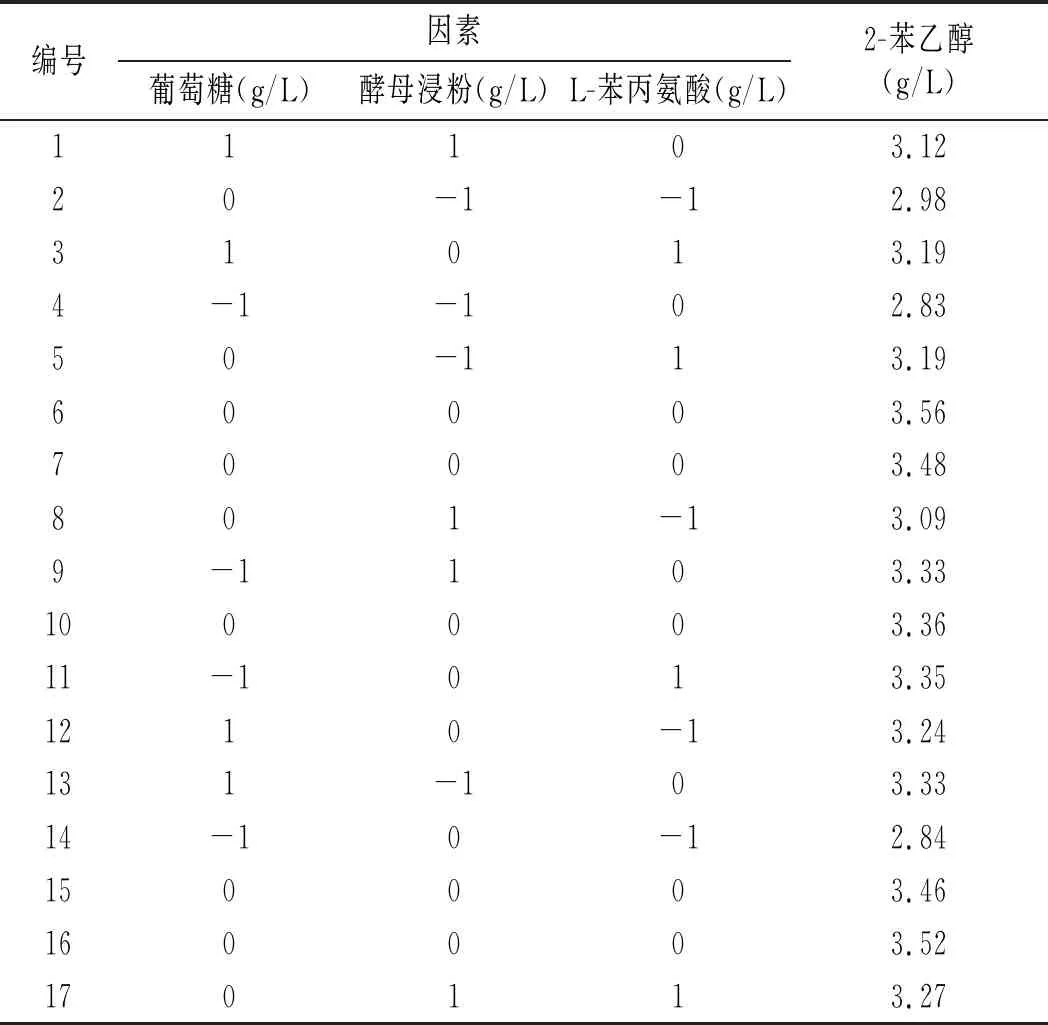
表3 Box-Behnken试验设计及结果
2.4.2 响应面模型的建立及方差分析
采用Design Expert 8.0软件对试验所得数据进行二次多项回归拟合,得2-苯乙醇(Y)的二次回归方程:Y=3.47349+0.067283X1+0.060664X2+0.10466X3-0.17582X1X2-0.13960X1X3-7.57000E-003X2X3-0.15023X12-0.17329X22-0.16861X32。
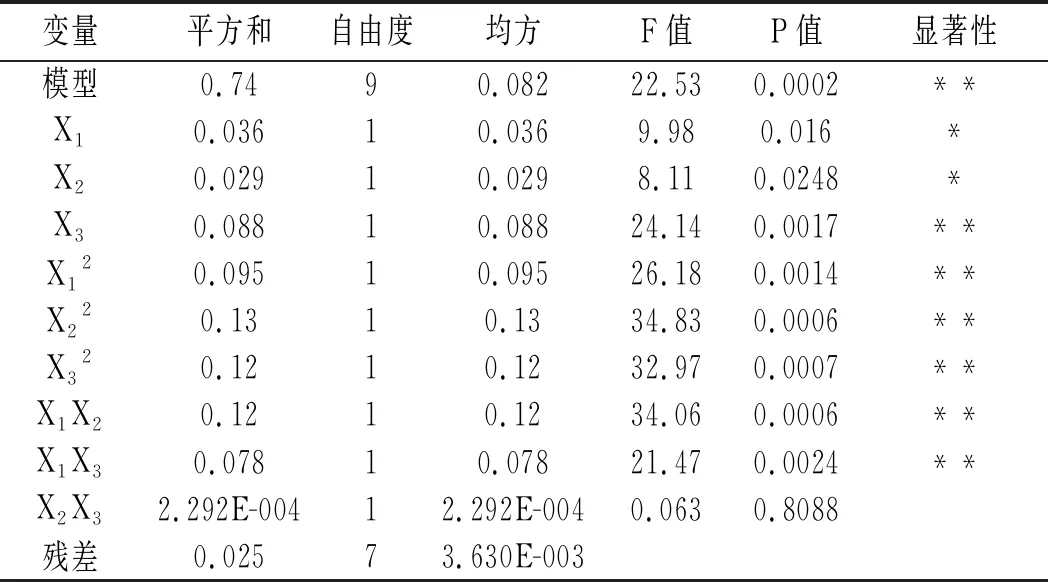
表4 回归方差分析及显著性检验

续 表
注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01);R2=96.66%,RAdj2=92.37%。
由表4可知,该模型P<0.01差异极显著,R2=0.9666,因素间交互作用存在显著性差异。失拟项P=0.9573,不显著,该模型调整后RAdj2=92.37%,表明该模型能解释92.37%关键因子对菌株转化合成2-苯乙醇的影响,可用其确定转化合成2-苯乙醇的最佳工艺。
由表4各因素的P值可知,该回归方程一次项X1和X2的P<0.05,差异显著,X3的P<0.01,差异极显著,3个因素对转化合成2-苯乙醇的影响顺序为L-苯丙氨酸(X3)>葡萄糖(X1)>酵母浸粉(X2)。二次项X12、X22、X32、交互相X1X2和X1X3的P值均小于0.01,表明差异极显著。
2.4.3 各因素交互作用的影响
回归方程可用响应面图描述,能够直观反映各因素对响应值的影响及各因素间交互作用的类型。由图6和图7可知,葡萄糖、酵母浸粉和L-苯丙氨酸对1号菌株转化合成2-苯乙醇的影响,并不是简单的线性关系,具有交互作用。
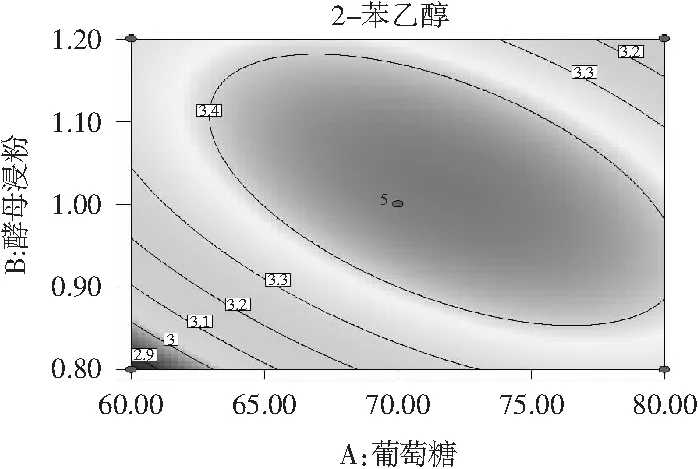
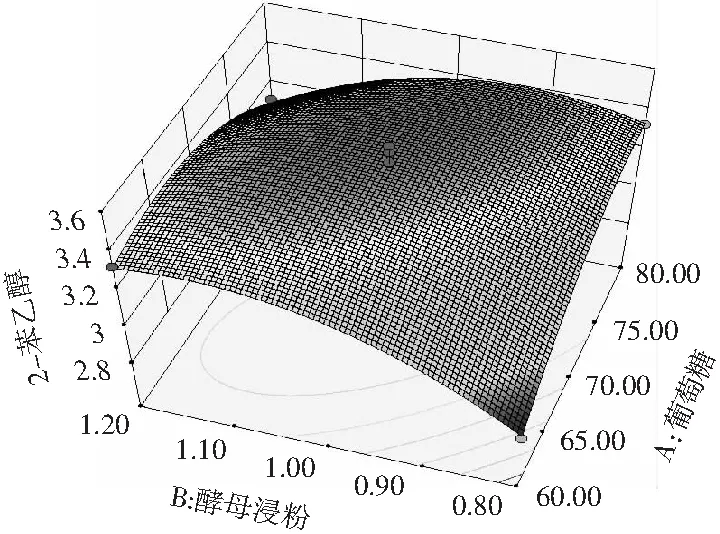
图6 酵母浸粉和葡萄糖交互作用对菌株1转化合成2-苯乙醇的影响
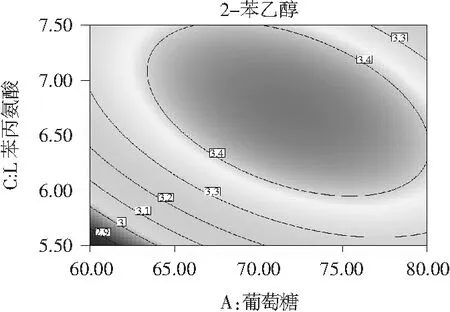
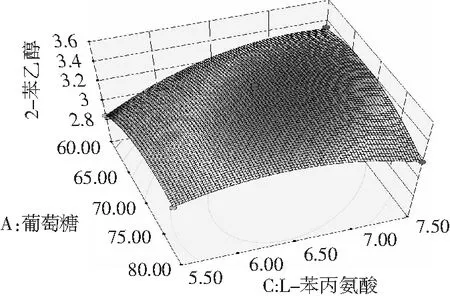
图7 葡萄糖和L-苯丙氨酸交互作用对菌株1转化合成2-苯乙醇的影响
由图6和图7可知,葡萄糖和酵母浸粉及葡萄糖和L-苯丙氨酸交互作用响应面图呈抛物面形,等高线呈扁平的椭圆形表示两者都有较强的交互作用。而酵母浸粉和L-苯丙氨酸有交互作用响应面呈圆滑形,等高线呈圆形,表示交互作用不明显[24,25],故没有陈列。结合表4的结果,交互项X1X2和X1X3试验结果显著性分析 P值均小于0.01,表明交互作用极显著;而X2X3的P>0.05,表明交互作用不显著,与图6和图7的结果一致。
上述回归模型响应面的最高点即为最佳值,等高线的圆心,也是菌株转化合成2-苯乙醇最大值稳定点,与其对应的因素水平即为最优工艺条件。采用Design Expert 8.0软件计算得出1号菌株转化合成2-苯乙醇的最佳条件为:葡萄糖80 g/L、酵母浸粉1.2 g/L、L-苯丙氨酸7.5 g/L,在此优化条件下,2-苯乙醇的理论值为3.47 g/L。通过试验验证1号菌株产2-苯乙醇与理论值贴近,达3.53 g/L,相比未优化前产2.51 g/L 2-苯乙醇,提升了40.64% 2-苯乙醇的量,表明该模型有效。
2.5 乙醇和2-苯乙醇对菌株的抑制
因酵母发酵的副产物乙醇与2-苯乙醇协同对细胞的抑制作用比各自单独存在抑制作用更强,且对菌株造成不可逆的影响。考察了2-苯乙醇和乙醇协同对1号菌株的抑制作用,见图8。

图8 乙醇和2-苯乙醇协同对菌株的抑制
于优化后培养基中培养,培养条件同上,乙醇浓度经测定为18.86 mL/L。由图8可知,无2-苯乙醇条件下,乙醇浓度大于50 mL/L时严重抑制了菌株的生长,大于75 mL/L时,几乎完全抑制菌株生长;无乙醇条件下,2-苯乙醇浓度为4 g/L时,仍有29.81%菌株生长。随2-苯乙醇浓度递增,乙醇浓度为25 mL/L的细胞生长趋势较弱于乙醇浓度为0 mL/L的细胞生长趋势。而该菌株产的乙醇较小于25 mL/L,与2-苯乙醇协同抑制细胞生长的作用不明显。
3 结论
自然界中多种酵母具有合成2-苯乙醇的能力,不同种属酵母或同种酵母不同菌株转化合成2-苯乙醇的能力各有差异。据报道,酵母对2-苯乙醇的耐受性越好,其转化合成2-苯乙醇的能力越高。从奶酪中分离纯化的菌株,通过对2-苯乙醇固体耐受性初筛、液体耐受性复筛及高效液相色谱测定,获得一株耐受性高、转化合成2-苯乙醇能力强的菌株1,能于4 g/L的2-苯乙醇固体培养基中生长。通过单因素优化和响应面分析,确定其最优培养基组分:葡萄糖80 g/L、酵母浸粉1.2 g/L、L-苯丙氨酸7.5 g/L、磷酸二氢钾4 g/L和硫酸镁0.8 g/L。此条件下,30 ℃培养24 h菌株转化合成2-苯乙醇浓度达3.53 g/L;于39 ℃仍能合成1.5 g/L的2-苯乙醇。该菌株产生的乙醇和2-苯乙醇协同对细胞生长抑制作用不明显,可忽略不计。经分子生物学鉴定为库德里阿兹威氏毕赤酵母。为后续转化合成2-苯乙醇的研究奠定了基础,为应用生产天然2-苯乙醇提供了菌株来源。

