一种鸡肉中四环素类兽药残留高效液相色谱检测方法的建立
王余磊,舒相华,张 雪,高云梅,杨 崑,张雅靖,吕 涛,宋春莲
(云南农业大学 动物医学院,云南 昆明 650201)
近年来,抗生素在医疗和畜禽养殖业中的大量使用所导致的环境污染问题日趋严重。每年我国生产的21万t的抗生素中9.7万t的抗生素都流向了畜禽养殖场,大约占到了年产量的46.1%,而这巨大的使用量中90%的抗生素都是作为了动物饲料的添加剂而被消耗掉,致使动物的抗生素滥用现象十分严重,出现了大量的耐药菌株,为畜禽养殖业的发展埋下了隐患的同时也为人类的生命健康带来了威胁[1]。
四环素类抗生素(tetracyclineantibiotics,TCs)是由放线菌产生的一类广谱抗生素,包括土霉素(Oxytetracycline,OTC)、四环素(Tetracycline,TC)和金霉素(Chlortetracycline,CTC)等。四环素类抗生素由于价格低廉,大量使用于许多疾病的预防与促进动物的生长,提高畜禽生产效率。但是禽畜组织中四环素类抗生素的残留会影响食用者的健康,还会造成环境中四环素类抗生素的残留,从而间接或直接进入人体,增加人体的耐药性,给人类公共健康带来威胁[2]。为了保护环境和人类健康,国际食品法典委员会(CAC)制定了动物组织及产品中兽药残留的最高残留限量(MRLVDs)的规定,用以保障公众健康和各国正常进出口贸易。我国也制定了国家标准规定四环素类抗生素的添加限量,所有食用性动物肌肉组织中土霉素、四环素和金霉素的单个或复合物含量不得超过0.1 mg·kg-1。
兽药残留检测方法目前主要有金标检测法、酶联免疫吸附法、高效液相色谱-紫外检测法[3]、气相色谱法和质谱法[4]等。四环素类抗生素最常用的化学检测方法主要有高效液相色谱法[5]和高效液相质谱联用法。本研究在传统方法的基础上,建立了一种高效液相色谱法快速检测鸡肉组织中土霉素类药物残留的方法,为临床快速准确检测提供依据。
1 材料与方法
1.1 试验材料
检测方法验证鸡4羽;2个合作社饲养的乌骨鸡各6羽。
1.2 主要试剂与仪器
主要试剂有乙腈(色谱级)、甲醇(色谱级)美国天地有限公司;甲醇(分析纯)重庆川东化工(集团)有限公司;正己烷(分析纯)天津市风船化学试剂科技有限公司;土霉素对照品、四环素对照品、金霉素对照品北京索莱宝科技有限公司。
高效液相色谱仪岛津LC-2030(配紫外检测器);色谱柱C18 4.6×150 mm,5μm;氮吹仪HSC-24A天津市恒奥科技发展有限公司。
1.3 试验方法
1.3.1 色谱条件 色谱柱为C18(4.6×150 mm,5μm)。以0.01 mol·L-1磷酸二氢钠溶液-乙腈=81∶19(体积比)为流动相。检测波长为350 nm,柱温为40℃,流速为1.0 ml·min-1,进样量为10 ul。
1.3.2 溶液的制备 分别称取OTC、TC、CTC对照品各10 mg,置于三个10 ml的棕色容量瓶中,然后用甲醇溶液溶解并定容到10 ml,制备得到的OTC、TC、CTC标准溶液浓度为1 mg·ml-1。
混合标准溶液。称取土霉素、四环素、盐酸金霉素对照品各约100 mg,置于10 ml棕色容量瓶中,用甲醇溶解并定容至刻度线得到10 mg·ml-1的标准溶液。用移液枪精密吸取上述标准溶液0.1 ml,分别置100、50、25、10、5 ml量瓶中,加甲醇稀释至刻度线,摇匀。得到浓度分别为0.01、0.02、0.04、0.1和0.2 mg·ml-1的标准溶液。所有的标准溶液都放置与4~6℃冰箱保存备用。
1.3.3 样品前处理 将组织剪碎称取5 g,置于50 ml离心管中,加入25 ml甲醇,超声5 min。8000 r·min-1,匀浆提取1 min。4 000 r·min-1离心15 min,将上清液移置150 ml的分液漏斗中。加入25 ml甲醇饱和的正己烷溶液,手动振摇2 min,静置分层。取下层溶液20 ml,置于25 ml的旋蒸瓶中,41℃水浴减压蒸干,加入1 ml5%的高氯酸,涡旋1 min,移至1.5 ml离心管中,10 000r·min-1离心15 min,将上清液吸出过0.45μm滤膜,将滤液作为试样溶液待测。
出峰顺序与时间的确定将配制好的1 mg·ml-1土霉素、四环素和金霉素三个标准溶液经0.45μm滤膜过滤后,放入高效液相色谱仪进行检测,每个样品重复进样6次,取平均值。
标准曲线的制定称取9份已剪碎的样品各5 ±0.01g,放入50 ml离心管中。分别加入50 ul不同浓度的混合标准溶液,浓度分别为0.02、0.04、0.1、0.2、0.3、0.4、0.5、1、2 mg·ml-1,配制成相对于样品浓度为0.2、0.4、1、2、3、4、5、10、20μg·g-1,按照样品前处理方法进行操作。绘制土霉素、四环素和金霉素三种四环素类抗生素的标准曲线。
取3份已经剪碎的空白样品各5±0.01 g,按照 0.3 mg·ml-1、0.4mg·ml-1和 0.5mg·ml-1添加量添加三种标准品,每个样品平行测定3次,计算样品的加标回收率。
2 结果与分析
2.1 一种高效液相色谱检测鸡肉中土霉素类抗生素方法
2.1.1 出峰顺序与时间
如图一所示:根据6次重复进样得出平均出峰时间,土霉3.65min,四环素4.41 min,金霉素9.62 min。土霉素、四环素、金霉素依次出峰且分离度良好。

图1 混合标准品出峰顺序和时间
2.1.2 标准曲线及线性范围
在1.3.1色谱条件下进样,已标准溶液浓度为横坐标,峰面积为纵坐标,绘制标准曲线。回归方程、相关系数及线性范围见表1,表明三种抗生素在各自的范围内线性关系较好。

表1 土霉素、四环素和金霉素的标准曲线
2.1.3 方法检出限
按照样品前处理的方法进行操作,经过HPLC分析,得到土霉素、四环素的方法检出限为20μg·kg-1,金霉素的方法检出限为100μg·kg-1。
2.1.4 变异系数与添加回收率试验
由表2显示,三个空白样品在三个不同浓度下的回收率范围为84.33%~107%,回收率良好。
2.1.5 实验组土霉素测定结果
将实验组阳性对照和空白对照进行检测,每个样品平行测定三次,结果见表3,相关色谱图见图2。

图2 A为土霉素阳性对照,B为空白对照
由表3可知,土霉素阳性对照组的胸肌和腿肌样品检测结果都超出兽药最高残留限量3~8倍,远远超过我国MRLVDs的规定(0.1mg·kg-1),空白对照组未检出残留。证明本方法成立。

表2 添加回收率与变异系数
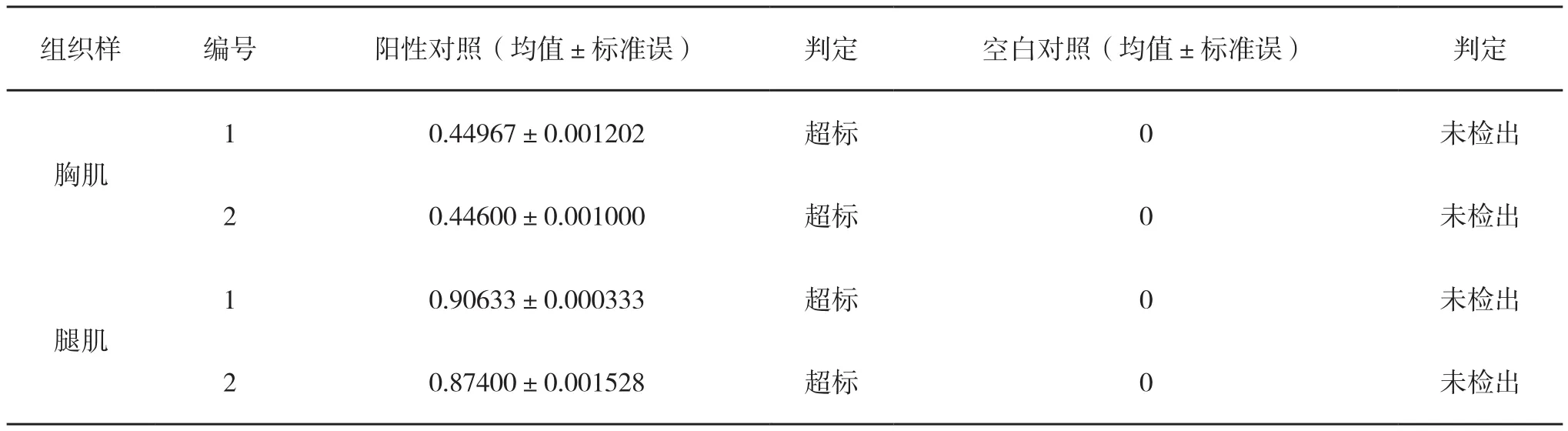
表3 土霉素阳性对照检测结果
2.2 鸡场样品测定与分析
采用1.3.3方法处理待测样品,用1.3.1色谱条件进行检测分析,色谱图见图3。检测结果表明所有样品都未检测出土霉素、四环素和金霉素兽药残留。

图3 C为待测样品
3 讨论
3.1 提取方法的选择
本研究样品处理方法和GB/T20764—2006[6]方法有很大改进,本方法使用的是甲醇-正己烷-高氯酸组合提取法,此方法操作重现性好,便于批量处理。GB/T20764—2006所使用的萃取柱提取方法,这种提取方法虽然操作简单,重现性差,并且成本高,不利于批量处理。而本方法尚有不足之处,样品前处理步骤复杂,相对于固相萃取柱提取法耗时较长,因此,以后仍需要改进。
3.2 流动相选择
以 78:22、81:19 和 85:15(V:V)进行了实验 ,结果表明流动相为 81:19(V:V)的比例分离效果较好; 随后又考察了0.8 ml/min 和 1.0 ml/min 的流速, 最终确定本实验流速为 1ml/min。在此色谱条件下, 试样中土霉素、四环素、金霉素均得到较好的分离,与高广慧[7]结果一致。
3.3 波长的选择
土霉素、四环素、金霉素在265 nm和350 nm两个波长处都有较好的吸收峰[8],而在265 nm波长下,吸收强度好,与鲍会梅所得结果相符合,但色谱图的基线不如前者平稳,综合考量,选择350 nm为检测波长。
4 结论
本研究建立了高效液相色谱测定鸡肉中土霉素、四环素、金霉素、药物残留的方法,采用甲醇-正己烷-高氯酸组合提取法,建立了鸡肉样品提取、净化、浓缩的前处理方法,并优化了高效液相色谱条件,可同时测定鸡肉中上述3种四环素类药物残留,该法简便、准确,可用于该类兽药的残留监控。
从待测样品的检测结果来看,此农户家养殖的鸡土霉素、四环素和金霉素的阳性检出率为零。

