和胃降逆方对非糜烂性反流病大鼠食管黏膜组织中肥大细胞类胰蛋白酶及相关因子表达的影响
刘佳丽,寇富舜,石 磊,王允亮,谭 祥,李晓红,丁庞华,谢春娥,李军祥
(1.北京中医药大学研究生院,北京 100029;2.北京中医药大学东方医院消化内科,北京 100078)
非糜烂性反流病(non-erosive reflux disease,NERD)是常见的功能性消化系统疾病,临床多存在反流、胃灼热、胸痛或腹胀等典型的胃食管反流症状,亦有食管以外组织损伤而引起的咳喘等症状,发病率逐年上升[1],严重影响患者的身心健康。NERD的发病机制尚不十分明确,研究发现,食管高敏感在NERD的发病中起着重要作用[2]。本课题组前期研究发现,平调寒热的和胃降逆方在改善NERD 患者整体症状方面优于奥美拉唑,且未见明显不良反应[3-4]。研究表明,消化系统出现功能异常时,活化的肥大细胞脱颗粒引起的致敏机制可特异性激活蛋白激酶2(protein kinase receptor 2,PAR2),促使机体释放P 物质(substance P,SP)、降钙素基因相关肽(calcitonin gene related peptide,CGRP)等神经肽类物质,诱导消化系统的内脏伤害性感受器产生继发性过敏,从而增加消化系统的内脏高敏感状态[5]。因此,本研究通过构建内脏高敏感性NERD大鼠模型,观察和胃降逆方对其血清SP、CGRP、PAR2及食管黏膜组织中肥大细胞类胰蛋白酶(mast cell tryptase,MCT)表达的影响,并探讨该方的最佳剂型及剂量。
1 材料与方法
1.1 实验动物无特定病原体级雄性Sprague Dawley(SD)大鼠48只,体质量250~280 g,由斯贝福(北京)实验动物科技有限公司提供,许可证号:SCXK(京) 2016-0002。室温22~24 ℃、相对湿度50%~60%和 12 h昼夜循环标准实验室条件下分笼饲养,常规饲料,自由饮水,适应环境1周。
1.2 药物和胃降逆方药物组成:黄芩9 g、黄连6 g、干姜9 g、清半夏9 g、浙贝母9 g、蒲公英9 g、龙胆草9 g、枳实9 g、全瓜蒌9 g、炙甘草3 g,药材购自北京同仁堂有限责任公司,水煎剂和颗粒剂由北京中医药大学中药学院根据相应的加工工艺由上述药材加工制成。配方颗粒剂购自北京康仁堂药业有限公司。奥美拉唑肠溶片购自山东新时代药业有限公司(国药准字H20044871)。
1.3 主要试剂与仪器卵清蛋白、40 g·L-1多聚甲醛购自北京索莱宝科技有限公司,氢氧化铝佐剂购自美国Sigma公司,水合氯醛购自北京酷来搏科技有限公司,MC Tryptase购自美国OmnimAbs公司,9.79 mol·L-1过氧化氢购自北京华腾化工有限公司,非免疫山羊血清、生物素标记山羊抗小鼠IgG抗体、辣根过氧化酶标记链霉亲和素、苏木精染色液、免疫组织化学染色试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购自北京鼎国昌盛生物技术有限责任公司,SP、CGRP、PAR2酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自武汉华美生物工程有限公司;灌注泵购自保定兰格恒流泵有限公司,离心机购自德国Eppendorf公司,电热恒温培养箱购自黄石市恒丰医疗器械有限公司,病理石蜡包埋机购自沈阳龙首电子仪器有限公司,石蜡切片机购自北京弘泰嘉业有限公司,显微镜、摄像装置、成像软件系统购自香港麦克奥迪公司,自动洗板机购自北京拓普分析仪器有限公司,酶标仪购自美国Thermo公司。
1.4 动物分组及模型制备大鼠适应性喂养1周,采用随机数字表法将所有大鼠分为空白组、模型组、奥美拉唑组、和胃降逆方配方颗粒组(配方颗粒组)、和胃降逆水煎剂组(水煎剂组)及和胃降逆方颗粒剂高、中、低剂量组(颗粒剂高、中、低剂量组),每组6只。模型组、奥美拉唑组、配方颗粒组、水煎剂组及颗粒剂高、中、低剂量组大鼠参照杨敏等[6]的方法,腹腔注射卵清蛋白和氢氧化铝佐剂混悬液1.5 mL(含卵清蛋白100 mg、氢氧化铝200 mg),构建内脏高敏感性NERD大鼠模型;空白组大鼠于同时间点腹腔注射等量生理盐水。24 h后,奥美拉唑组、配方颗粒剂组与水煎剂组大鼠基于课题组前期实验结果选定最佳剂量浓度,按照10 mL·kg-1分别给予840 mg·L-1奥美拉唑蒸馏水溶液、850 g·L-1和胃降逆配方颗粒剂溶液、850 g·L-1和胃降逆方水煎剂溶液灌胃[7],颗粒剂高、中、低剂量组大鼠按照10 mL·kg-1分别给予440、220、140 g·L-1的和胃降逆方颗粒溶液灌胃,每日1次,连续2周;空白组、模型组大鼠在同时间点给予10 mL·kg-1的蒸馏水灌胃;灌胃第12天夜间开始禁食不禁水,第14天大鼠经35 g·L-1水合氯醛麻醉,平卧位固定于保温的干净泡沫板上,头部抬高20°~30°,切开腹壁和胃壁,将一引流管放置在贲门处以收集从食管滴注的液体;将单腔灌流管经口置于食管内,导管内端开口位于食管和胃交界处上2~3 cm,固定导管,外端与持续注射泵相连,使用0.1 mol·L-1盐酸滴注;空白组大鼠给予蒸馏水食管滴注;滴注液温度保持 37 ℃,速度10 mL·h-1,共50 min。灌注完成后,断颈处死大鼠,在食管齿状线 2 cm 处取各组大鼠食管黏膜组织 1 cm,40 g·L-1多聚甲醛固定,石蜡包埋,5 μm 厚度冠状面连续切片,苏木精-伊红(hematoxylin and eosin,HE)染色,观察食管黏膜组织形态学变化,参照文献[8]方法,根据模型组NERD大鼠食管黏膜炎性细胞浸润、基底层增生、乳突延长、细胞间隙增宽情况确定NERD大鼠模型状态。
1.5 ELSIA法检测各组大鼠血清SP、CGRP、PAR2蛋白表达灌胃第14天,各组灌注结束后,经腹主动脉取血5~8 mL,4 ℃、3 000 r·min-1离心15 min,吸取上层血清分装至EP管中,-80 ℃冰箱保存。根据ELISA检测试剂盒说明书,用纯化的抗体包被96孔板,制成固相载体,分别往包被抗SP、CGRP、PAR2抗体的微孔中依次加入标本或标准品、生物素化的抗体SP、CGRP、PAR2、过氧化物酶标记的亲和素,彻底洗涤后,分别用ELISA试剂盒中的底物3,3′,5,5′-四甲基联苯胺显色,在过氧化物酶催化下转化成蓝色,然后在酸作用下转化为黄色,其颜色深浅与样本中SP、CGRP、PAR2的表达呈正相关,用酶标仪在450 nm波长下测定的吸光度值即代表样本中SP、CGRP、PAR2的浓度。
1.6 免疫组织化学法检测各组大鼠食管黏膜组织中MCT表达灌胃第14天,各组灌注结束,腹主动脉取血后,断颈处死大鼠,在距食管齿状线 2 cm处取大鼠食管黏膜组织1 cm,40 g·L-1多聚甲醛固定,石蜡包埋;脱蜡水化后经过氧化氢阻断,非免疫性山羊血清封闭,加一抗,4 ℃孵育过夜,用相应的生物素标记的山羊抗小鼠IgG抗体(150)37 ℃孵育40 min,50 μL辣根过氧化酶标记链霉亲和素溶液(1200)37 ℃孵育40 min,DAB显色,苏木精复染,脱水,透明,固定,拍照。食管黏膜鳞状上皮层出现深棕黄色或褐色颗粒为MCT阳性表达,颜色深浅及分布面积与MCT阳性表达呈正相关,运用Image-Pro Plus 6.0图像分析系统检测每个样本的吸光度值和染色区域总面积(area),MCT的单位面积相对表达量=吸光度值/area。

2 结果
2.1 各组大鼠食管黏膜组织病理学改变空白组大鼠食管黏膜鳞状上皮细胞间隙紧密,无明显炎性细胞浸润、鳞状上皮层增生等表现(图1A)。模型组大鼠食管黏膜鳞状上皮细胞间隙明显增宽,鳞状上皮层存在少量炎性细胞浸润,乳突出现一定延长(图1B)。奥美拉唑组及各中药干预组大鼠可见增宽的细胞间隙不同程度减小或恢复,炎性细胞及鳞状上皮层增生均不明显(图1C~图1H)。

A:空白组;B:模型组;C:奥美拉唑组;D:配方颗粒剂组;E:水煎剂组;F:颗粒剂高剂量组;G:颗粒剂中剂量组;H:颗粒剂低剂量组。
图1 各组大鼠食管黏膜组织病理学改变(HE染色,×100)
Fig.1 Pathological changes of esophageal mucosa of rats in each group (HE staining,×100)
2.2 各组大鼠血清SP、CGRP、PAR2蛋白水平比较结果见表1。与空白组比较,模型组大鼠血清SP、CGRP蛋白表达水平显著升高,差异有统计学意义(P<0.01);模型组大鼠血清PAR2蛋白表达水平与空白组比较差异无统计学意义(P>0.05)。与模型组比较,奥美拉唑组、颗粒剂中剂量组大鼠血清SP蛋白表达水平下降,差异有统计学意义(P<0.05);配方颗粒组、水煎剂组及颗粒剂高、低剂量组大鼠血清SP蛋白表达水平与模型组比较差异无统计学意义(P>0.05)。与模型组比较,奥美拉唑组及颗粒剂高、中剂量组大鼠血清CGRP蛋白表达水平均显著下降,差异有统计学意义(P<0.01);配方颗粒组、水煎剂组及颗粒剂低剂量组大鼠血清CGRP蛋白表达水平与模型组比较差异无统计学意义(P>0.05)。与模型组比较,颗粒剂高剂量组大鼠血清PAR2蛋白表达水平升高,差异有统计学意义(P<0.05);其余各用药组大鼠血清PAR2蛋白表达水平与模型组比较差异无统计学意义(P>0.05)。与奥美拉唑组比较,其余各用药组大鼠血清SP蛋白表达水平均有不同程度的升高,但差异无统计学意义(P>0.05);水煎剂组和颗粒剂低剂量组大鼠血清CGRP蛋白表达水平高于奥美拉唑组,差异有统计学意义(P<0.05,P<0.01);颗粒配方剂组及颗粒剂高、中剂量组大鼠血清CGRP蛋白表达水平与奥美拉唑组比较差异均无统计学意义(P>0.05);与奥美拉唑组比较,其余各用药组大鼠血清PAR2蛋白表达水平均有不同程度上升,但差异无统计学意义(P>0.05)。
表1 各组大鼠血清SP、CGRP、PAR2蛋白表达水平比较
Tab.1 Comparison of the serum levels of SP,CGRP and PAR2 protein in each group of rats
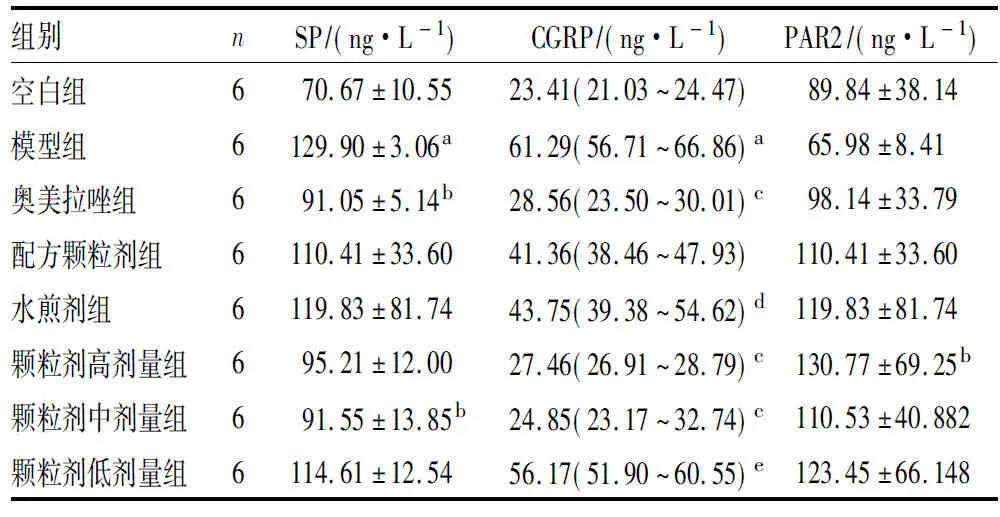
组别nSP/(ng·L-1)CGRP/(ng·L-1)PAR2/(ng·L-1)空白组670.67±10.5523.41(21.03~24.47)89.84±38.14模型组6129.90±3.06a61.29(56.71~66.86)a65.98±8.41奥美拉唑组691.05±5.14b28.56(23.50~30.01)c98.14±33.79配方颗粒剂组6110.41±33.6041.36(38.46~47.93)110.41±33.60水煎剂组6119.83±81.7443.75(39.38~54.62)d119.83±81.74颗粒剂高剂量组695.21±12.0027.46(26.91~28.79)c130.77±69.25b颗粒剂中剂量组691.55±13.85b24.85(23.17~32.74)c 110.53±40.882颗粒剂低剂量组6114.61±12.5456.17(51.90~60.55)e123.45±66.148
注:与空白组比较aP<0.01;与模型组比较bP<0.05,cP<0.01;与奥美拉唑组比较dP<0.05,eP<0.01。
2.3 各组大鼠食管黏膜组织中MCT表达比较空白组、模型组、奥美拉唑组、配方颗粒剂组、水煎剂组及颗粒剂高、中、低剂量组大鼠食管黏膜组织中MCT相对表达量分别为0.69±0.12、1.16±0.39、0.55±0.16、0.97±0.08、0.51±0.22、1.17±0.20、0.63±0.06、0.65±0.07。与空白组比较,模型组大鼠食管黏膜组织中MCT的相对表达量显著升高,差异有统计学意义(P<0.01)。与模型组比较,奥美拉唑组、水煎剂组及颗粒剂中、低剂量组大鼠食管黏膜组织中MCT相对表达量显著降低,差异有统计学意义(P<0.01);配方颗粒剂组、颗粒剂高剂量组大鼠食管黏膜组织中MCT相对表达量与模型组比较差异无统计学意义(P>0.05)。配方颗粒剂组、颗粒剂高剂量组大鼠食管黏膜组织中MCT相对表达量高于奥美拉唑组,差异有统计学意义(P<0.01);水煎剂组及颗粒剂中、低剂量组大鼠食管黏膜组织中MCT相对表达量与奥美拉唑组比较差异无统计学意义(P>0.05)。
3 讨论
胃食管反流病是一种常见的危害极大的慢性上消化道疾病[9-10],已经成为影响人类身心健康的疾病之一,其发病率不断上升,其中NERD占该病发病的70%[1]。目前,NERD的发病机制尚不十分明确,研究发现,内脏高敏感是NERD的重要病理生理机制,在其发生、发展过程中起重要作用[11]。NERD患者对质子泵抑制剂(proton pump inhibitors,PPI)治疗反应差,可能与PPI不能消除内脏高敏感性有关[12]。深入研究内脏高敏感的分子机制将为NERD的治疗提供重要依据。NERD属于中医学“嘈杂”、“吞酸”的范畴[13-14],病机多因寒热错杂、脾不升清、胃失和降,治以平调寒热、和胃降逆。和胃降逆方由黄芩、黄连、清半夏、干姜、浙贝母、蒲公英、龙胆草、枳实、全瓜蒌、炙甘草组成,共奏寒热并调,和胃降逆、散结除痞之功。
肥大细胞是多种介质的有效来源,具有介导促炎、抗炎及免疫调节作用。在消化系统疾病中,激活后的肥大细胞能通过刺激消化道神经递质调节内脏敏感性,进而影响消化道的运动功能[15]。在对反流性食管疾病的研究中发现,肥大细胞活化或脱颗粒能特异性激活PAR2受体,引起SP和CGRP的释放[16]。临床研究发现,NERD患者食管黏膜组织中肥大细胞存在活化、脱颗粒等改变,可能在NERD发病中起重要作用[17]。PAR2激活参与了神经递质和炎性因子释放活动,可增加上皮通透性,调节内脏高敏感状态和疼痛[18]。本课题组前期研究也证实,和胃降逆方能通过下调NERD大鼠的5-羟色胺受体等神经递质而调节内脏高敏感状态[19]。基于此,本研究对NERD大鼠给予和胃降逆方干预,结果发现,NERD大鼠食管黏膜组织中MCT及血清SP、CGRP蛋白表达有不同程度下降,PAR2蛋白的表达尚存在一定争议,提示和胃降逆方可能通过多靶点起到有效治疗NERD的作用。
SP和CGRP是伤害性刺激传入神经元局部释放的炎性介质,参与传入神经通路的高敏感,不仅存在于人类和其他哺乳动物的皮肤,也存在于内脏器官[20-21]。SP是由神经元分泌的肽类物质,参与感受伤害性刺激及炎症等生物过程[22]。在受到伤害性刺激时,肥大细胞脱颗粒所引起的继发性反应是由初级感觉神经末梢刺激后从感觉神经元末梢释放的神经肽类物质所引起。释放的SP除了参与局部血管扩张外,又能反作用于肥大细胞,诱导其释放组胺,进而激活其他感觉神经末梢,加重感觉刺激[23]。CGRP也是一种神经肽,在消化系统功能性的内脏传入神经敏化中具有重要作用。研究发现,NERD患者食管上皮组织中CGRP和SP表达增加,提示CGRP和SP是治疗NERD的潜在作用靶点[24]。
PAR2是跨膜G蛋白偶联受体家族中的一员,表达于整个消化系统的上皮细胞以及腰椎区的外周和脊髓传出神经元[25],因其易被胰蛋白酶在内的丝氨酸蛋白酶特异性激活,使其有别于大多数的家族成员。研究证实,在消化系统中,PAR2的激活与内脏痛觉过敏、通透性增加、运动等有关[26]。相关研究表明,PAR2的激活可能在NERD发病过程中起重要作用,将PAR2作为NERD的潜在治疗靶点是必要的[27]。
本研究结果显示,模型组大鼠食管黏膜鳞状上皮层呈现出不同程度的细胞间隙增宽、少量炎细胞浸润及乳突延长,而各用药组大鼠病变较轻,提示卵清蛋白基础致敏联合酸灌注能够诱导内脏高敏感大鼠模型,而和胃降逆方能够缓解NERD大鼠的病理变化。另外,模型组大鼠血清SP、CGRP蛋白表达水平显著高于空白组,提示NERD大鼠出现SP、CGRP等敏感物质的释放;经药物干预后,与模型组比较,奥美拉唑组、颗粒剂中剂量组大鼠血清SP蛋白表达水平下降,奥美拉唑组及颗粒剂中、高剂量组大鼠血清CGRP蛋白表达水平显著下降;而水煎剂组大鼠血清中CGRP蛋白表达水平显著高于奥美拉唑组,颗粒剂中、高剂量组大鼠血清CGRP蛋白表达水平与奥美拉唑组比较差异无统计学意义;综合以上结果,提示颗粒剂中剂量组在调节SP、CGRP释放方面的效果最佳。另外,本研究发现,模型组大鼠血清PAR2表达水平低于空白组,但差异无统计学意义,因此,PAR2作为和胃降逆方治疗NERD的特异性靶点的设想有待进一步研究证实;模型组大鼠食管黏膜组织中MCT表达显著高于空白组,提示NERD大鼠存在肥大细胞激活的状况。经药物干预后,奥美拉唑组、水煎剂组及颗粒剂低、中剂量组大鼠食管黏膜组织中MCT相对表达量显著低于模型组,其余各用药组大鼠食管黏膜组织中MCT相对表达量虽较模型组有不同程度下降,但组间比较差异无统计学意义;另外,配方颗粒剂组、颗粒剂高剂量组大鼠食管黏膜组织中MCT相对表达量高于奥美拉唑组,差异有统计学意义;水煎剂组、颗粒剂中剂量组大鼠食管黏膜中MCT相对表达量与奥美拉唑组接近,提示水煎剂、中剂量颗粒剂抑制肥大细胞激活的效果更佳。
综上所述,和胃降逆方可一定程度减轻NERD模型大鼠食管黏膜组织炎性增生及细胞间隙增宽的状态,其机制可能与抑制食管黏膜组织中肥大细胞激活,降低血清SP、CGRP等神经肽类物质的表达,从而缓解内脏高敏感状态有关;同时,通过对和胃降逆方不同剂型和浓度的观察,发现220 g·L-1和胃降逆方颗粒剂对NERD大鼠的改善效果最佳。

