母猪乳寡糖的生理功能研究
阳田恬 吕宏伟 贺喜 范志勇 宋泽和
摘 要:乳寡糖(Milk Oligosaccharides,MOs)是一类存在于母乳中的天然益生元,在母乳中为仅次于脂肪和乳糖的第三大固有成分。MOs本质为一系列结构复杂的糖分子,猪乳寡糖(Porcine Milk Oligosaccharides,PMOs)主要分为岩藻糖MOs(fucosylated-MOs,fuc-MOs)、中性MOs(neutral-MOs,neu-MOs)和唾液酸化MOs(sialylated-MOs,sia-MOs)。MOs不仅可被动物肠道消化吸收,还可作为底物被肠道微生物利用。PMOs具有调节肠道菌群结构、调节免疫应答和抵抗有害微生物黏附的能力,因而在仔猪肠道菌群塑造和免疫构建过程中发挥着重要功能。本文阐述了PMOs的组成成分、MOs的生理功能及其代谢,旨在为PMOs应用于动物生产提供理论参考。
关键词:乳寡糖;生理功能;代谢;猪乳寡糖
中图分类号:S816.2 文献标志码:A 文章编号:1001-0769(2019)08-0021-03
肠道是动物体中最大的免疫器官,而幼龄时期是动物体免疫系统激活的重要阶段,此阶段肠道菌群的塑造和免疫应答过程对动物后续生命阶段的生长发育和抗病能力具有持久影响[1]。仔猪在断奶前后,由于自身肠道功能和免疫系统发育不完善,易受到外源因素(如环境、饮水和食物等)影响而发生腹泻,严重影响其生长速度和养殖效益[2]。同时,仔猪肠道健康依赖于有益菌在肠道定植过程中处于优势地位,使用抗菌物质抑制肠道中的细菌数量并不能长期有效地对仔猪抗病能力产生有益的影响。此外,外源添加剂的使用对幼龄仔猪肠道具有未知风险,如过敏反应和黏膜损伤等。
母乳不仅为幼龄仔猪生长发育提供能量、蛋白和矿物质等营养素,而且还含有多种细胞因子、免疫球蛋白及母乳干细胞等免疫活性物质。与外源添加剂相比,母乳本身即为新生仔猪构建免疫系统的关键因素,具有低风险和高利用率等优势。乳寡糖(Milk Oligosaccharides,MOs)是一种天然的益生元,是乳汁中低于脂肪和乳糖的第三大固有成分[3],对仔猪肠道菌群塑造和免疫系统的构建过程具有积极的影响。目前,人类食品领域对于人乳寡糖(Human Milk Oligosaccharides,HMOs)的研究已进入应用阶段,但对猪乳寡糖(Porcine Milk Oligosaccharides,PMOs)的研究仍相对滞后,需要引起广大研究者的关注。
1 PMOs简介
PMOs在乳腺上皮细胞中的高尔基体合成,通常由3~10个单糖组成,其基本单体有己糖(Hexose,Hex)、N-乙酰己糖胺(N-acetylhexososamine,HexNAc)、L-岩藻糖(L-Fucose,Fuc)、N-酰基神经氨酸(N-acetylneuraminic Acid,NeuNAc)和N-羥乙酰神经氨酸(N-glycolylneuraminic Acid,Neu5Gc),经检测,其种类在30~60种之间[4-7]。PMOs主要分为岩藻糖MOs(fucosylated-MOs,fuc-MOs)、中性MOs(neutral-MOs,neu-MOs)和唾液酸化MOs(sialylated-MOs,sia-MOs)。在整个泌乳期,中性MOs的含量高于酸性MOs,初乳PMOs的种类和含量最高,而常乳PMOs的种类和含量减少,其中游离唾液酸的浓度降低,结合和总唾液酸的浓度增加[7]。
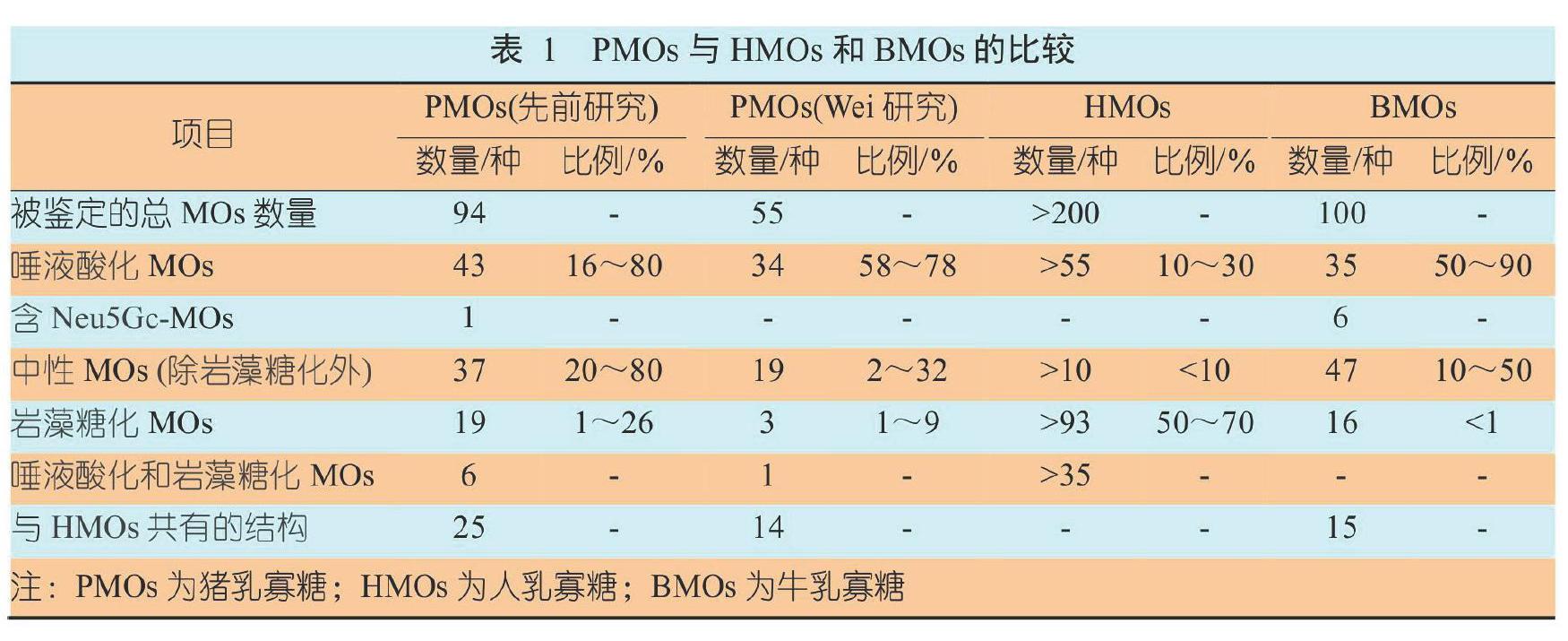
由于不同物种的胃肠道系统不同,寡糖种类和比例各有差异。表1显示已鉴定的PMOs共有94种[7],唾液酸化结构的数量占猪乳总数量的16%~80%,占人乳总数量的10%~30%。PMOs是高度唾液酸化的,HMOs是高度岩藻糖化的,牛乳寡糖(Bovine Milk Oligosaccharides,BMOs)是高度唾液酸化和低岩藻糖化的[8]。初乳中HMOs的含量为22 g/L~23 g/L,常乳中的为12 g/L~13 g/L;BMOs含量极低,比人乳浓度低20~100倍,在初乳中约为1 g/L,在常乳中约为0.5 g/L[7,9]。猪乳和人乳存在25种共同的MOs结构,而牛乳和人乳仅存在15种共有结构。
2 MOs的代谢
MOs主要在肠道中被消化吸收,经肠道吸收到血液中,在血液中以游离和化合物形式存在,然后通过血液转运参与体循环,小部分通过血脑屏障进入大脑,促进大脑发育[10],未消化部分主要到达结肠[11],但其在结肠中的降解产物尚不清楚,最终以粪便或尿液形式排出体外[12-13]。Jantscher-Krenn等[14]证明,大鼠摄入MOs后,在到达结肠之前,其在小肠段的相对丰度显著变化。表明肠道选择性吸收MOs。HMOs在粪便中的主要核心结构是乳酰-N-四糖(Lacto-N-tetraose,LNT),排泄的变化远高于尿液;而在尿液中,大约15%的HMOs以10 mg/d~ 100 mg/d LNT或10 mg/d~100 mg/d 乳酰-N-岩藻五糖(Lacto-N-fucopentaose II,LNFP II) 排出[15]。
MOs的降解程度会受到胃肠道微生物的组成和活动的影响。Underwood等[16]研究表明早产儿对HMOs的吸收和排泄会对肠道微生物群造成影响,fuc-HMOs和sia-HMOs的百分比在个体之间高度可变,尿液和粪便中HMOs组成存在差异,这与粪便变形菌和厚壁菌门的改变有关。Dotz等[17]在婴儿粪便和尿液中发现了其母乳中不存在的Se-特异性HMOs和Le-特异性HMOs。Rudloff等[18]在早产仔猪配方中分别添加5 d和11 d的HMOs,结肠中微生物群组成和内容物均出现差异,从第5天高水平的厚壁菌门(以梭菌为主)变为第11天由螺杆菌和弯曲杆菌主导的高水平的变形菌。
3 MOs的生理功能
3.1 改善肠道微生态
MOs能够调节动物肠道菌群,通过为肠道提供利于有益菌(双歧杆菌和乳杆菌)生长的环境,促进它们的增殖,而有益菌进一步发酵产生有机酸,包括乳酸、短链脂肪酸(Short Chain Fatty Acids,SCFAs)、丁酸盐、乙酸盐和丙酸盐,降低肠道中内容物的pH,从而抑制有害菌的生长[19-20]。其中,SCFAs还可以在促进分化的同时抑制增殖以及紧密连接的发育,改善肠屏障功能。乳酸菌和双歧杆菌在人体肠道内消耗和降解HMOs,MOs尤其是sia-MOs可作为益生元,供给乳酸菌和双歧杆菌碳源,并促使它们快速增殖[21-22]。Marcobal等[23]研究发现,在婴儿双歧杆菌和拟杆菌共同接种的情况下,HMOs中的一种成分乳糖基-N-新四糖(Lacto-N-neotetraose,LNnT)为婴儿双歧杆菌提供了显著的生长优势,并使其相对丰度由2%左右增加至40%以上。乳酸菌和双歧杆菌在机体肠道内定植,改善肠道微生态环境,具有一定的免疫调节功效[24]。Kavanaugh等[25]证明,HMOs能促进长双歧杆菌婴儿亚种ATCC 15697对HT-29和Caco-2人肠道细胞的黏附能力。Difilippo等[26]研究表明,仔猪微生物菌群首先利用小分子的PMOs,如neu-PMOs和sia-PMOs,然后利用大分子的neu-PMOs。
3.2 调节免疫应答
MOs可通过直接或间接作用影响免疫系统,从而调节免疫应答。一方面,MOs调节免疫反应相关的细胞因子和趋化因子的水平,通过刺激肠道成熟[27-28]、预防过敏反应[29]和调节炎症标志物的细胞表达水平[30-31]三条途径来调节机体免疫应答。中性HMOs被转运到肠上皮细胞中,并通过受体介导的胞吞作用穿过上皮单层细胞,减弱炎症信号转导的关键步骤,预防、阻止以及逆转炎症的发生,这可部分归因于HMOs能淬灭黏膜的过度炎症反应。另一方面,MOs通过介导宿主肠道微生物群组成,可间接影响其免疫系统。研究发现HMOs能够调节仔猪黏膜免疫、结肠微生物组成以及降低轮状病毒诱导仔猪腹泻的持续时间[32],新生仔猪对唾液乳糖具有良好的耐受性,其对肠道发育无不利影响[33]。MOs还可与参与病原体识别的受体结合,即Toll样受体(Toll-Like Receptors,TLR)、樹突状细胞特异性ICAM3-捕获非整合素(Dendritic Cell-Specific ICAM3-Grabbing Non-integrin,DC-SIGN)、唾液酸结合性免疫球蛋白样凝集素(Siglecs)、半乳凝素和选择素,增加它们的信号转导表达,影响免疫稳态[34]。
此外,研究表明,MOs可有效预防坏死性小肠结肠炎(Necrotising Enterocolitis,NEC),且可能具有高度的结构特异性,但目前机制尚不明确。Jantscher-Krenn等[35]用患有新生儿坏死性小肠结肠炎的小鼠进行试验,在处理组中加入HMOs,96 h后大鼠的存活率从73.1%提升至95.0%。HMOs的特殊成分双唾液酸-N-四糖(Disialyllacto-N-Tetraose,DSLNT)可用于预防或治疗配方奶喂养婴儿造成的新生儿坏死性小肠结肠炎[36]。Good等[37]研究表明,HMOs中的2FL通过增加血管扩张分子内皮型一氧化氮合酶表达维持肠系膜灌注来预防新生儿坏死性小肠结肠炎。
3.3 抗有害微生物的黏附与侵袭
在某些情况下,疾病是由于细菌[38]、真菌[39]、病毒[40-42]以及原生动物寄生虫病原体[43]附着于上皮细胞表面、入侵后增殖引起的。而MOs具有与寡糖相似的结构,可用作可溶性诱饵受体,与细菌、病毒和真核生物结合到达黏膜表面,或者通过直接结合上皮表面受体,阻断病原体的进入,避免它们的复制,进而阻止其进入细胞,显示出抗微生物黏附作用。MOs抵抗阿米巴虫黏附是通过与非岩藻糖基化末端Gal结合,形成GalNAc凝集素,促进寄生虫附着以及肠上皮细胞的杀伤和吞噬作用。
MOs还可以直接与上皮细胞相互作用,防止细菌侵袭。Lin等[44]研究表明,含3SL的HMOs能抑制凋亡的细胞内信号通路,保护膀胱上皮细胞免受尿道致病性大肠杆菌感染产生的有害细胞毒性和促炎作用。
4 小结
MOs作为天然和安全的活性物质,在调节动物肠道菌群平衡、激发动物体免疫和抵抗有害微生物黏附方面发挥着重要的作用。目前人类对PMOs的研究处于发展的阶段,结构种类方面的研究在不断加强,生理功能以及吸收和代谢机制研究较少,局限于HMOs。研究PMOs中的有效功能成分,开发PMOs添加剂应用于动物生产,对新生仔猪的营养研究与发展具有重要意义。□□
参考文献:(44篇,略)

