“盖斯定律”知识解读
2019-11-11 13:31李清
中学化学 2019年10期
李清

“盖斯定律”是热化学的重要定律,也是各类考试考查的重点。现对其进行多角度分析,希望对复习有所帮助。
一、盖斯定律的内容
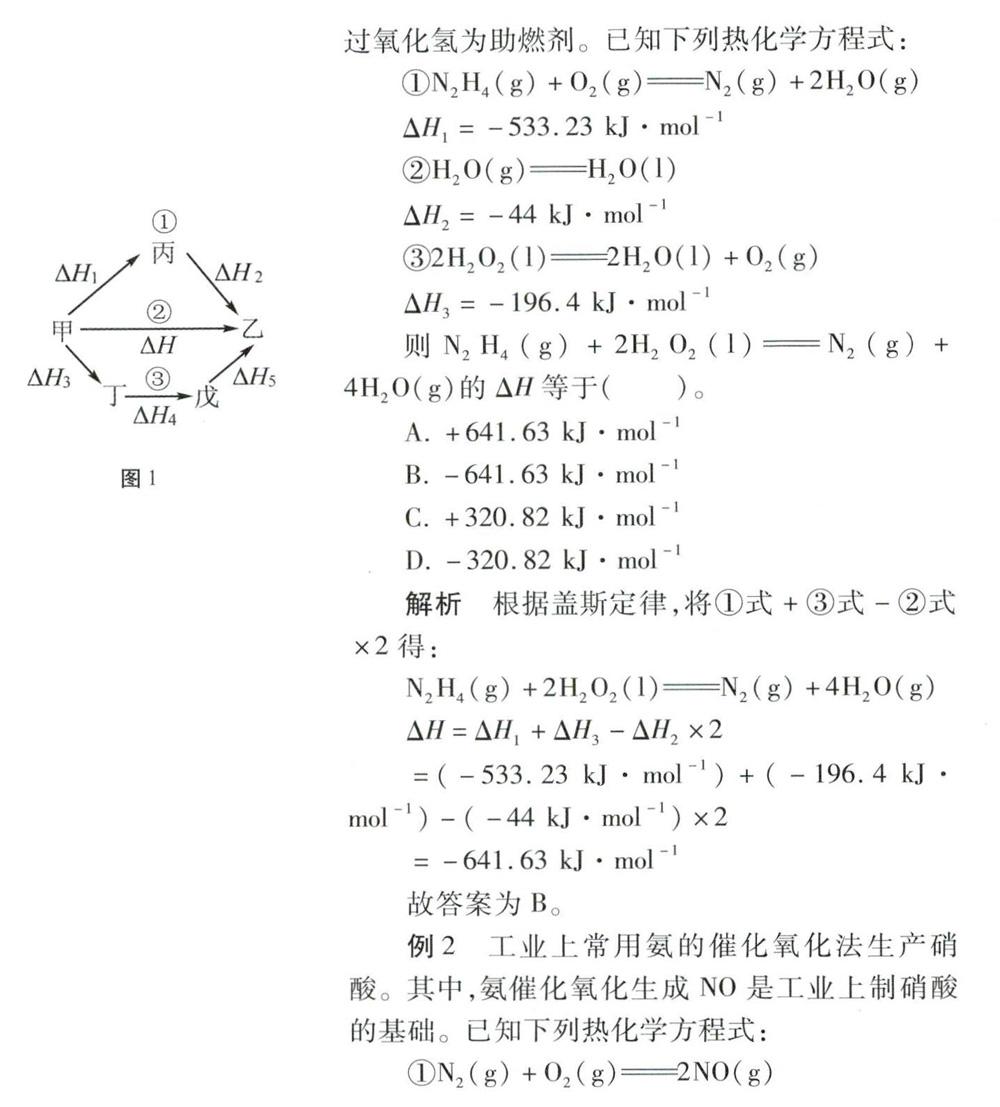
对于一个化学反应,无论是一步完成还是分几步完成,其反应热相同。即:化学反应的反应热只与反应的始态和终态有关,而与反应的途径无关。如图1所示,始态和终态相同,反应的途径有三种,则△H=△H1+△H2=△H3+△H4+△H5。
二、盖斯定律的应用
一是应用盖斯定律计算反应热;二是应用盖斯定律判断有关反应热之间的关系;三是应用盖斯定律书写热化学方程式。
三、应用盖斯定律时的注意事项
一是将热化学方程式乘以某一个数时,反应热也必须乘上该数;二是将热化学方程式相加减时,反应热也必须相加减;三是将一个热化学方程式颠倒时,△日的“+”、“一”随之改变,但数值不变。
四、有關盖斯定律的典例赏析
1.利用已知的反应热计算未知的反应热△H
例1火箭推进器常以联氨(N2H4)为燃料,过氧化氢为助燃剂。已知下列热化学方程式:
猜你喜欢
儿童故事画报·智力大王(2019年5期)2019-07-14
理科考试研究·高中(2017年7期)2017-11-04
扬子江(2017年4期)2017-07-19
试题与研究·高考理综物理(2016年3期)2017-03-28
创新作文(3-4年级)(2014年11期)2014-11-25
读者·校园版(2014年7期)2014-05-14
新东方英语(2014年1期)2014-01-07
知识窗(2013年9期)2013-02-11
花木盆景·盆景赏石(2009年9期)2009-04-07
数理化学习·高三版(2009年2期)2009-04-03

