新型PPARα激动剂(E)-4-氯苯氧苯丙烯酸衍生物的合成及降血脂活性研究
陈小兵,黄丽芸,许 军,袁章林,凌志杰,林丽娟,彭 红
(1.赣南卫生健康职业学院,江西 赣州 341000;2.江西中医药大学 药学院,江西 南昌 330004)
PPARα是过氧化物酶体增殖激活受体( peroxisome proliferator-activated receptors,PPARs)家族中重要的亚型之一,PPARs包括PPARα、PPARβ 和 PPARγ 3 种亚型[1]。PPARα激动剂是目前临床上常用的降血脂药物,其生理功能的发挥主要是依靠调节靶基因的启动子来实现基因转录[2],其降血脂机制是主要参与肝脏、肾脏以及心肌等组织器官中游离脂肪酸的氧化[1]。当PPARα被激动剂激活,可导致高密度脂蛋白水平增加,同时增加脂蛋白脂酶的表达,减少载脂蛋白C Ⅲ的表达,以降低血浆中低密度脂蛋白和甘油三酯水平等生理功能[3-4]。本研究从对新型PPARα激动剂对氯苯氧丁酸甲氧基苯丙酸酯的结构改造与降血脂活性的关系出发,通过整合组合化学策略以及运用CADD辅助新药开发的计算机虚拟筛选技术,设计出新型的PPARα激动剂(E)-4-氯苯氧苯丙烯酸衍生物。
新药对氯苯氧丁酸甲氧基苯丙酸酯是阿魏酸的衍生物,是具有降血脂活性的全新化合物[5],其降血脂的机制是通过降低大鼠体内的极低密度脂蛋白的生物合成,促使极低密度脂蛋白的生物降解导致甘油三酯的减少以及促使大鼠体内胆固醇的水解与转移[6]。中药阿魏酸具有降血脂、延缓衰老、抗炎、抗血栓形成以及调节人体免疫功能等作用[7-11]。但由于阿魏酸分子结构中含有烯烃且烃链较短,其亲水性较强,亲酯性弱难以深入脂质双层发挥生理作用,故将阿魏酸结构中的酚羟基和羧基进行设计与活性口袋互补进行结构改造和活性筛选,改变阿魏酸难于通过膜的脂质双分子层的局限性。新药对氯苯氧丁酸甲氧基苯丙酸酯由中药活性成分阿魏酸和化学降血脂药对氯苯氧异丁酸通过酯化反应而成[5],其结构也通过各种波谱数据进行了确证报道[12]。但在前期研究中,笔者发现对氯苯氧丁酸苯丙烯酸以阿魏酸为原料合成的收率不高且其降血脂的活性并不是很强,故打算改变合成路径以及将它作为先导化合物,将其结构再进行修饰,将结构中羧基转化成酯类和酰胺类,期望得到活性更高、毒性更低的(E)-4-氯苯氧苯丙烯酸衍生物。课题组通过化合合成的方式,将先导化合物分别与饱和醇、脂环醇、芳香醇和杂环醇成酯,与脂肪胺、脂环胺、芳香胺和杂环胺成酰胺总共合成了10个未见文献报道的(E)-4-氯苯氧苯丙烯酸衍生物,并对这10个不同类型的衍生物进行了降血脂活性考察,发现目标化合物2b,2e,3b,3d,3e具有明显的降血脂活性。
1 实验
1.1 仪器
FTIR-650傅里叶变换红外光谱仪(KBr压片,天津港东科技股份有限公司),ARX-300型核磁共振仪(内标物:TMS,瑞士Bruker公司),LCMS-IT-TOF质谱仪(SHIMADZU/岛津),电热数显恒温水浴锅(HH-6,常州蒙特仪器制造有限公司),ZF-20D暗箱三用紫外分析仪(上海越众仪器设备有限公司),JC-JJ-WS数显增力电动搅拌器(青岛聚创环保设备有限公司),101-4数显鼓风干燥箱(上海沪粤明科学仪器有限公司),X5显微熔点测定仪(温度计读数未校正,巩义市科瑞仪器有限公司),循环水真空泵(郑州市亚荣仪器有限公司)。
1.2 试剂
香草醛、3-胺乙基氧杂环丁烷(分析纯,中国医药(集团)上海化学试剂公司),对氯苯氧异丁酸、2-茴香胺(分析纯,上海邦成化工有限公司),苯磺酰氯、环丙基甲胺(分析纯,上海久山化工有限公司),吡啶(分析纯,汕头市西陇化工有限公司),苯胺(分析纯,汕头市西陇化工有限公司),乙醇、乙胺(分析纯,中国医药(集团)上海化学试剂公司),金刚烷醇、金刚烷胺(分析纯,上海冠导生物工程有限公司),苯氧乙醇、3-吡咯烷醇(分析纯,湖北信康医药化工有限公司)。
1.3 试验用大鼠及其他试剂
SD种大鼠,SPF级,雌雄各半,体重110~120 g,由江西中药大学实验动物中心提供,动物合格证号:SCXK(赣)2017-0003。其他试剂为分析纯,市售。
1.4 合成实验
先导化合物(1)以对氯苯氧异丁酸、香草醛为原料采用酰氯法、酸酐法、Doebner反应等将先导化合物中羧酸基团与苯磺酰氯生成酰氯,然后再与酚醇反应生成酯,再经Doebner反应[13-15]合成得到。通过先导化合物对氯苯氧异丁酸甲氧基苯丙烯酸酯(1)制备10个酯类和酰胺类新型的PPARα激动剂(E)-4-氯苯氧苯丙烯酸衍生物,所有化合物的结构经1HMNR、元素分析及 MS分析确证,目标化合物的理化常数见表1。目标化合物的合成路线见图1。
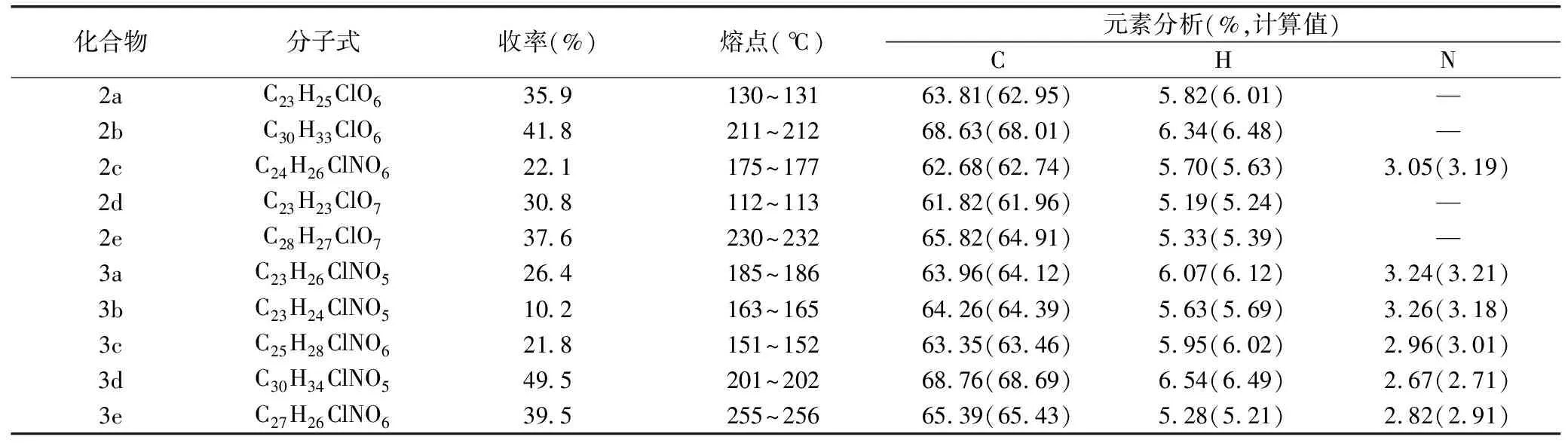
表1 目标化合物理化性质及元素分析
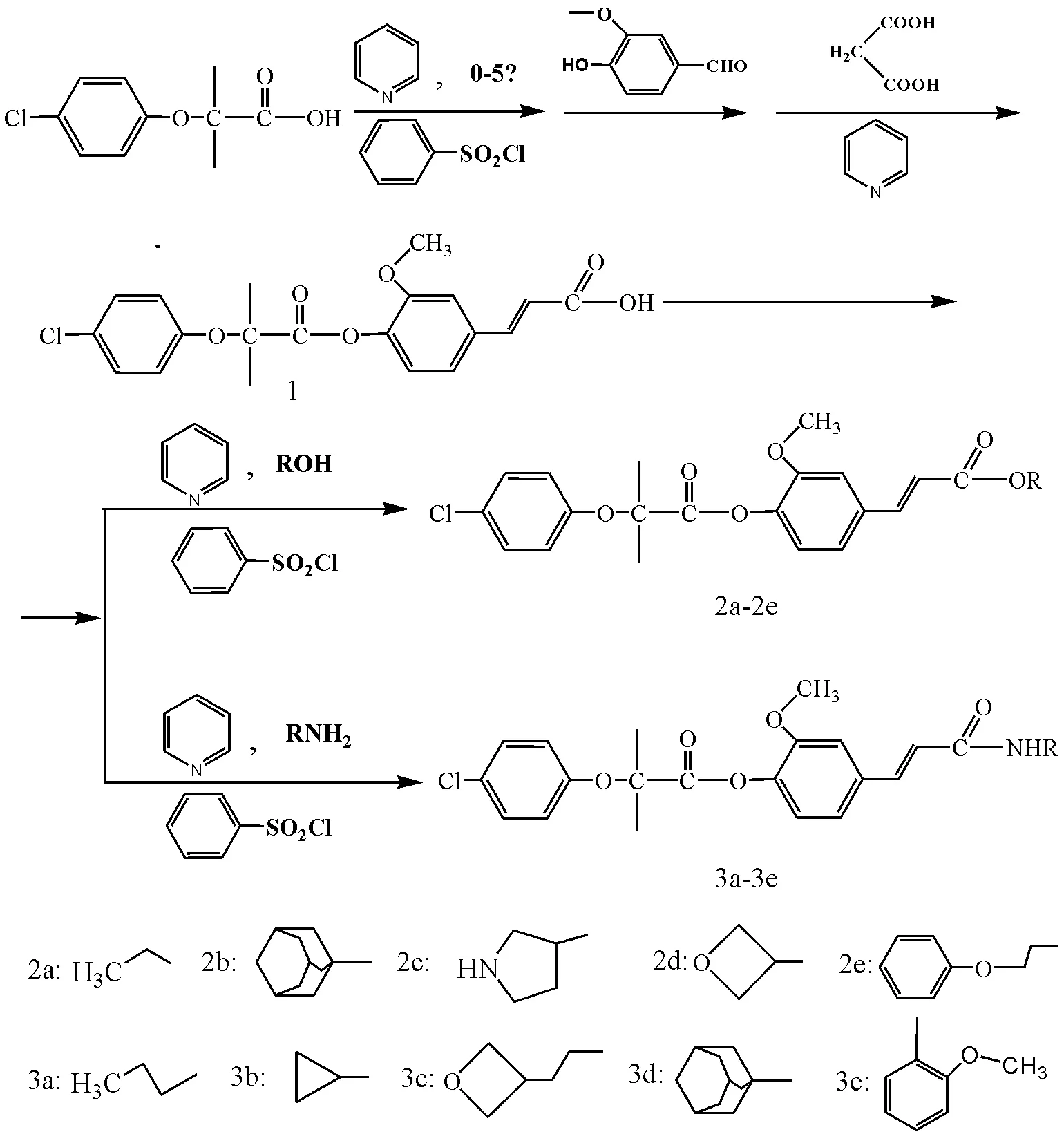
图1 目标化合物合成路线
1.4.1 先导化合物对氯苯氧异丁酸甲氧基苯丙烯酸酯(1)的制备 将对氯苯氧异丁酸10.7 g(50 mmol)溶于100 mL无水吡啶中,加入到安装有冷凝回流器和废气处理的三口烧瓶中。在冰浴(0~5 ℃)条件下,缓慢滴加6.4 mL(17.7 g,50 mmol)的苯磺酰氯,滴毕,室温条件下继续反应1 h后,继续向反应器中滴加30 mL溶有7.6 g(50 mmol)香草醛的无水吡啶溶液,滴毕,滴加几滴苯胺溶液。室温条件下反应4 h后,再加入丙二酸5.2 g(50 mmol)于80~90 ℃条件下回流8 h,反应完成后将反应液倒入含50 mL浓盐酸的200 g冰水中,溶液显现为淡黄色,静置片刻,烧杯内壁及底部出现淡黄色结晶状物质。静置2 h后,抽滤,滤饼用体积分数4%的NaOH水溶液洗涤5次(每次100 mL),再用蒸馏水洗涤5次(每次100 mL)至中性,干燥后的粗品先后用体积分数70%和95%的乙醇重结晶,得到淡白色结晶体状化合物。烘干,研碎得到白色粉末11.4 g,收率58.5%。测其熔点为143~144 ℃。化合物结构的光谱数据与文献报道基本一致[12],确证为对氯苯氧异丁酸甲氧基苯丙烯酸酯(1)。
1.4.2 对氯苯氧异丁酸甲氧基苯丙烯酸酯(2a-2e)的制备 将对氯苯氧异丁酸甲氧基苯丙烯酸酯(1)7.8 g(20 mmol)溶于50 mL无水吡啶中,加入到安装有冷凝回流器和废气处理的三口烧瓶中。在冰浴(0~5 ℃)条件下,缓慢滴加2.6 mL(20.3 g,20 mmol)的苯磺酰氯,滴毕,室温条件下继续反应1 h后,继续向反应器中滴加5 mL溶有25 mmol乙醇(金刚醇、吡咯烷醇、环氧醇、苯氧乙醇)的无水吡啶溶液,滴毕,滴加几滴苯胺溶液。室温条件下反应4 h后,将反应液倒入含20 mL浓盐酸的100 g冰水中,溶液显现为淡黄色,静置片刻,烧杯内壁及底部出现淡黄色结晶状物质。静置2 h后,抽滤,滤饼用体积分数4%的NaOH水溶液洗涤5次(每次100 mL),再用蒸馏水洗涤5次(每次100 mL)至中性,干燥后的粗品用体积分数70%和95%的乙醇重结晶,得到目标化合物2a-2e。
2a:收率:35.9%。分子式:C23H25ClO6,mp130~131 ℃。IR (KBr)光谱显示:C=O的吸收峰在1 609、1 658 cm-1处。苯环吸收峰:1 621、1 515、1 439、1 207、1 054、911、821、807 cm-1。EI-MS:m/z 432[M]+。1H-NMR(CDCl3,300 MHz)δ:1.01(d,3 H),1.58(s,6 H,J=7.8 Hz),1.65(m,2 H),3.89(s,3 H,J=7.8 Hz),4.31(d,2 H),6.42(d,1 H,J=7.9 Hz),6.77(dd,2 H),6.81(s,1 H,J=7.8 Hz),6.91(d,1 H),7.25(d,2 H,J=7.9 Hz),7.93(d,1 H)。
2b:收率:41.8%。分子式:C30H33ClO6,mp211~212 ℃。IR (KBr)光谱显示:在1 609、1 712 cm-1处有两个C=O吸收峰。苯环吸收峰:1 796、1 711、1 659、1 581、1 168、955、856、754 cm-1。其中,在856、754 cm-1的C-H弯曲振动提示分子中存在苯环的 1,4-二取代。EI-MS:m/z 524[M]+。1H-NMR(CDCl3,300 MHz)δ:1.21~2.01(d,12 H),1.45(m,3 H),1.63(s,6 H,J=7.9 Hz),3.91(s,3 H,O-H),6.68~7.04(d,6 H),7.23(d,2 H,J=7.9 Hz),7.72(d,1 H)。
2c:收率:22.1%。分子式:C24H26ClNO6,mp175~177 ℃。IR (KBr)光谱显示:在1 611、1 663 cm-1处有C=O的吸收峰。苯环吸收峰:1 638、1 621、1 545、1 530、1 328、1 209、1 043、956、804 cm-1。EI-MS:m/z 459[M]+。1H-NMR(CDCl3,300 MHz)δ:1.63(s,6 H,J=8.0 Hz),1.98(m,2 H),2.18(s,1 H,N-H,J=8.0 Hz),2.75(d,2 H),2.91(d,2 H),3.89(s,3 H,J=7.8 Hz),4.08(dd,1 H),6.39(d,1 H,J=8.0 Hz),6.75(d,2 H),6.79(s,1 H,J=8.0 Hz),6.84(d,1 H),6.89(d,1 H),7.22(d,2 H,J=7.8 Hz),7.89(d,1 H)。
2d:收率:30.8%。分子式:C23H23ClO7,mp112~113 ℃。IR (KBr)光谱显示:在1 606、1 682 cm-1处有C=O的吸收峰。苯环吸收峰:1 644、1 619、1 539、1 528、1 325、1 218、1 051、955、805 cm-1。EI-MS:m/z 446[M]+。1H-NMR(CDCl3,300 MHz)δ:1.69(s,6 H,J=7.8 Hz),3.95(s,3 H,O-H),4.91(d,2 H),5.11(d,2 H),5.31(m,1 H),6.45(d,1 H),6.81(d,2 H),6.71(d,1 H,J=8.0 Hz),6.74(d,2 H),6.98(d,1 H),7.22(d,2 H,J=8.0 Hz)。
2e:收率:37.6%。分子式:C23H23ClO7,mp230~232 ℃。IR (KBr)光谱显示:在1 612、1 691 cm-1处有C=O的吸收峰。苯环吸收峰:2 945、1 761、1 691、1 651、1 595、904、856、771 cm-1。其中,在856、771 cm-1的C-H弯曲振动提示分子中存在苯环的 1,4-二取代。EI-MS:m/z 510[M]+。1H-NMR(CDCl3,300 MHz)δ:1.67(s,6 H,J=8.0 Hz),3.89(s,3 H,O-H),4.34(d,2 H),4.63(d,2 H,J=8.0 Hz),6.41(d,1 H),6.72(d,1 H),6.79(d,2 H),6.82(d,1 H,J=7.8 Hz),6.89(d,1 H),7.19(d,2 H,J=7.8 Hz),7.83(d,1 H,J=8.0 Hz)。
1.4.3 对氯苯氧异丁酸甲氧基苯丙烯酸酰胺(3a-3e)的制备 将对氯苯氧异丁酸甲氧基苯丙烯酸酯(1)2.5 g(6.4 mmol)溶于10 mL无水吡啶中,加入到安装有冷凝回流器和废气处理的三口烧瓶中。在冰浴(0~5 ℃)条件下,缓慢滴加0.8 mL(2.2 g,6.4 mmol)的苯磺酰氯,滴毕,室温条件下继续反应1 h后,继续向反应器中滴加5 mL溶有6.4 mmol乙胺(环丙胺、环氧乙胺、金刚烷胺、茴香胺)的无水吡啶溶液。常温下反应12 h后,将反应液倒入100 g冰水中,溶液显现为淡黄色,静置片刻,烧杯内壁及底部出现淡黄色结晶状物质。静置2 h后,抽滤,滤饼用体积分数1%的盐酸溶液洗涤3次,再用蒸馏水洗涤3次至中性,干燥后的粗品用乙醇、丙酮混合液重结晶,得到目标化合物3a-3e。
3a:收率:26.4%。分子式:C23H26ClNO5,mp185~186 ℃。IR (KBr)光谱显示:在1 608、1 715 cm-1处有C=O的吸收峰。苯环吸收峰:1 758、1 689、1 657、1 591、1 211、911、847、789 cm-1。其中,在847、789 cm-1的C-H弯曲振动提示分子中存在苯环的 1,4-二取代。EI-MS:m/z 431[M]+。1H-NMR(CDCl3,300 MHz)δ:1.09(d,3 H,J=7.8 Hz),1.57(m,2 H),1.63(s,6 H,J=7.8 Hz),2.99(m,2 H),3.76(s,3 H,O-H),6.73(d,2 H),6.79(s,1 H),6.85(d,1 H,J=8.0 Hz),6.88(d,1 H),7.08(d,1 H),7.21(d,2 H,J=8.0 Hz),7.61(d,1 H,J=7.8 Hz),8.24(d,1 H,N-H,J=7.8 Hz)。
3b:收率:10.2%。分子式:C23H24ClNO5,mp163~165 ℃。IR (KBr)光谱显示:在1 613、1 709 cm-1处有两个C=O吸收峰。苯环吸收峰:1 785、1 701、1 664、1 589、1 208、906、852、781 cm-1。其中,在852、781 cm-1的C-H弯曲振动提示分子中存在苯环的1,4-二取代。EI-MS:m/z 429[M]+。1H-NMR(CDCl3,300 MHz)δ:0.31~0.61(m,4 H),1.66(s,6 H,J=8.0 Hz),2.42(m,1 H),3.85(s,3 H,O-H),6.71~6.99(d,6 H),7.21(d,2 H,J=7.8 Hz),7.66(d,1 H,J=8.0 Hz),8.22(d,1 H,N-H,J=8.0 Hz)。
3c:收率:21.8%。分子式:C25H28ClNO6,mp151~152 ℃。IR (KBr)光谱显示:在1 616、1 711 cm-1处有两个C=O吸收峰。苯环吸收峰:1 796、1 689、1 657、1 586、1 211、911、856、775 cm-1。其中,在856、775 cm-1的C-H弯曲振动提示分子中存在苯环的 1,4-二取代。EI-MS:m/z 473[M]+。1H-NMR(CDCl3,300 MHz)δ:1.51(m,2 H),1.67(s,6 H,J=7.8 Hz),2.82(m,1 H),3.11(d,2 H),3.81(s,3 H,O-H,J=7.8 Hz),4.62(d,2 H),5.02(d,2 H),6.69~7.11(d,6 H),7.19(d,2 H,J=8.0 Hz),7.68(d,1 H,J=7.8 Hz),8.19(d,1 H,N-H,J=7.8 Hz)。
3d:收率:49.5%。分子式:C30H34ClNO5,mp201~202 ℃。IR (KBr)光谱显示:在1 612、1 711 cm-1处有两个C=O吸收峰。苯环吸收峰:1 789、1 707、1 662、1 575、1 191、953、848、755 cm-1。其中,在848、755 cm-1的C-H弯曲振动提示分子中存在苯环的 1,4-二取代。EI-MS:m/z 523[M]+。1H-NMR(CDCl3,300 MHz)δ:1.41~2.19(d,12 H),1.47(m,3 H),1.64(s,6 H),3.85(s,3 H,O-H),6.59~7.01(d,6 H,J=7.9 Hz),7.18(d,2 H,J=8.0 Hz),7.59(d,1 H),8.15(d,1 H,N-H,J=7.9 Hz)。
3e:收率:39.5%。分子式:C27H26ClNO6,mp255~256 ℃。IR (KBr)光谱显示:在1 612、1 708 cm-1处有两个C=O吸收峰。苯环吸收峰:1 796、1 689、1 657、1 586、1 211、911、856、775 cm-1。其中,在856、775 cm-1的C-H弯曲振动提示分子中存在苯环的 1,4-二取代。EI-MS:m/z 473[M]+。1H-NMR(CDCl3,300 MHz)δ:1.65(s,6 H,J=8.0 Hz),3.78(s,6 H,O-H,J=8.0 Hz),6.58~7.03(d,10 H),7.25(d,2 H,J=8.0 Hz),7.59(d,1 H,J=8.0 Hz),8.24(d,1 H,N-H)。
2 结果与讨论
2.1 反应时间、介质及催化剂对产率的影响
考察先导化合物对氯苯氧异丁酸甲氧基苯丙烯酸酯的合成试验中反应时间、介质以及催化剂等三方面因素对产率的影响,以得到最佳的反应条件。通过参照相关文献[16],选出4种合成工艺进行考察。分别为:(1)催化剂苯胺和介质二氯甲烷,反应时间6 h;(2)催化剂哌啶及介质吡啶和苯,反应时间3 h;(3)催化剂苯胺及介质吡啶和苯,反应时间6 h;(4)催化剂哌啶及介质吡啶和苯,反应时间12 h。通过工艺考察发现,碱性介质对催化反应的产率影响较大,苯作为带水剂除去反应过程中形成的水,也可大副提高产率。哌啶与苯胺做催化剂,反应都能发生,但哌啶作为催化剂,反应时间对产率影响不大,产率比苯胺低好多。故在实验方法中选择工艺3。考察结果见表2。
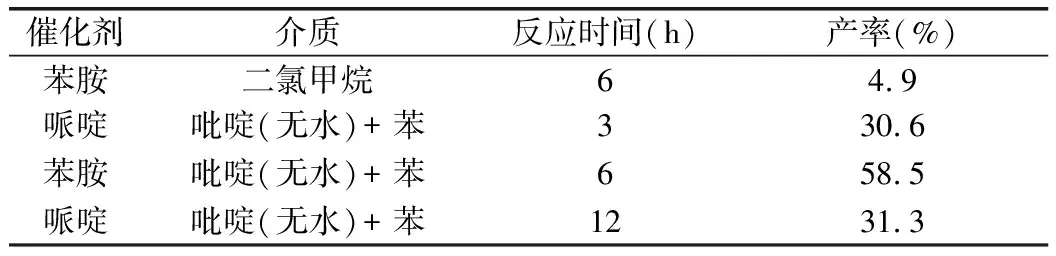
表2 反应时间、介质及催化剂对产率的影响
2.2 目标化合物的降血脂活性

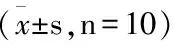

化合物TC mmol·L-1TG mmol·L-1LDL-C mmol·L-1HDL-C mmol·L-1111.28±0.242.63±0.432.18±0.191.54±0.38BG1.89±0.242.15±0.361.05±0.471.14±0.292a11.32±0.75∗∗2.68±0.44∗∗△△2.21±0.47△△1.55±0.12△△2b9.51±0.38∗∗2.18±0.48∗∗△1.94±0.16△△1.21±0.14∗∗2c11.37±0.55∗∗2.71±0.38∗∗△2.24±0.21△△1.61±0.11△2d12.01±0.56∗∗2.68±0.21∗∗△2.25±0.45△△1.71±0.28△2e9.81±0.52∗∗2.23±0.24∗∗△2.09±0.64△△1.34±0.23∗△△3a12.15±0.53∗∗2.84±0.25∗∗△2.25±0.46△△1.57±0.18△3b10.08±0.42∗∗2.34±0.45∗∗△2.05±0.71△△1.26±0.24∗∗3c12.09±0.41∗∗3.12±0.38∗∗△2.54±0.18△△1.61±0.31△3d9.75±0.16∗∗2.21±0.42∗∗△1.97±0.22△△1.22±0.47∗△△3e9.84±0.18∗∗2.24±0.29∗∗△2.11±0.34△△1.33±0.29∗∗
注:与1组比较,*P<0.05,**P<0.01;与空白对照组(BG)相比△P<0.05,△△P<0.01。
由表3可看出,与先导化合物组比较,2b,2e,3b,3d,3e组高脂血症模型大鼠血清中TC、TG、LDL-C和HDL-C的含量均降低,差异具有统计学意义(P<0.01)。其他5个化合物则与先导化合物降血脂活性相当,差异无统计学意义(P>0.05)。结果表明,目标化合物2b,2e,3b,3d,3e在降血脂活性上比先导化合物强,其降血脂机制可能通过对先导化合物的结构修饰得到的新型PPARα激动剂增加了药物的脂溶性,并通过减少肝脏极低密度脂蛋白(VLDL)的合成和分泌来有效降低血中的LDL-C、TG和TC水平。课题组将进一步对这5个目标化合物的降血脂机制深入研究,以获取降脂活性更好的化合物。
3 结论
设计合成了10个新型的PPARα激动剂(E)-4-氯苯氧苯丙烯酸衍生物,合成实验结果表明,该设计合成方法适合用于由小分子的有机酸合成大分子酯类化合物和酰胺胺类,且改进后的合成工艺实验条件温和,收率较高。目标化合物降血脂活性研究表明:合成得到的化合物2b,2e,3b,3d,3e比先导化合物的降脂活性更强,其降血脂机制可能与这5个化合物增加了先导化合物的脂溶性有关,今后将进一步深入研究其降脂活性的机制。

