喷施ALA对紫花苜蓿耐热性的诱导效应
李宛宣,王世敏,赵 雁
(1. 云南农业大学园林园艺学院, 云南 昆明 650201; 2. 昭通学院农学与生命科学学院,云南 昭通 657000)
5-氨基乙酰丙酸(5-aminolevulinic acid,ALA)广泛存在于细菌、真菌和动植物细胞中,是叶绿素、维生素和亚铁红素等所有四氢吡咯化合物的合成前体[1-2]。ALA也是一种潜在的植物生长调节剂,能增加植物叶绿素的相对含量,提高植物光合作用,调控植物生长和产量,如月季(Rosahybrida)[3]、彩色马蹄莲(Zantedeschiahybrida)[4]、马铃薯(Solanumtuberosum)[5]和水稻(Oryzasativa)[6]。给植物喷施ALA溶液有利于提高植物对多种非生物胁迫的抗性[7],ALA可以提高叶片中的抗氧化酶(过氧化物酶(Peroxidase,POD);抗坏血酸过氧化物酶(Ascorbate peroxidase,APX);超氧化物歧化酶(Superoxide dismutase,SOD)等)活性,提高植株清除活性氧(Reactive oxygen species,ROS)的能力,降低丙二醛(Malonydialdehyde,MDA)含量和相对电导率,控制膜脂过氧化物的产生和大量电解质的外渗,稳定生物膜的完整性,增强葡萄(Vitisvinifera)的抗盐性[8]和玉米(Zeamays)的抗冷性[9]。此外,ALA还能通过保护光系统II、提高光合运转速率,增强小麦(Triticumaestivum)[10]和草地早熟禾(Poapratensis)的抗旱性[11];能通过上调关键基因表达量,增强黄瓜(Cucumissativus)的抗热性[12]和油菜(Brassicanapus)的抗盐性[13]。
紫花苜蓿(MedicagosativaL.)是世界范围内广泛栽培的豆科牧草,具有地面覆盖率(10%~100%)大、根系深而发达、固氮能力强的特点,也是改善生态环境的优良草种[14-16],但高温是限制其在热带和亚热带地区应用的非生物胁迫之一[17]。高温胁迫会诱导紫花苜蓿细胞产生高浓度的ROS,进而破坏细胞膜系统的相对完整性,导致MDA含量和相对电导率上升,因此MDA含量和相对电导率常作为衡量高温胁迫下植物受害程度的指标[18-19]。此外,高温胁迫还会降低紫花苜蓿的光合作用和呼吸效率,造成植物叶片萎焉、生长缓慢和病虫害增多,影响其产量和品质[20-22]。植物为了适应环境,通过应激反应,会诱导抗氧化酶活性来提高植物抗性[23]。过氧化物酶(Peroxidase,POD)是植物清除ROS的抗氧化酶之一,为典型的热敏感酶和诱导酶,其活性变化间接反映紫花苜蓿耐热性的强弱[24-25]。目前,ALA缓解紫花苜蓿高温胁迫伤害的研究未见报道。本研究以云南地方品种‘德钦’紫花苜蓿(M.sativaL. ‘Deqin’)为材料,探究在高温胁迫下喷施不同浓度ALA对其生长发育和生理生化的影响,以期为提高紫花苜蓿耐热性和生产力提供理论依据。
1 材料与方法
1.1 供试材料
供试材料为‘德钦’紫花苜蓿,由毕玉芬教授提供。将当年采收的种子播于花盆中(基质为蛭石50%+珍珠岩50%),放置于光照培养箱内,温度为23℃/20℃(白/夜),光周期为16 h/8 h(白/夜),相对湿度为65%,光强为400 μmol·m-2·s-1,每隔2 d浇霍格兰营养液200 mL。8周后紫花苜蓿处于营养生长期,留下健康、生长一致的小苗进行药剂喷施和高温胁迫。
1.2 高温胁迫方法
药剂ALA来源于苏州纳美特生物科技有限公司,由吴红芝教授提供。将4个不同浓度的[0 mg·L-1(清水对照,CK),10 mg·L-1,30 mg·L-1,50 mg·L-1]ALA溶液喷施于紫花苜蓿叶面,喷施药剂的时间参照梁金凤[26]的方法并稍加修改,喷施1.5 h后置于人工气候箱中进行空气高温胁迫,胁迫48 h后迅速喷施相同浓度的ALA溶液,再次胁迫48 h后测定紫花苜蓿的生理和形态指标。胁迫温度为35℃/25℃(白/夜),光周期为16 h/8 h (白/夜),相对湿度为65%,光强为400 μmol·m-2·s-1,每隔2 d浇霍格兰营养液200 mL。每个浓度处理5盆,每盆1棵苗,用3盆测定形态指标,用2盆测定生理指标,试验重复3次。
1.3 指标测定
1.3.1形态指标测定 参照梁金凤[26]的方法并稍加修改,测定12棵紫花苜蓿在高温胁迫前,每棵苗的叶片数、分枝数和生物量,并进行挂牌标记。高温胁迫后,测定每个浓度处理后3棵苗的3个指标,计算平均每棵苗的叶片增长率、分枝增长率和生物量增长率。
叶片增长率=(胁迫后的叶片数-胁迫前的叶片数)/胁迫前的叶片数×100%
分枝增长率=(胁迫后的分枝数-胁迫前的分枝数)/胁迫前的分枝数×100%
生物量增长率=(胁迫后的生物量-胁迫前的生物量)/胁迫前的生物量×100%
1.3.2相对电导率测定 参照叶尚红[27]的方法稍加改良,称取0.2 g叶位相同并完全展开的新鲜叶片,避开主脉剪成大小一致的叶块放入试管中,加入15 mL蒸馏水,在室温下放置30 min,测定电导率S1。置沸水浴中20 min,冷却后测定电导率S2,并测定蒸馏水电导率S0,按下列公式计算相对电导率。
相对电导率(%)=(S1-S0)/(S2-S0)×100%
1.3.3叶绿体色素含量测定 叶绿体色素包含总叶绿素(叶绿素a、叶绿素b)和类胡萝卜素,测定参照叶尚红[27]的方法并稍加改良。称取0.1 g叶位相同并完全展开的新鲜叶片,用25 mL 80%的丙酮放黑暗条件下浸泡24 h,用分光光度计测定波长663 nm,646 nm和470 nm的光吸收值,并按下列公式分别计算叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量。
Ca(叶绿素a浓度)=12.21A663-2.81A646;
Cb(叶绿素b浓度)=20.13A646-5.03A663;
Cx(类胡萝卜素)=(1000A470-3.27Ca-104Cb)/229;
C(叶绿素总浓度)=Ca+Cb;
叶绿体色素含量(mg·g-1)=[C(mg·L-1)×提取液总量(ml)]/[叶样重量(g)×1 000]
其中A470,A646和A663分别代表待测液在470 nm,646 nm和663 nm波长下的吸光度值。
1.3.4MDA含量测定 参照叶尚红[27]的方法稍加改良,称取0.3 g叶位相同并完全展开的新鲜叶片,加入2 mL蒸馏水和少量石英砂研磨至匀浆,转移到20 mL刻度试管中,再用3 mL蒸馏水分两次冲洗研钵合并提取液。另取一支刻度试管,加入5 mL蒸馏水作空白对照。在提取液和空白对照中各加入0.5%硫代巴比妥酸溶液5 mL,在沸水浴上反应15 min,取出试管冷却后记下液体体积。转入离心管中,3 000 rpm离心10 min,取上清液至1 cm比色皿中,测定在450 nm,532 nm和600 nm波长下的光吸收值,并按下列公式计算MDA含量。
提取液中MDA浓度(μmol·L-1)=(A532-A600) / (0.155×L)-0.56×A450
鲜组织中MDA含量(nmol·g-1)=提取液中MDA浓度×V(mL)/W(g)
其中A450,A532和A600分别代表待测液在450 nm,532 nm和600 nm波长下的吸光度值,V为提取液总体积(mL),W为样品重量(g),L为比色皿厚度(cm)。
1.3.5POD活性测定 参照李合生[28]的方法稍加改良,称取0.2 g叶位相同并完全展开的新鲜叶片,在冰浴上预冷的研钵中加入2 mL预冷磷酸缓冲液(0.05 mol·L-1,pH5.5)混合研磨成匀浆。4℃ 3 000 rpm离心10 min,上清液转入25 mL容量瓶中,沉淀用磷酸缓冲液反复提取两次,并转入容量瓶,最后定容至—80℃低温保存。POD酶反应体系为:2.9 mL 0.05 mol·L-1磷酸缓冲液、1 mL 2% H2O2、1 mL 0.05 mol·L-1的愈创木酚和0.1 mL酶液。用煮沸10 min酶液作对照,反应体系加入酶液后,立即在35℃的水浴中保温3 min,然后用分光光度计测定波长470 nm的光吸收值A470,每隔1 min记录1次吸光度,共记录9次,然后以每分钟内A470变化0.01为1个酶活性单位[μ·(g·min)-1],并按下列公式计算POD活性。
POD活性=△A470×VT/(W×VS×0.01×t)
其中:△A470为反应时间内吸光度的变化值,W为样品鲜重(g),t为反应时间(min),VT为提取酶液总体积(mL),VS为测定时取用酶液体积(mL)。
1.4 数据处理
用Excel和SPSS 17.0软件进行数据分析。
2 结果与分析
2.1 ALA对紫花苜蓿MDA含量的影响
由图1可知,对照(CK)与喷施不同浓度的ALA溶液相比,紫花苜蓿的MDA含量最高,差异不显著。随着ALA浓度的增加,MDA含量持续降低,但差异不显著。在ALA浓度为50 mg·L-1时,紫花苜蓿MDA含量最低。
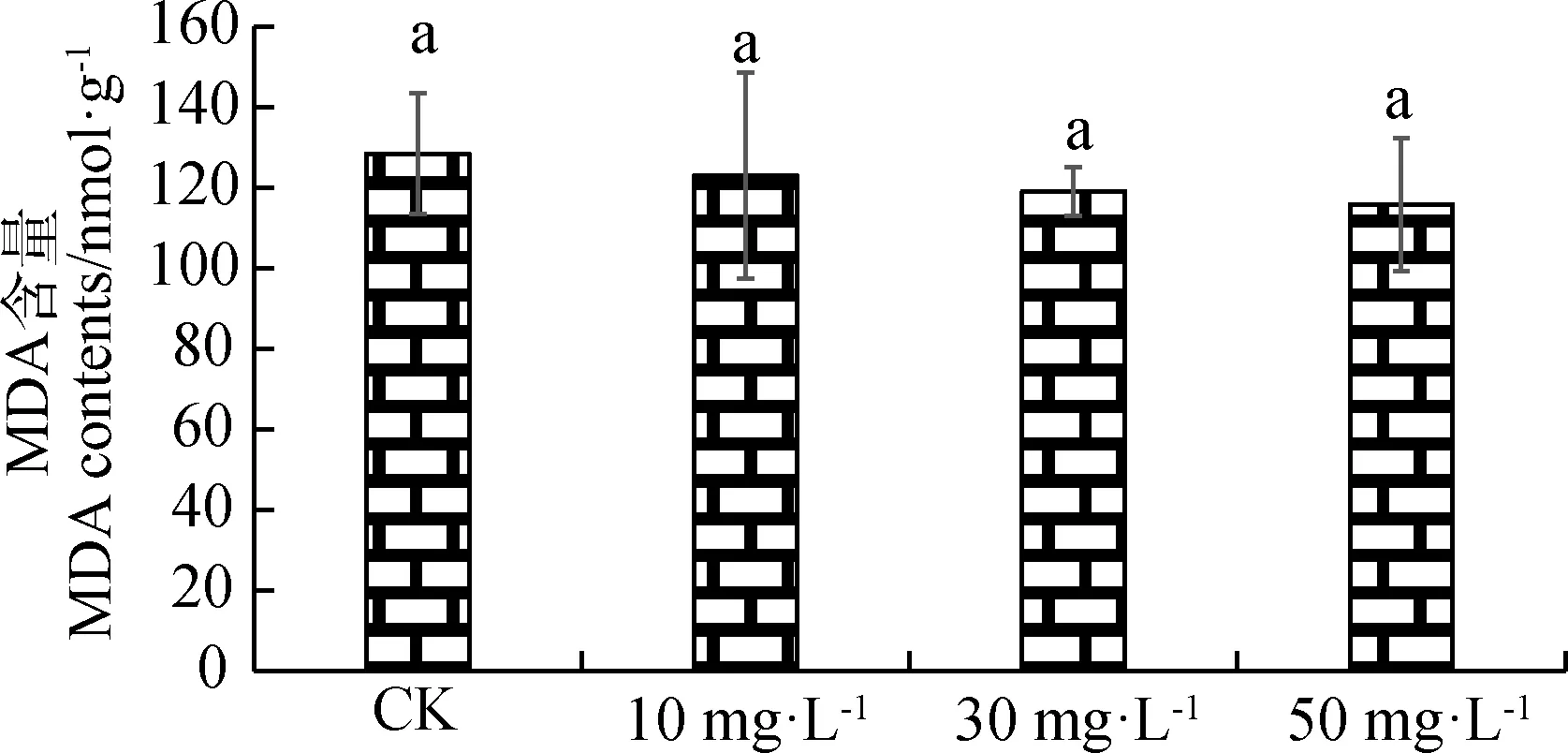
图1 不同浓度ALA对紫花苜蓿MAD含量的影响
2.2 ALA对紫花苜蓿相对电导率的影响
由图2可知,CK与喷施不同浓度的ALA溶液相比,紫花苜蓿的相对电导率最高,差异显著(P<0.05)。随着ALA浓度的增加,相对电导率先降低后升高,但差异不显著。在ALA浓度为30 mg·L-1时,紫花苜蓿的相对电导率最低。
2.3 ALA对紫花苜蓿POD活性的影响
由图3可知,CK与喷施不同浓度的ALA溶液相比,紫花苜蓿的POD活性最低。随着ALA浓度的增加,POD活性持续降低,但差异不显著。在ALA浓度为10 mg·L-1时,紫花苜蓿的POD活性最高,与对照相比,差异显著(P<0.05)。
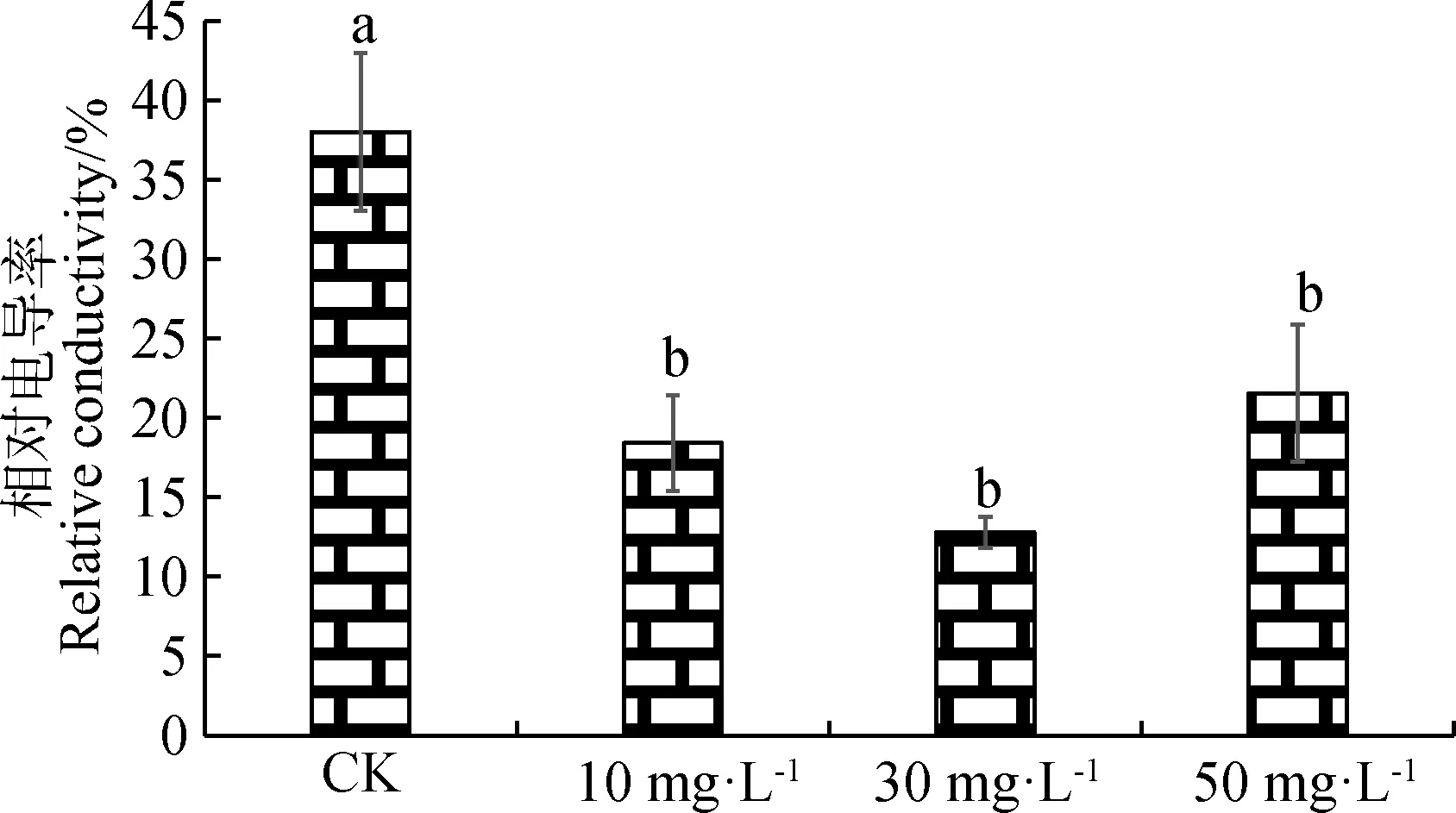
图2 不同浓度ALA对紫花苜蓿相对电导率的影响

图3 不同浓度ALA对紫花苜蓿POD活性的影响
2.4 ALA对紫花苜蓿形态特征的影响
由表1可知,喷施不同浓度的ALA溶液能影响高温胁迫后的紫花苜蓿分枝数、叶片数和生物量。在ALA浓度为0 mg·L-1(CK)时,分枝数、叶片数和生物量的增长率都呈负增长。喷施ALA溶液的处理与CK相比,分枝数和叶片数的增长率不显著,但喷施药剂的增长效果比不喷施的效果好。在ALA浓度为10 mg·L-1时,叶片数增长率最高达12%,分枝数和生物量的增长率呈负增长;与CK相比,3个指标差异不显著,分枝数增长率有所增加,生物量增长率有所降低。在ALA浓度为30 mg·L-1时,生物量增长率最高达16%,差异显著(P<0.05),且叶片数增长率呈正增长,分枝数增长率与CK相比有所增加。在ALA浓度为50 mg·L-1时,分枝数增长率最高达31%,叶片数和生物量呈负增长。
2.5 ALA对紫花苜蓿叶绿体色素含量的影响
由图4可知,喷施不同浓度的ALA溶液能影响高温胁迫后紫花苜蓿叶绿体色素的含量。随着ALA浓度的增加,叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量先增高后降低。在ALA浓度为30 mg·L-1时,叶绿素a、叶绿素b、总叶绿素和类胡萝卜素的含量最高,与CK相比,差异不显著。在ALA浓度为10 mg·L-1时,叶绿素a、总叶绿素和类胡萝卜素的含量最低,与ALA浓度为30 mg·L-1时相比,差异显著(P<0.05)。
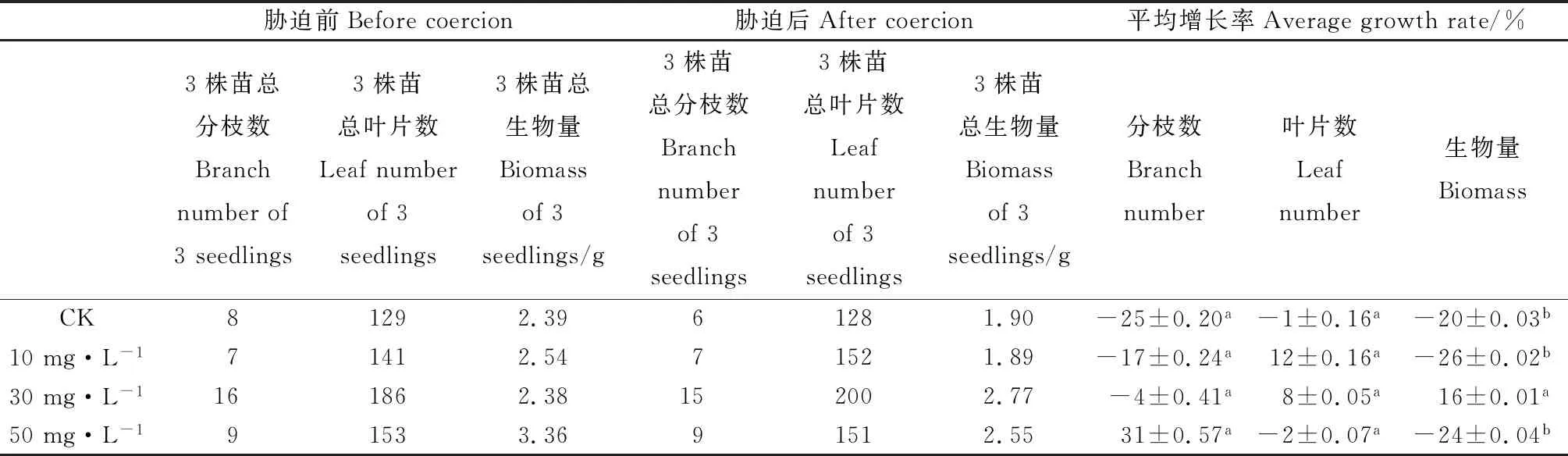
表1 不同浓度ALA对紫花苜蓿形态指标的影响
注:不同小写字母表示纵向差异显著(P<0.05)
Note:Different lowercase letters indicate significant longitudinal difference at the 0.05 level
2.6 高温条件下紫花苜蓿各形态指标和生理指标的相关分析
由表2可知,高温胁迫下紫花苜蓿的分枝数增长率、叶片数增长率、生物量增长率、相对电导率、类胡萝卜素含量、MDA含量和POD活性两两指标之间的相关性不显著。叶绿素a与叶绿素b (r=1.00,P<0.01)、总叶绿素(r= 1.00,P<0.01)和类胡萝卜素(r= 0.96,P<0.05)含量呈正相关,与MDA含量、POD活性相关性不显著。叶绿素b与总叶绿素(r= 1.00,P<0.01)、类胡萝卜素(r=1.00,P<0.05)含量呈正相关,与MDA含量、POD活性相关性不显著。总叶绿素与类胡萝卜素(r= 1.00,P<0.05)含量呈正相关,与MDA含量、POD活性相关性不显著。
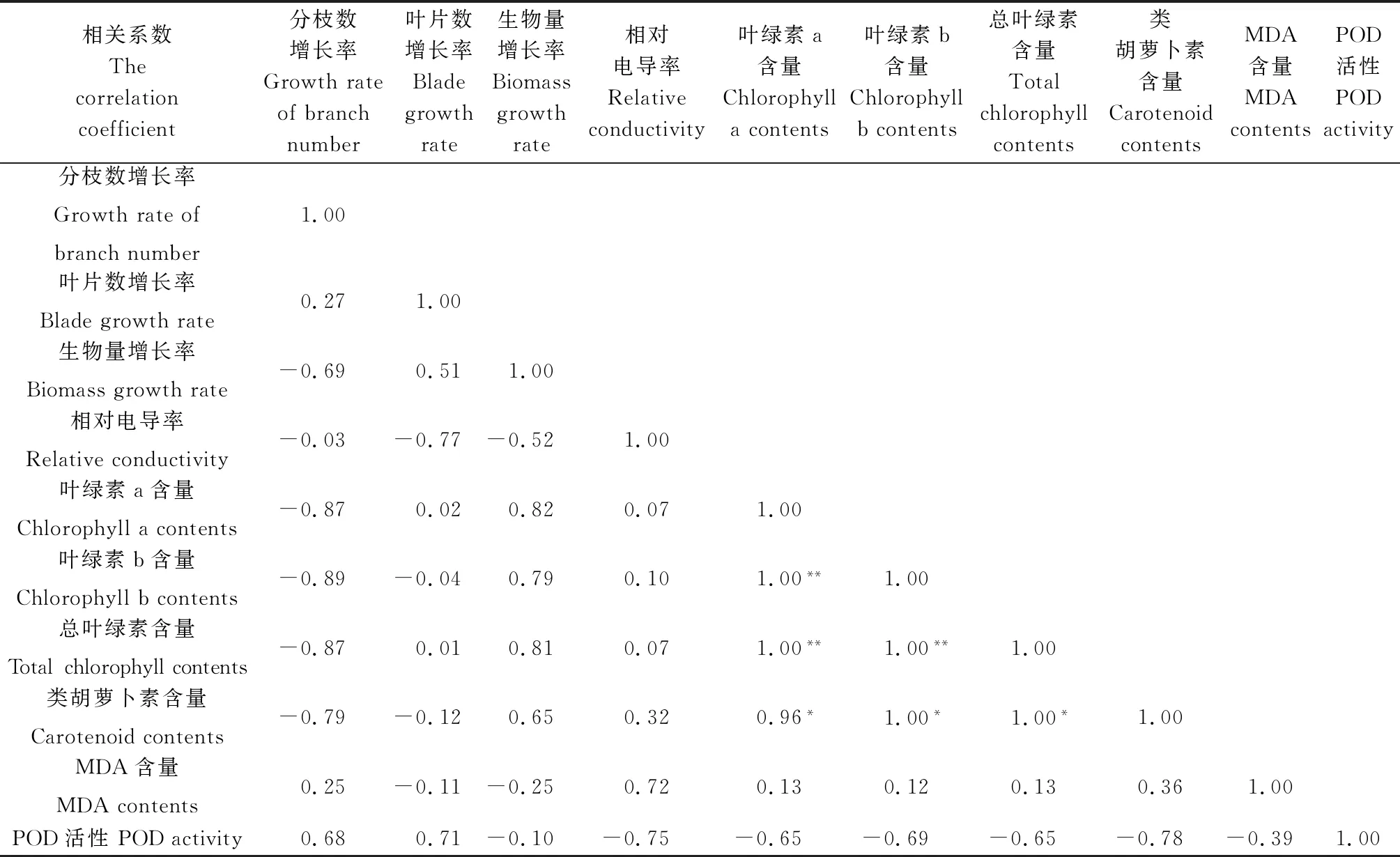
相关系数Thecorrelationcoefficient分枝数增长率Growthrateofbranchnumber叶片数增长率Bladegrowthrate生物量增长率Biomassgrowthrate相对电导率Relativeconductivity叶绿素a含量Chlorophyllacontents叶绿素b含量Chlorophyllbcontents总叶绿素含量Totalchlorophyllcontents类胡萝卜素含量CarotenoidcontentsMDA含量MDAcontentsPOD活性PODactivity分枝数增长率Growthrateofbranchnumber1.00叶片数增长率Bladegrowthrate0.271.00生物量增长率Biomassgrowthrate-0.690.511.00相对电导率Relativeconductivity-0.03-0.77-0.521.00叶绿素a含量Chlorophyllacontents-0.870.020.820.071.00叶绿素b含量Chlorophyllbcontents-0.89-0.040.790.101.00**1.00总叶绿素含量Totalchlorophyllcontents-0.870.010.810.071.00**1.00**1.00类胡萝卜素含量Carotenoidcontents-0.79-0.120.650.320.96*1.00*1.00*1.00MDA含量MDAcontents0.25-0.11-0.250.720.130.120.130.361.00POD活性PODactivity0.680.71-0.10-0.75-0.65-0.69-0.65-0.78-0.391.00
注:*表示相关性显著(P<0.05),**表示相关性极显著(P<0.01)
Note:* indicates significant correlation at the 0.05 level,and ** indicates extremely significant correlation at the 0.01 level
3 讨论
3.1 喷施ALA提高紫花苜蓿的抗热性
当植物受到高温胁迫时,大量的ROS会加深细胞膜脂过氧化损伤和破坏细胞膜的相对完整性,进一步引起各项代谢活动内环境遭受破坏[25]。MDA是细胞膜脂过氧化的最终产物,其含量的高低间接反应植物受伤害的程度[29]。此外,细胞膜的相对完整性被破坏,大量电解质外渗,进而导致膜功能紊乱和植株伤害[30]。MDA含量和相对电导率常用于衡量植物遭受高温伤害程度的指标[31],如肇东苜蓿(M.sativaL. cv. Zhaodong)[29]、不结球白菜(Brassicacampestrisssp.chinensis)[32]、菜豆(Phaseolusvulgaris)[33]、大豆(Glycinemax)[34]等。在抗逆性研究中,ALA在提高植物的抗逆性方向中具有广阔的应用前景[35]。ALA是具有多种生物活性的非蛋白氨基酸,可作为植物的一种外源生长调节剂,对缓解植物抗热胁迫具有重要作用[36-37]。在本试验中,喷施不同浓度的ALA溶液与CK相比,MDA含量和相对电导率都低,说明高温破坏了紫花苜蓿细胞膜系统,喷施ALA有利于降低细胞膜脂过氧化程度和细胞膜通透性,提高细胞膜的相对稳定性。随着ALA浓度的增加,MDA含量逐渐降低,相对电导率先降低后升高,这可能与高浓度的ALA溶液能增加紫花苜蓿细胞电解质的流动性有关。
3.2 ALA调控紫花苜蓿在高温胁迫下的生长
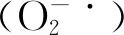
4 结论
本试验以‘德钦’紫花苜蓿为材料,观察高温胁迫下喷施不同浓度的ALA对紫花苜蓿形态和生理指标的影响。在叶面喷施30 mg·L-1浓度的ALA溶液时,有利于提高紫花苜蓿叶片中POD活性、降低细胞膜过氧化程度和细胞膜通透性,进而保护细胞叶绿体色素和增加其干物质的积累,促进植株的生长发育。

