基于SERS技术的靶向修饰金纳米探针用于Hela细胞的检测
冯雨晴, 李 奚
(长春工业大学 化学与生命科学学院, 吉林 长春 130012)
1 引 言
癌症的早期诊断可以增加癌症的治愈率并提高癌症患者的生存率。因此,开发具有高灵敏度的特异性癌症精确诊断工具非常重要[1]。拉曼光谱(Raman)是一种研究生物分子的重要分析方法,但存在信号微弱的缺点[2]。随着激光及纳米技术的进步,利用纳米金属材料(如金、银)的表面等离子体共振效应(Surface plasmon resonance,SPR)发展起来的表面增强拉曼散射光谱(Surface-enhanced Raman scattering,SERS)可使纳米材料表面分子的拉曼信号强度增大103~106倍[3],从而使其成为一种检测痕量生物分子的重要工具,并应用于肿瘤标记物的鉴定[4-6]。其中,具有优良生物相容性的金纳米棒(Gold nanorods, AuNRs)由于制备简易、稳定性高、消光系数大且纵向 SPR吸收峰(LSPR)从可见区到近红外区连续可调[7],从而表现出较好的光学性能而在体外SERS癌症诊断应用中受到广泛关注[7-8]。
表皮生长因子受体(Epidermal growth factor receptor,EGFR)是一种由EGFR基因编码的蛋白[9]。在EGFR基因发生突变后会引起EGFR蛋白过量表达,在细胞膜表面组装,导致细胞膜表面表皮生长因子受体过多,可结合大量表皮生长因子(Epidermal growth factor,EGF),加速促进细胞异常生长和分裂,最终导致肿瘤产生[10-11]。因此,EGFR蛋白可作为肿瘤标志物用于癌症早期诊断。本文针对SERS光谱的激发波长在785 nm,设计合成了LSPR吸收峰在785 nm的AuNRs以最大程度提高对吸收光的利用效率,并在AuNRs表面修饰了能够特异性结合EGFR的抗体Anti-EGFR,利用经典SERS探针分子4-MBA信号的变化,用于检测细胞表面肿瘤标志物EGFR。
2 实 验
2.1 试剂与仪器
人宫颈癌Hela细胞株、人肾上皮HEK-293细胞株购置于中科院上海细胞库。DMEM培养基、二甲基亚砜(DMSO)、MTT检测试剂盒为Thermo公司产品。对羟基苯甲酸(4-MBA)、聚乙二醇(m-PEG)购自Sigma公司。人表皮生长因子抗体(EGFR)为生工产品。细胞培养瓶、爬片、96孔板、6孔板为NEST公司产品。
透射电子显微镜(FEI Tecnai G2 F20 日本电子),加速电压30 kV;共聚焦拉曼光谱仪(alpha300R,美国WITEC),用785 nm的半导体激光器作光源,超快速拉曼光谱成像,光谱范围400~4 000 cm-1,扫描时间15 s。全自动酶联免疫检测仪(BIOTEK ELx800);台式离心机(美国,THERMO FISHER);激光共聚焦扫描显微镜(德国,Leica)。
2.2 金纳米探针的合成
金纳米棒(AuNRs)的合成采用文献报道的晶体生长法[12]。首先合成种子溶液:向5 mL、0.2 mol·L-1CTAB(十六烷基三甲基溴化铵)溶液中加入5 mL、0.5 mmol·L-1氯金酸;再加入0.6 mL、0.01 mol·L-1新鲜配置的冰的硼氢化钠,而后放入30 ℃水浴中静置老化2 h后备用。金纳米棒的生长:将0.060 8 g CTAB加入到33 mL水中,加热溶解,加入10 μL 0.01 mol·L-1硝酸银,然后加入22.5 mmol·L-1氯金酸溶液297 μL,加入0.24 mL 0.1 mol·L-1的AA还原,溶液由黄色变透明,期间不断搅拌;最后加入20 μL上述种子溶液后快速搅拌2 min后静置过夜,让金种生长为金棒。离心(10 000 r/min,12 min)洗涤两次,将纯化后的金纳米棒分散在超纯水中备用。向合成的2 mL金纳米棒溶胶中加入8.5 μL 10 μmol·L-1的4-MBA(4-巯基苯甲酸),反应过夜;14 000 r/min离心15 min,小心去除上层溶液,重分散在灭菌水中。按照上述步骤重复清洗2~3遍,再加入20 μL 20 mmol·L-1mPEG-SH过夜反应,重复上述清洗步骤除去多余未反应的PEG;之后再加入EGFR(pH=7.2的PBS缓冲溶液),过夜反应。重复上述清洗步骤,重分散在2.0 mL灭菌水中备用。
2.3 细胞毒性检测
进行AuNRs与靶向修饰的AuNRs粒子的细胞MTS毒性检测,96孔板检测,平行实验6组。取对数生长期的HEK-293(人肾上皮细胞)细胞进行铺板,单孔细胞容量104,过夜培养,细胞贴壁后,于对照组中加入培养液、实验组分别加入不同浓度的两种AuNRs继续孵育培养过夜。细胞与两种纳米粒子共孵育24 h后加入MTS试剂(每孔10 μL),继续培养2 h后用酶标仪读数,计算细胞存活率并绘制图表。将靶向修饰的金纳米棒与Hela细胞(人宫颈癌细胞)共孵育24 h后进行暗场成像,对照组采用HEK-293细胞(人肾上皮细胞)。
2.4 SERS检测
拉曼检测如下:仪器用硅片校准,拉曼峰位于520 cm-1,光谱范围600~1 800 cm-1,样品激发波长为785 nm,激光实际功率5 mW,积累时间10 s。对于细胞SERS检测,将粒子与细胞共孵育24 h后,选择激发波长785 nm,激光实际功率5 mW,累计时间10 s,光谱范围600~1 800 cm-1,测20个细胞得到平均SERS光谱。
3 结果与讨论
3.1 金纳米棒探针的表征
Anti-EGFR功能化金纳米棒AuNRs probes可通过透射电子显微镜(TEM)进行形貌表征,如图1所示。AuNRs probes形态均一,平均粒径约为(42±11) nm(共统计328个金纳米棒粒子),长径比约为3.8。将金纳米棒近似看作一个圆柱体,通过电感耦合等离子体发射光谱测定(Inductively coupled plasma optical emission spectrometer,ICP-OES),可计算出AuNRs probes粒子浓度为1.31×1012/mL[13],用于定量功能化修饰。

图1 Anti-EGFR功能化的金纳米棒AuNRs probes透射电镜图
Fig.1 TEM image of AuNRs probes
图2分别为金纳米棒AuNRs、AuNRs-MBA和AuNRs probes的可见吸收光谱(图2(a))和SERS谱(图2(b))。由图可见,在785 nm处AuNRs有明显LSPR吸收峰,当AuNRs表面修饰拉曼染料4-MBA后,LSPR峰红移15 nm至790 nm,且在SERS谱图上1 100 cm-1与1 600 cm-1左右出现了特征峰,分别对应于4-MBA分子的苯环呼吸特征振动和轴向变形振动[14]。单个拉曼染料4-MBA分子所占面积约为0.20 nm2,可估算出加入4-MBA的量为0.042 μmol·L-1,使其只占据金纳米棒表面约50%,可以用于进一步修饰靶向性Anti-EGFR分子。当Anti-EGFR分子连接到AuNRs-MBA后,其可见吸收光谱LSPR峰红移30 nm至820 nm,证明Anti-EGFR分子已被成功地修饰到金纳米棒表面,与此同时,金纳米棒表面SERS信号分子4-MBA的特征峰的峰位及强度未发生明显变化,可用于下一步SERS检测。
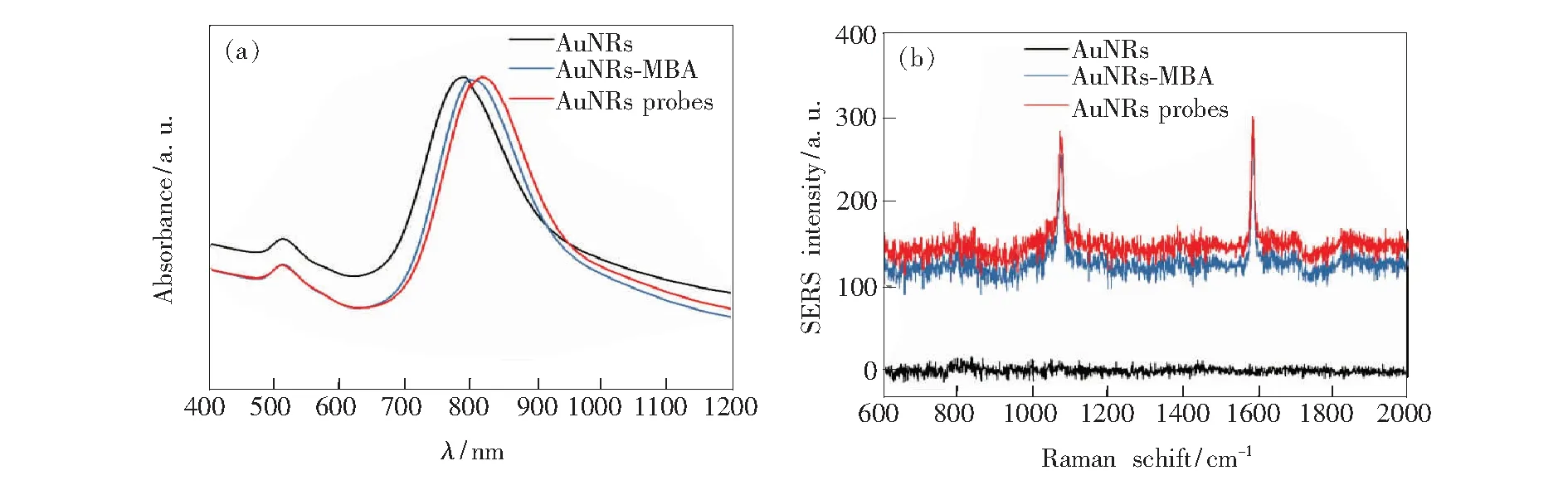
图2 金纳米棒的紫外吸收光谱(a)和SERS光谱(b)
3.2 金纳米棒探针细胞毒性检测及暗场成像
由于金纳米材料的强散射特性,可以用暗场显微镜来研究纳米金颗粒与细胞的相互作用。图3(a)是anti-EGFR靶向修饰AuNRs probes与HEK-293细胞暗场成像显微镜图片,由于HEK-293细胞表面呈EFGR阴性,AuNRs probe不能与HEK-293产生特异性结合,因此未见大量金纳米棒聚集于HEK-293细胞处。图3(b)是AuNRs probes与Hela细胞暗场成像,由于Hela癌细胞表面特异性表达EGFR,可与AuNRs probes上修饰的Anti-EFGR产生特异性识别,从而从暗场成像下我们观察到anti-EGFR功能化的AuNRs probes可与Hela细胞发生相互作用,聚集在细胞边缘处。并且通过MTS实验可证实(图3(c)),AuNRs probes生物兼容性较好,可用于进一步体内拉曼成像显影检测。
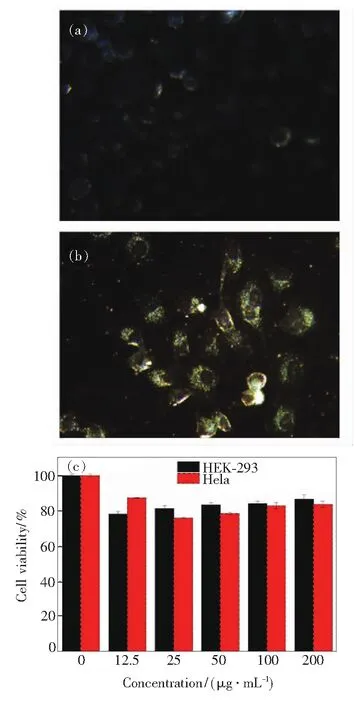
图3 AuNRs纳米棒与HEK-293细胞(a)、Hela细胞(b)作用的暗场成像及细胞毒性MTS实验结果(c)。
Fig.3 Dark field images of HEK-293 cell(a), Hela cell(b) incubated with AuNRs probes and cell viability detection by MTS assay(c).
3.3 金纳米棒探针细胞SERS检测
将AuNRs-MBA和AuNRs probes分别与HEK-293细胞(EGFR阴性)和Hela细胞(EGFR阳性)共孵育24 h后进行SERS检测。如图4所示,无论是AuNRs-MBA还是AuNRs probes,位于1 100 cm-1和1 600 cm-1处拉曼信号分子4-MBA的特征吸收峰依然存在,由此证明AuNRs probes结构稳定适合用于活体细胞SERS检测。由于细胞表面过表达的EGFR可与AuNRs probes 表面的Anti-EGFR产生特异性结合,从而使AuNRs probes大量聚集在Hela细胞表面(如图3(b)),与Hela细胞共孵育测得AuNRs probes上4-MBA分子的1 100 cm-1和1 600 cm-1处的信号相较于通过非特异性吸附于细胞的AuNRs-MBA分别增强2.2倍和2.4倍;与此同时,AuNRs-MBA和AuNRs probes 与HEK-293细胞共孵育后,SERS特征峰强度变化不大(1 100 cm-1和1 600 cm-1处的信号分别增强1.2倍和1.3倍)。因此可通过比较与AuNRs-MBA和AuNRs probes共孵育前后SERS信号的变化来诊断表面肿瘤标记物EGFR阳性的癌细胞。
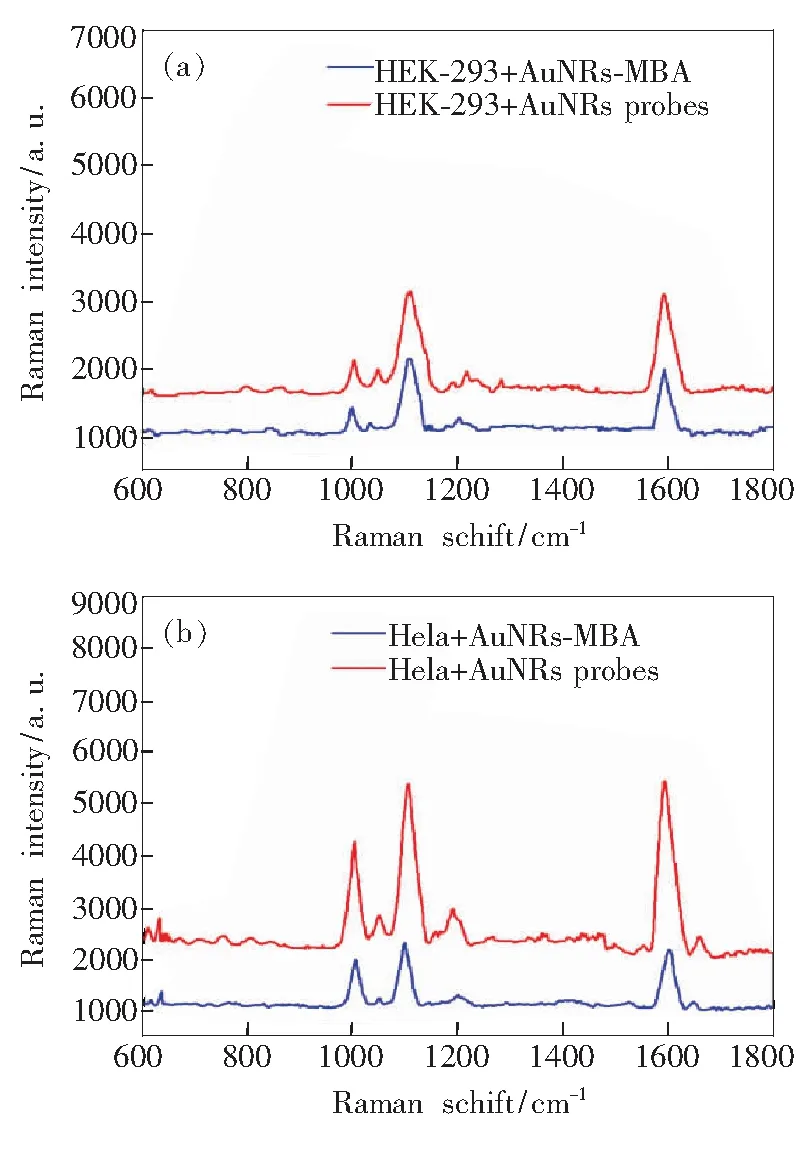
图4 细胞与AuNRs纳米棒共孵育24 h后的SERS光谱。 (a)HEK-293细胞;(b)粒子与Hela细胞。
Fig.4 SERS spectra of cell. (a) HEK-293 cell. (b) Hela cell.
4 结 论
我们通过共价修饰合成了生物兼容性好、且在细胞环境具有稳定SERS信号的EGFR细胞靶向的金纳米探针AuNRs probes。通过该AuNRs probes表面修饰的Anti-EGFR与癌细胞表面过表达的EGFR特异性识别,可使AuNRs probes更为有效地结合于癌细胞表面,使该探针上拉曼活性分子4-MBA在1 000 cm-1和1 600 cm-1的拉曼信号得到增强,对癌细胞进行高灵敏度检测,为临床新型癌症早期筛查方法的研究提供了新的思路和实验依据。

