络合掩蔽-中和滴定法测定湿法炼锌浸出液中的硫酸含量
王贤果
﹙云南永昌铅锌股份有限公司,云南 保山 678307﹚
0 引 言
湿法炼锌的基本原理是利用硫酸作溶剂,将矿石中的锌浸出到溶液中来,净化除去溶液中的杂质,通过电积使锌析出在阴极板上,熔铸后得到锌锭。在湿法冶炼过程中,调浆液、沉矾前液、沉矾后液、氧压酸浸液、高酸浸出前液、高酸浸出后液等溶液中还含有一定的硫酸,在生产过程中,由于需要根据溶液中的硫酸含量来计算中和剂的加入量,所以就需要对调浆液、沉矾前液、沉矾后液、氧压酸浸液、高酸浸出前液、高酸浸出后液等过程溶液中的硫酸含量进行测定,为后续生产提供决策依据。由于对矿石进行浸出过程中,矿石中的杂质元素与锌一同浸出溶液中,采用常规中和滴定法,由于溶液中铁离子的干扰,滴定前后试样溶液呈现浑浊状态,无法出示分析结果,不能为湿法炼锌生产提供决策依据。。采用络合掩蔽—中和滴定法测定湿法炼锌生产浸出液中的硫酸含量,Na2EDTA-CaCl2中性混合液掩蔽了浸出液中的铁,滴定前、后试样溶液清亮,能准确、快速的出示分析结果,为湿法炼锌生产提供了决策依据。
1 试验部分
1.1 主要试剂
1)溴甲酚绿溶液﹙0.1 %﹚:称取分析纯溴甲酚绿0.05 g溶于适量无水乙醇中,并用无水乙醇稀释至50 ml,混匀。
2)甲基红溶液﹙0.2 %﹚:称取分析纯甲基红0.1 g溶于适量无水乙醇中,并用无水乙醇稀释至50 ml,混匀。
3)溴甲酚绿—甲基红混合指示剂:溴甲酚绿(2.1.1)和甲基红(2.1.2)按(3+1)混匀。
4)乙二胺四乙酸二钠溶液(10 %):称取分析纯乙二胺四乙酸二钠10 g溶于适量水中,加热溶解完全后,冷却至室温,用水稀释至100 ml,混匀。
5)分析氯化钙溶液(5 %):称取分析纯氯化钙5 g溶于适量水中,并用水稀释至100 ml,混匀。
6)氢氧化钠溶液(10 %):称取分析纯氢氧化钠50 g溶于适量水中,并用水稀释至100 ml,混匀。
7)乙二胺四乙酸二钠-氯化钙中性混合溶液:氯化钙溶液(2.1.4)和乙二胺四乙酸二钠溶液(2.1.5)按(1+1)混匀后,加3-4滴溴甲酚绿—甲基红混合指示剂(2.1.3),用氢氧化钠溶液(2.1.6)调至PH=7(用PH试纸检测)。
8)酚酞(1 %):称取分析纯酚酞0.5 g溶于适量无水乙醇中,并用无水乙醇稀释至50 ml,混匀。
9)氢氧化钠标准滴定溶液[c(NaOH)≈0.06 mol/L]
(1)配制:把500 g优级纯氢氧化钠分多次加入加热至沸腾30 min后冷却至室温的500 ml蒸馏水中,混匀放置三天后,用塑料量杯量取15 ml放入适量的加热至沸腾30 min后冷却至室温的500 ml蒸馏水中,并用加热至沸腾30 min后冷却至室温的蒸馏水稀释至5 000 ml,混匀,放置一天后待标定。
(2)标定:准确称取基准试剂邻苯二甲酸氢钾(在105~110℃干燥2 h,并在干燥器冷却至室温)0.40 g于500 ml三角烧杯中,加入80 ml加热至沸腾的蒸馏水将邻苯二甲酸氢钾溶解完全,冷却至室温,加入2滴酚酞(2.1.8),用配制好的氢氧化钠溶液(2.1.9.1)滴至微红色为终点。
随同做空白试验
按式(1)计算氢氧化钠标准滴定溶液的实际浓度
(1)
式中:
C—氢氧化钠(NaOH)标准滴定溶液的实际浓度,单位为摩尔每升(mol/L);
G—称取邻苯二甲酸氢钾的量,单位为克(g);
204.23—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol);平行标定四份,其极差值不大于4×10-5mol/L时,取其平均值,否则重新标定.
1.2 试验方法
1.2.1 试料
1)移取1.0毫升试样,精准到1.00 ml﹙试样为浸出物过滤后的液体部分,试样要取上层清亮部分进行分析,如果试料呈浑浊状,可以用滤纸对浸出物进行过滤,但需注意一定要采用干过滤的方式进行过滤,防止在过滤过程中对试样造成稀释,使测定结果偏低。
2)独立地进行两次测定,取其平均值。
3)随同试样做空白试验
1.2.2 测定
1)准确移取试样1.0 ml(精准至1.00 ml)置于250 ml锥形瓶中,加入80 ml水,摇匀。
2)加入乙二胺四乙酸二钠-氯化钙(Na2EDTA-CaCl2)中性混合溶液10 ml,摇匀。
3)加入溴甲酚绿-甲基红混合指示剂4滴,摇匀。
4)用氢氧化钠标准滴定溶液滴定至溶液由红色变为亮绿色即为终点,记下消耗毫升数。
按式(2)计算酸H+的含量,数值以g/L表示:
(2)
式中:
C—氢氧化钠(NaOH)标准滴定溶液的实际浓度,单位为摩尔每升(mol/L);
V1—滴定时,滴定试液所消耗氢氧化钠标准滴定溶液的体积,单位为毫升(mL);
V2—滴定时,滴定空白试液所消耗氢氧化钠标准滴定溶液的体积,单位为毫升(mL);
V3—移取试样的体积,单位为毫升(mL);
49.04—硫酸(1/2H2SO4)的摩尔质量.
2 条件试验
2.1 掩蔽剂及指示剂的选择
2.1.1 浸出液中主成分及杂质含量的分析

表1 浸出液中主成分及杂质含量的分析
通过分析,浸出液中含有的主要成分是锌,杂质中含铁较高,镉、钴、锗、铜、镍、锑较低。在分析浸出液中的酸含量时,镉、钴、锗、铜、镍、锑不影响酸含量的分析测定,铁影响酸含量的分析测定。因此,在分析测定浸出液中的酸含量时必须加入乙二胺四乙酸二钠-氯化钙(Na2EDTA-CaCl2)来掩蔽浸出液中的铁。
2.1.2 掩蔽剂及指示剂用量的选择

表2 Na2EDTA-CaCl2及甲基橙指示剂用量的选择
通过实验表明:加入Na2EDTA(10 %)-CaCl2(5 %)混合液(1+1)10甲酚绿—甲基红混合指示剂4滴,试液无浑浊现象,终点明显,分析测定结果正常,加入其余不同量的Na2EDTA-CaCl2掩蔽剂溶液和溴甲酚绿-甲基红指示剂,试液还是有浑浊现象,终点也不明显,分析测定结果异常。
2.1.3 含铁量不同的浸出液加入Na2EDTA-CaCl2量的试验
通过实验表明:当浸出液中的铁含量≥15 g/L时,需要加入15 ml Na2EDTA(10 %)-CaCl2(5 %)混合液。否则,滴定终点不明显,分析测定结果异常。
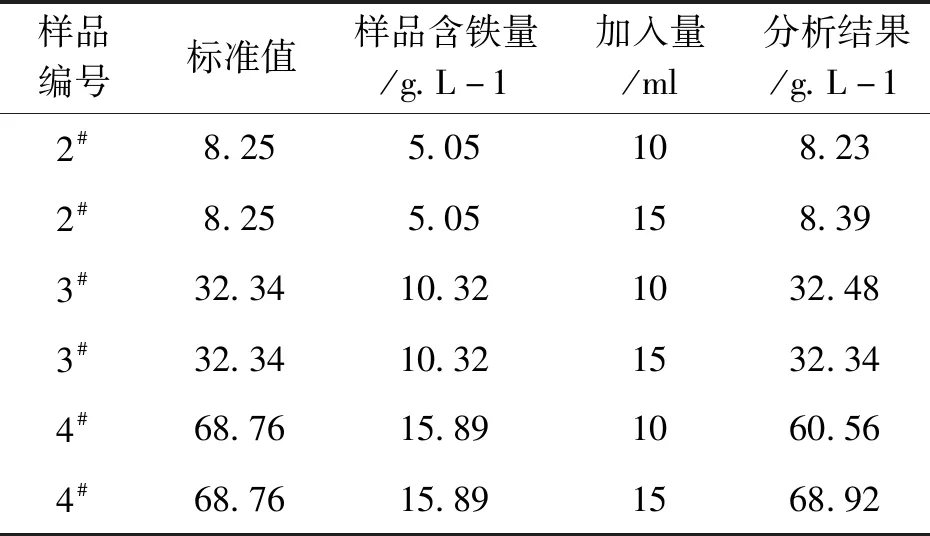
表3 含铁量不同的浸出液加入Na2EDTA-CaCl2的量
3 准确度试验
对3个不同的试样重复测量7次,得到方法测量精密度,见表4;对3个不同的样品加入不同的标准量,得到方法回收率,见表5。

表4 方法测量精密度
试样结果表明,方法测量精密度相对标准偏差为0.16 %~0.98 %,表明该分析方法具有良好的出现性。

表5 方法回收率
试样结果表明,方法的加标回收率在96.65 %~104.10 %,表明该方法具有较高的准确度
4 结 语
此分析测定方法精密度好,准确度高,分析流程短,便于操作,容易掌握。适合于湿法炼锌生产浸出液中硫酸含量的测定。对促进湿法炼锌生产具有重大的意义。

