恶性淋巴瘤化疗后合并足细胞内陷病一例报告
李娟,卢婉君,龚书豪,王缨
足细胞内陷病(PIG)是2008年由Joh等[1]提出的一种新型肾小球疾病,由于其特征性的病理改变而引起了广泛关注,主要表现为基底膜不规则增厚,基底膜内的微球和微管及足细胞内陷。目前针对此病的相关临床病例报道尚少见,且由于其临床和组织学特征上存在异质性,PIG的发病机制仍不明确。本文报告1例恶性淋巴瘤化疗后合并PIG,通过分析该病例及查阅足细胞内陷性肾小球病的相关临床病例报道,探讨PIG的发病机制。
1 病例报告
患者 女,46岁。主因蛋白尿阳性6年余,加重3个月余,于2018年10月15日就诊于南昌大学第一附属医院。2009年9月4日患者在江西省人民医院诊断为弥漫大B细胞淋巴瘤,进行了8个周期化疗(R-CHOP方案:美罗华500 mg+吡柔比星50 mg+长春新碱1.5 mg+环磷酰胺0.6 g+强的松100 mg),诉病情控制可。2012年8月5日患者因淋巴瘤在江西省人民医院住院化疗,查尿检发现蛋白尿阳性(具体不详),肾功能无异常,无特殊不适,故未予重视及治疗。2018年7月2日患者病情复发,于江西省人民医院再次接受3个周期化疗后发现蛋白尿较前加重,白蛋白明显降低(具体不详),故暂停化疗方案2个月,于9月27日再次复查尿蛋白3+,10月2日查尿蛋白4+,白蛋白23.4 g/L,且出现双下肢轻度凹陷性水肿,泡沫尿,感腹部不适,偶有腹胀,无胸闷气促,无夜间阵发性呼吸困难,无肉眼血尿,无尿频尿急等不适。患者既往无糖尿病、高血压等病史,无遗传性家族病史。入院查体:体温36.6℃,脉搏100次/min,呼吸20次/min,血压97/74 mmHg(1 mmHg=0.133 kPa),慢性病容,轻度贫血貌,心、肺、腹查体未见异常,双下肢轻度凹陷性水肿。故以“肾病综合征”收入我院肾内科住院治疗。入院后完善相关检查。血常规:白细胞计数2.51×109/L,红细胞3.73×1012/L,血红蛋白112 g/L,血小板计数191×109/L;小便常规:蛋白质3+;尿肌酐测定/尿蛋白定量(P/CR):蛋白定量4 742 mg/L,尿总蛋白/尿肌酐5.31;尿免疫球蛋白G 1 205.92 mg/L,尿转铁蛋白487.87 mg/L;尿微量白蛋白6 478.10 mg/L,尿微量白蛋白/尿肌酐 6 543.54 mg/g,尿α1-微球蛋白53.13 mg/L,尿N-乙酰-β-D氨基葡萄糖苷酶30.82 U/L;24 h尿蛋白定量6.78 g;血生化检查:总蛋白46.5 g/L,白蛋白20.9 g/L,血清铁2.9µmol/L,肌酐46.3 µmol/L,三酰甘油7.25µmol/L,总胆固醇7.40 µmol/L,钙1.81 mmol/L;甲状旁腺素26.73 ng/L;甲状腺功能:游离三碘甲状腺原氨酸2.29 pmol/L,游离甲状腺素0.58 pmol/L,促甲状腺激素13.600 mIU/L;补体C3 0.45 g/L,补体C4 0.19 g/L;抗核抗体核颗粒型阳性(+);游离轻链检测:游离κ轻链362.0 mg/L,游离λ轻链456.0 mg/L;血沉122 mm/1 h,人中性粒细胞明胶酶583.00µg/L;抗核抗体谱、抗双链DNA抗体(dsDNA)、抗肾小球基底膜(GBM)抗体、抗中性粒细胞胞质(ANCA)抗体、乙肝五项、人免疫缺陷病毒抗体测定(Anti-HIV)、风湿四项均未见异常;心电图、心脏彩超未见明显异常。
完善肾穿刺活检病理检查,光镜:共15个肾小球,系膜细胞和基质弥漫性轻-中度增生,个别肾小球毛细血管壁缺血皱缩,1个大细胞性新月体形成,系膜区、基底膜下红染均质物沉积,部分呈团块状沉积(图1)。过碘酸六胺银染色(PASM)示:肾小球上皮细胞空泡及颗粒变性,小灶状萎缩。肾间质小灶状淋巴单核细胞浸润伴纤维化,散在红染均质物沉积。小动脉管壁增厚,红染均质物沉积(图2)。免疫荧光检查:共4个球,IgG(2+),IgA(+),IgM(+),C3(+),C1q(-),FRA(2+),沿毛细血管壁线性沉积。乙肝表面抗原(HbsAg,-),乙肝核心抗原(HbcAg,-);免疫球蛋白κ(-),免疫球蛋白λ(-);电镜:镜下检测到1个肾小球,毛细血管内皮细胞明显空泡变性,个别管腔内可见红细胞聚集,毛细血管襻开放,壁层细胞空泡变性,基底膜弥漫性不规则增厚,厚度达2µm,基底膜内靠近上皮侧可见大量大小不等的圆形膜性结构,足突弥漫性融合,系膜细胞和基质增生,基底膜内可见少量电子致密物沉积,肾小管上皮细胞空泡变性(图3)。结合其病史及病检结果,诊断为足细胞内陷性肾小球病合并恶性淋巴瘤化疗后,治疗上给予降尿蛋白、护肾、改善甲减、补铁、调脂等对症支持治疗。经治疗后患者尿蛋白程度较前缓解,水肿较前消退。出院后2个月随访,患者诉再次因蛋白尿及低白蛋白、低白细胞,暂停淋巴瘤化疗方案。该患者存在淋巴瘤病史,需要长期化疗控制病情,可因免疫功能异常导致各种继发性感染及多脏器损伤,目前肾病反复出现尿蛋白,低白蛋白血症,经我院治疗后病情好转但仍复发,其后继续在当地医院进行降低尿蛋白、护肾等相关对症治疗。

Fig.1 Light microscopic observation of biopsy renal tissue(masson staining)图1 活检肾组织光镜观察(masson染色)
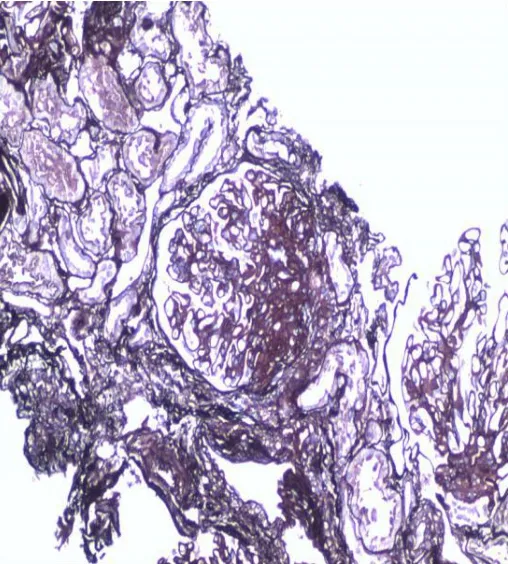
Fig.2 Light microscopic observation of biopsy renal tissue(PASM staining,×100)图2 活检肾组织光镜观察(PASM染色,×100)
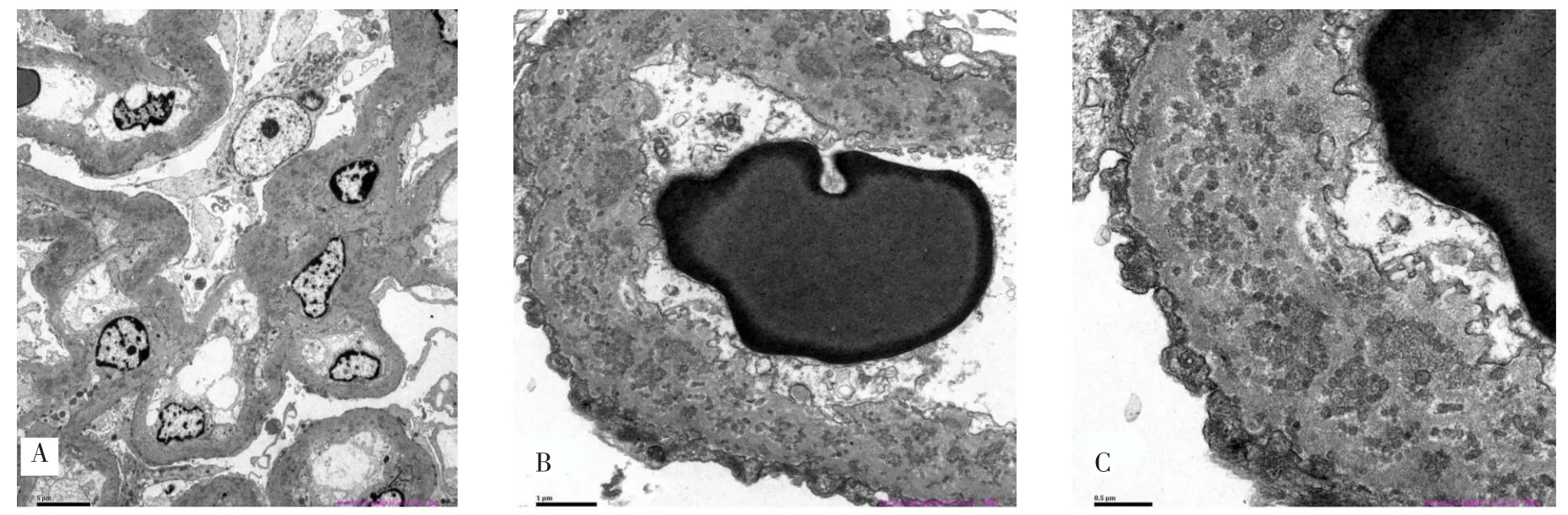
Fig.3 Electron microscopic observation of biopsy renal tissue图3 活检肾组织电镜观察
2 讨论
对于PIG究竟是一种新的疾病实体,还是某种已知疾病短暂的形态学改变[2],目前仍存争议。同时世界卫生组织也未将PIG纳入肾小球疾病的分类中。由于PIG在临床和形态学上存在异质性,对于PIG的诊断主要依赖于肾脏病理活检。日本在2008年提出的病理诊断标准[1]为:(1)光镜下观察到肾小球基底膜中的非嗜银空泡。(2)电镜下肾小球基底膜内50~150 nm的微球和/或微管,可能存在/不存在免疫复合物。而PIG的微粒结构主要分为两类,一类是原发性足细胞胞浆内陷,另一类是GBM内超微结构,包括微球体和微管样结构,类似足细胞微绒毛化的胞质突入到GBM内,前者在光镜下可观察到钉突样结构,后者则对应表现为GBM内空泡样结构[3]。目前国内外报道的PIG,大多合并自身免疫性疾病(如系统性红斑狼疮、桥本甲状腺炎、干燥综合征、类风湿关节炎、动脉炎等),肾脏活检免疫荧光染色存在/不存在免疫球蛋白和补体沉积,电镜下存在/不存在电子样密度物质。
目前PIG的病因及发病机制尚不明确。根据对其病理形态的观察,笔者考虑其病因可能包括3个方面:(1)免疫异常。其中补体通路的过度激活起着关键作用。Fujigaki等[4]采用免疫电镜分析肾小球病变,发现在GBM的细胞外组织中存在补体C5-9b复合物和波形蛋白。故认为足细胞和基底膜的损伤可能是由于补体C5-9b复合物攻击足细胞,从而导致了足细胞内陷和基底膜内的微粒结构。(2)足细胞损伤。表现为足突广泛融合,微绒毛转化和细胞质空泡化。Matsuo等[5]在电镜下观察到了微绒毛的形成和丝状肌动蛋白的增加,故认为足细胞损伤打破了足细胞基质的生物合成和降解之间的平衡,进而导致PIG进展。(3)GBM的异常。Matthai等[6]研究认为GBM的异常在PIG的发病过程中可能起促进作用。本例患者在临床表现上符合肾病综合征的诊断,相关的化验指标可以排除系统性红斑狼疮、过敏性紫癜、乙肝病毒相关性肾炎等继发性病因导致的肾病。结合既往存在弥漫大B细胞淋巴瘤和周期性化疗病史,行肾活检后病理上考虑足细胞内陷性肾小球病。深入分析该患者的病情,笔者推测该例PIG的发病可能与患者淋巴瘤化疗后导致的免疫异常有关,且患者补体降低,轻链κ、λ水平升高,肾活检组织免疫荧光下见IgG(2+)、IgA(+)、IgM(+)、C3(+),沿毛细血管壁线性沉积。这也提示可能存在补体通路的过度活化,这与Fujigaki等[4]的推测相符。该患者的肾组织在电镜下可见足突的弥漫性融合,虽未观察到微绒毛转化及胞质空泡化,但同样提示可能存在足细胞损伤。这也与Matsuo等[5]的推测相符。综上,笔者推测本例PIG的发病可能与化疗诱发的免疫异常及足细胞损伤有关,但具体的发病机制仍待进一步研究。

