miR-27a-3p对肝癌细胞化疗敏感性的影响及机制探讨
杨 颖,杨志芳,才 层,张瑞丽,路鹏霏,贾春丽,李志鹏,毛 睿,张 华,包永星
新疆医科大学第一附属医院肿瘤中心,新疆 乌鲁木齐 830011
肝细胞肝癌是一种常见的恶性肿瘤,在全球范围发病率居第五位,死亡率居第三位[1],近年来发病率呈逐年递增的趋势,严重威胁人类健康。肝癌起病隐匿,发展迅速,大多数患者确诊时已到中晚期[2],化疗是目前中晚期患者主要治疗手段。在临床上顺铂(cisplatin,DDP)是肝癌的化疗药物之一,但由于肝癌细胞对化疗药物常出现敏感性下降,甚至产生多药耐药(multidrug resistance,MDR)的情况,从而导致治疗效果不佳。因此,寻找增强肝癌化疗敏感性的方法是一种提高肝癌治疗效果的有效途径。
MicroRNA(miRNA,miR)是一类长约22 nt的单链非编码RNA,可通过调节与修饰不同靶点,在肿瘤细胞对化疗药物敏感性方面发挥重要作用[3-4]。近期研究发现,miR-27a-3p在肺鳞癌、结直肠癌和肝癌等多种肿瘤中低表达[5-7],与肿瘤的生长、侵袭、转移等生物学行为密切相关。但是,miR-27a-3p的表达水平与肝癌化疗敏感性相关的报道尚不多见,本研究旨在探索其表达对肝癌细胞DDP敏感性的影响。
1 材料和方法
1.1 主要试剂及细胞系
人肝癌细胞系HepG2、PLC购自中国科学院典藏培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心;胎牛血清、OPTI-MEM、DMEM培养基、胰蛋白酶-EDTA消化液购自美国Gibco公司;二甲亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司;脂质体转染试剂LipofectamineTM3000购自美国Invitrogen公司;miR-27a-3p相关质粒购自上海吉凯基因化学技术有限公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)细胞增殖检测试剂盒购自上海碧云天生物技术有限公司;PE-AnnexinV凋亡检测试剂盒、PI/RNase染色液购自美国BD Pharmingen公司;蛋白[质]印迹法(Western blot)检测试剂盒购自瑞士Roche公司;PI3K、p-AKT、C-caspase-3和β-actin抗体购自美国Cell Signaling Technology 公司。
1.2 癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据分析
我们使用公开可访问的TCGA数据库进行TCGA数据分析(https://tcga-data.nci.nih.gov/tcga/)。收集并分析372例肝细胞肝癌患者的临床资料,包括年龄、性别、种族、TNM分期、和miR-27a-3p表达等。通过TCGA数据库对miR-27a-3p进行表达定量。根据TCGA规范化协议,值为上四分位数标准化。
1.3 细胞培养、转染及分组
上述细胞系均接种于含有10%胎牛血清的高糖DMEM,在37 ℃、CO2体积分数为5%的培养箱中温育,取对数生长期的细胞用于实验。细胞转染采用脂质体瞬时转染方法,将miR-27a-3p过表达质粒(miR-27a)与阴性对照质粒(miR-control)转染肝癌细胞株HepG2;将miRinhibitor-27a-3p敲低质粒(miR-inhibitor-27a)与阴性对照质粒(miR-inhibitor-control)转染PLC细胞;实验设立6组:HepG2过表达细胞miR-27a+DDP组,miR-control+DDP组,空白对照组+DDP组;PLC敲低细胞,miR-inhibitor-27a+DDP组,miR-inhibitor-control+DDP组,空白对照组+DDP组。
1.4 四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)法检测细胞增殖
将肝癌细胞HepG2、PLC以4×104个/孔的密度接种到96孔板培养,转染后培养24 h后加入药物。实验组:为不同浓度DDP组(0、3、6、9和12 μg/mL),另设加药对照组和空白组,每个浓度设3个复孔。加药后的细胞继续培养48 h后,于实验终止前4 h每孔加入10 μL的MTT溶液,继续培养4 h。用酶标仪测定各孔波长490 nm处的光密度值(D),计算并绘制药物剂量-存活率曲线,利用GraphPad PRISM 6.0软件计算IC50,实验重复3次。
1.5 流式细胞术检测细胞凋亡
将肝癌细胞HepG2、PLC以4×104个/孔的密度接种到96孔板培养,转染后培养48 h后加入DDP(3 μg/mL)。依据凋亡试剂盒说明书操作,采用流式细胞术进行检测。实验重复3次。
1.6 Western blot检测
收集细胞,磷酸缓冲盐溶液(phosphatebuffered saline,PBS)浸洗各组细胞2次后,于冰上加入细胞裂解液进行裂解45 min,每隔15 min震荡1次,后加入一定量的上样缓冲液。加入一定量的蛋白样品与十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转法移到硝酸纤维素膜上,5%脱脂奶粉室温温育封闭2 h,温育一抗,4 ℃过夜,PBS洗涤3遍,每次15 min。加入对应的二抗温育1 h,再次洗膜后加入荧光发光液检测。
1.7 统计学处理
2 结果
2.1 miR-27a-3p在肝癌组织中低表达
从公开可访问的TCGA数据库进行数据分析,发现miR-27a-3p的表达量在肝癌组织中明显低于癌旁组织,差异有统计学意义(P<0.05,图1)。提示miR-27a-3p可能是一种抑癌miR。

图1 miR-27a-3p在肝癌组织与癌旁组织中的表达情况Fig.1 Expression of miR-27a-3p in hepatocellular carcinoma and adjacent tissues
2.2 miR-27a-3p可增强肝癌细胞对DDP的敏感性
采用MTT 实验检测各组细胞活性,在不同浓度DDP(0、3、6、9和12 μg/mL)作用48 h 后,HepG2 过表达细胞中,实验组miR-27a+DDP 细胞对DDP 的半数抑制浓度(IC50)为(1.02±0.03)μg/mL,明显低于对照组的I C50(1.27±0.08)μg/m L与空白组的I C50(1.73±0.08)μg/m L,差异有统计学意义(P<0.05);在PLC 敲低细胞中,实验组miR-inhibitor-27a+DDP的IC50[(3.87±0.08)μg/m L]较对照组[(2.97±0.08)μg/m L]和空白组[(1.02±0.03)μg/mL]均明显升高,差异有统计学意义(P<0.05),以上空白组与对照组结果均无统计学意义,提示miR-27a-3p可增强肝癌细胞对DDP的敏感性(图2)。
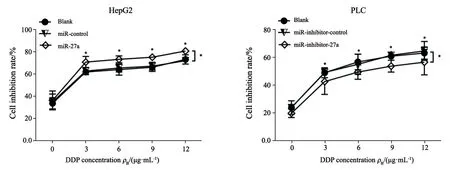
图2 不同浓度顺铂对2株肝癌细胞活性的抑制率Fig.2 Inhibitory rate of different concentrations of cisplatin on cell activity of hepatocellular carcinoma
2.3 miR-27a-3p可增强DDP促进肝癌细胞凋亡的作用
采用流式细胞术检测各组细胞凋亡率,经3 μg/mLDDP作用48 h后,在HepG2过表达细胞中,实验组miR-27a+DDP细胞凋亡率为(31.03±0.20)%,较对照组的(18.51±2.96)%与空白组的(8.73±1.58)%显著升高(P<0.05);在PLC敲低细胞中,实验组miRinhibitor-27a+DDP凋亡率(5.57±0.26)%较对照组的(13.58±1.50)%和空白组(12.52±0.70)%均明显降低(P<0.05),提示miR-27a-3p可明显增强DDP促进肝癌细胞凋亡的作用(图3)。
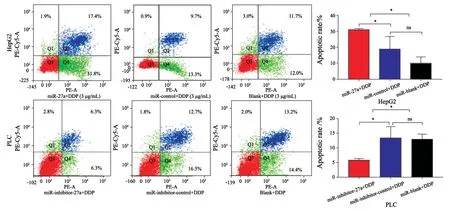
图3 顺铂对2株肝癌细胞凋亡率的影响Fig.3 Effect of cisplatin on apoptotic rate of hepatocellular carcinoma cells
2.4 miR-27a-3p可促进PI3K/AKT信号通路激活,增强肝癌细胞化疗敏感性
Western blot检测结果显示,3 μg/L DDP作用48 h后,HepG2过表达细胞中,PI3K和p-AKT蛋白表达量在miR-control组高于miR-27a组,DDP组高于miR-27a+DDP组,而miR-27a组C-caspase-3表达量较miR-control组升高,miR-27a+DDP组较DDP组升高(P<0.05);在PLC敲低细胞中,PI3K和p-AKT蛋白表达量在DDP组中低于miR-inhibitor-27a+DDP组,在miR-inhibitorcontrol组低于miR-inhibitor-27a组(P<0.05),而C-caspase-3表达量在DDP组较miR-inhibitor-27a+DDP组升高,在miR-inhibitor-control组较miR-inhibitor-27a组升高(P<0.05)。这说明DDP作用于肝癌细胞后,PI3K/AKT/caspase-3通路处于激活状态,可提高细胞凋亡率,而miR-27a-3p可增强这种效果(图4)。
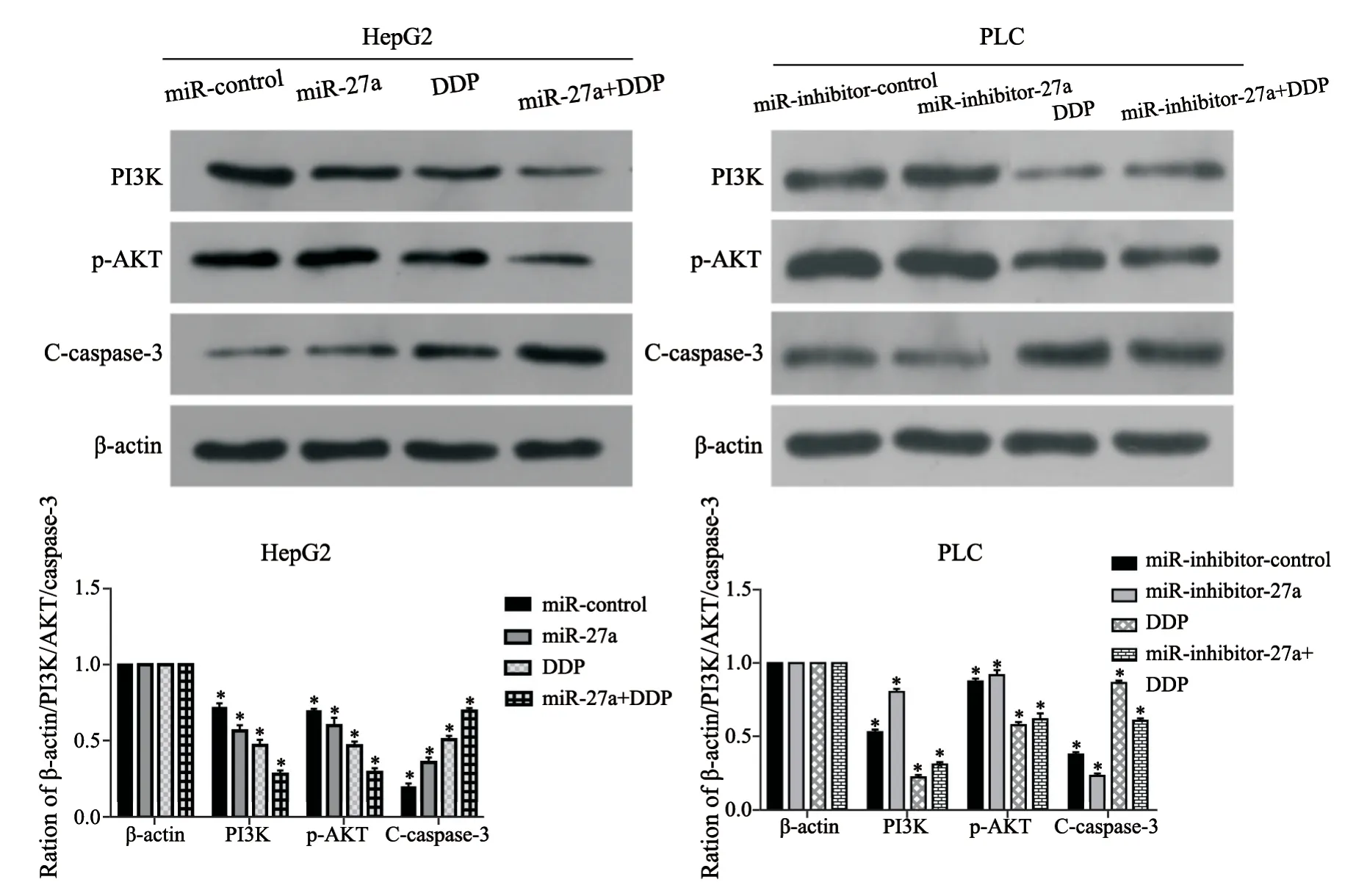
图4 Western blot检测顺铂作用后2株肝癌细胞PI3K/AKT信号通路中相关蛋白的表达Fig.4 Expression of proteins involved in PI3K/AKT signaling pathway of hepatocellular carcinoma cells treated with cisplatin detected by Western blot
3 讨 论
肝癌已成为我国恶性肿瘤中的第二号杀手[8],因其早期缺乏特异性症状和有效的筛查方法,大多数患者发现时已处于中晚期,错过了外科手术的最佳时机,而相关辅助治疗的效果也十分有限[9-10]。虽然近年来肝癌的治疗方案不断更新和改进,但由于在肿瘤治疗过程中化疗药物的耐药性在临床上普遍存在,导致化疗效果欠佳。近年来,随着生物分子机制的研究不断深入,研究发现miR作为一类长19~22 nt的内源性非编码小RNA,可以通过与靶基因特定区域互补配对结合,干预靶基因在转录后水平的表达,进而影响肿瘤的发生、发展[11]。也有研究报道,miR作为一种重要的靶基因修饰因子,对调节肿瘤的生长、侵袭和化疗耐药性有不可或缺的作用[12]。因此,探讨miR对增强肝癌化疗敏感性的作用和调节机制,为提高肝癌化疗效果奠定了一定实验依据和理论基础。
DDP属于细胞周期的非特异性药物,可抑制癌细胞DNA复制过程,并损伤其细胞膜上的结构,是一类较强的广谱抗癌药物,但在临床治疗中常容易发生肿瘤耐药,从而降低疗效[13]。Chen等[14]发现,miR-27a可以作为一种新的调节因子,通过抑制FZD7/β-catenin信号通路来逆转肝癌细胞中的获得性多药耐药。Zhang等[15]发现miR-27a通过促进Apaf-1-caspase-9复合体的形成,增强大肠癌干细胞对肿瘤坏死因子(tumor necrosis factor,TNF)相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)的敏感性,从而改善大肠癌干细胞对TRAIL的化疗抵抗性。本研究发现,miR-27a-3p在肝癌组织中的表达量明显低于癌旁组织,这与Li等[16]的研究报道一致。MTT结果显示,在HepG2过表达细胞中,不同浓度DDP作用48 h后,与对照组和空白组相比,实验组miR-27a+DDP细胞对DDP的半数抑制浓度(IC50)明显降低,而PLC敲低细胞的结果相反,表明miR-27a-3p可增强DDP抑制肝癌细胞增殖的能力。值得关注的是,流式细胞术检测结果显示,HepG2过表达细胞经3 μg/mLDDP作用48 h后,实验组miR-27a+DDP细胞凋亡率明显升高,而将PLC敲低凋亡率却降低,结果表明miR-27a-3p可增强DDP促进肝癌细胞凋亡作用。上述结果与Chen等[14]的研究发现相似,即miR-27a-3p可能逆转化疗的多药耐药性,改善肝癌的化疗敏感性,提高化疗效果。以上结果提示,miR-27a-3p可能改善肝癌细胞株对DDP的敏感性。
PI3K/AKT信号级联放大反应是非常重要的细胞内通路,经常在多种肿瘤中激活[17],最近的研究表明,PI3K/AKT通路在化疗耐药产生过程中起着重要的作用[18]。Zhang等[19]发现使用PI3K抑制剂LY294002阻断PI3K/AKT信号通路可以逆转肝癌细胞的EMT及耐药,说明在肝癌化疗耐药机制中,PI3K/AKT通路激活是获得性耐药的重要途径。而caspase-3是一种影响细胞凋亡的蛋白,在促进肿瘤细胞凋亡过程中起重要作用。为探究miR-27a-3p是否可通过激活PI3K/AKT信号通路影响肝癌细胞凋亡。我们采用Western blot检测各组细胞PI3K/AKT信号转导通路相关蛋白及凋亡蛋白C-caspase-3的表达量。结果显示,经3 μg/mL DDP作用48 h后,在HepG2过表达细胞中,PI3K和p-AKT蛋白表达量在miR-control组、miR-27a组、DDP组和miR-27a+DDP组细胞中依次降低,而C-caspase-3表达量则依次升高,在PLC敲低细胞中趋势完全相反,表明miR-27a-3p有通过调节PI3K/AKT信号通路促进肝癌细胞凋亡进而改善DDP化疗敏感性的可能性。
综上所述,本研究证明miR-27a-3p可调控PI3K/AKT通路介导在DDP化疗敏感性中的作用,这将为增强DDP化疗敏感性提供新的思路。

