马铃薯甲虫RNA干扰高效致死基因的筛选
米热古丽·胡尔西达,付开赟,徐晴玉,吐尔逊·艾合买提,丁新华,何 江,郭文超
(1.新疆农业大学农学院,乌鲁木齐 830052;2.新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;3. 新疆农业大学博士后流动站,新疆农业科学院博士后工作站,乌鲁木齐 830052;4.南京农业大学植物保护学院,南京 210095;5.新疆农业科学院微生物应用研究所,乌鲁木齐 830091)
0 引 言
【研究意义】马铃薯甲虫(Leptinotarsadecemlineata)是马铃薯上国际检疫的食叶毁灭性害虫[1]。马铃薯甲虫是世界上应用化学防治最早、最为广泛的害虫,也是最早产生抗药性的害虫之一。到目前为止马铃薯甲虫对所有已注册的化学农药均产生了抗药性[2]。RNA干扰现象在1998年发现以来[3],逐步应用于基因功能研究、基因检测和医疗领域[4],在昆虫领域中虽然RNAi技术尚无应用于田间害虫防治的产品,但其绿色无公害,专一性强,作为“基因农药”是最具潜力的害虫防治手段之一。研究通过筛选更为快速高效的马铃薯甲虫致死基因,针对性提高RNAi效力,为RNAi防控技术能更好的应用田间提供了理论和技术支持。【前人研究进展】RNA干扰研究的昆虫种类已达几十种,包括鳞翅目、直翅目、膜翅目、同翅目、双翅目等多种昆虫[5-9]。通过注射或喂食dsRNA的方法比较发现组织器官的差异、物种的差别、基因的选择对RNA干扰效果影响较大[5]。先前研究通过dsRNA原核表达系统研究了马铃薯甲虫ATP酶E亚基的致死效果。结果表明,四龄幼虫的化蛹致死中浓度为dsATPaseE表达菌液的0.001 2倍,处理高浓度的dsATPaseE的幼虫均会在处理后3 d 出现拒食表型,在较高浓度处理下的马铃薯甲虫幼虫行动力下降,全部不能入土化蛹,在适中的浓度处理下的马铃薯甲虫能够入土,但是在土中全部不能正常化蛹[10]。【本研究切入点】研究利用赤拟谷盗中报导的高效快速致死基因[11],以dsATPaseE和dsATPaseA为对照基因,初步建立高效致死基因的评价方法,鉴定分析马铃薯甲虫中快速高效的RNA干扰靶标基因。【拟解决的关键问题】研究RNA干扰技术筛选高效致死基因,提出高效致死基因的关键评价指标。总结RNA干扰鞘翅目中两种昆虫的直系同源基因的试验结果,分析RNA干扰致死率的差异造成的原因。
1 材料与方法
1.1 材 料
1.1.1 供试昆虫
马铃薯甲虫卵块均随机采集于新疆农科院植物保护研究所安宁渠试验地。(N:43.9128,E:87.4918)。培养箱饲养温度:(26±1)℃;光周期:14L∶10D;相对湿度50%~60%。用新鲜马铃薯叶片饲喂,取同一时间蜕皮至2龄初的幼虫作实验用虫。
1.1.2 主要试剂
总RNA提取试剂(TRIzol)购自Invitrogen公司,引物合成购自南京金斯瑞公司、SuperScript III反转录酶、Oligo (dT)18随机引物、TaqDNA聚合酶、dNTP mixture (2.5 mM 和10 mM) RNase抑制剂、DNA Marker购自TaKaRa宝生物公司。pGEM-T easy vector购自Promega公司。DNA凝胶回收试剂盒为AXYGEN公司或Promega公司产品;感受态细胞购自北京全式金公司;其他试剂为国产AR级或进口产品如酵母提取液和胰蛋白胨为Oxiod公司产品。
利用相似性搜索工具BLAST-2.2.27+,在马铃薯甲虫的转录组和基因组中(转录组数据由南京农业大学李国清老师惠赠,马铃薯甲虫的基因组数据下载自美国贝勒医学院人类基因组测序中心网站https://www.hgsc.bcm.edu/arthropods/colorado-potato-beetle-genome-Project。)搜索在赤拟谷盗中报导的40个高效致死基因[5]。选定赤拟谷盗致死基因中致死效率最高的10个基因,分别为Tcpp1alpha-96a、TcRpt3、Tcalphasnap、TcSrp54k、TcRpn6、TcRop、TcGawky、Tcshi、Tccact、Tcinr-a,以及比较致死效率的2个马铃薯甲虫阳性对照基因LdATPaseE和LdATPaseA,获得的cDNA序列通过PCR验证序列的正确性后提交到Genbank获取登录号。
1.2 方 法
1.2.1 dsRNA原核表达载体的构建
实验用大肠杆菌EscherichiacoliHTl15(DE3) RNase Ⅲ缺失品系和南京农业大学惠赠的pET-2p dsRNA表达载体。载体构建方法参照[12]中记载方法,用于构建马铃薯甲虫致死基因Tcpp1alpha-96a、TcRpt3、Tcalphasnap、TcSrp54k、TcRpn6、TcRop、TcGawky、Tcshi、Tccact、Tccpf的dsRNA的cDNA片段,超纯水和dsegfp为对照,PCR克隆获得。PCR产物的回收与纯化、连接和转化及单克隆的挑选参照[13]中记载方法。获得的阳性克隆通过测序和异丙基硫代半乳糖(isopropyl-D-hiogalactoside,IPTG)诱导发酵dsRNA验证结果。诱导发酵的步骤参照[14]中记载方法,在菌液重新扩大培养至OD600=1.0时加入IPTG至终浓度为0.1 mmol/L,发酵表达6 h即可获得稳定表达的浓度约为0.05 μg/μL 的dsRNA[14]。采用 Premier Primer5.0设计dsRNA片段的引物。表1
表1 用于构建dsRNA原核表达载体的引物
Table 1 Primers used for dsRNA synthesis

代号Symbol基因名GeneName上游引物Forwardprimer(5′-3′)下游引物Reverseprimer(5′-3′)dsRNA片段长度LengthofdsRNAfragmentL1Ldalpha-snapTTCGGTAGTTCTAGTCGTAATAGTCTGGTGGTGCTT288L2LdcactGAGGGTTGCTCAGGGTATTTCGCTGTCTTCAGTATCG222L3Ldinr-aAGCTCGTTCCTTCGCTAGGCAGTCCTTTGCCCTAAC226L4LdGawkyCGGCTCAAGTTGTCGTTCTGAGGTCGTCAGATAGTTCG224L5LdRpn6GATAAAGATAATGCCGTGAGGTGTAGCGGACAAATGCT323L6LdshiCGTTTACGGGAAGTAGTGGAACCTTTGCGAATGACCT217L7Ldsrp54kAGGAGCGTATGACCAAGTTCAGGTTTCACAGCGTTA219L8LdropCAAGAACACTGCGTTTAGCTTATGCTGTCTGGGATT178L9LdRpt3GGTCCACTACAGGTTCCAGTCCATACATCAACACCC309L10LdpplaphaGCAGAAGTCGTAGGGAAATAACTGACATCATCGCACC171L11LdATPaseAGCGGAAGTAGTAATAATGGGACAACTGATAAGCACCTA197L12LdATPaseEAATCCTGGAAAGCCTCATCCAACTGCTGCGAAATCA281dsegfpdsegfpAAGTTCAGCGTGTCCGCTTGCCGTAGTTCCAC414
1.2.2 喂食dsRNA试验
将已经构建好的pET-2p-alpha-snap、pET-2p-cact、pET-2p-inr、pET-2p-Gawky、pET-2p-Rpn6、pET-2p-shi、pET-2p-srp54k、pET-2p-rop、pET-2p-rpt、pET-2p-pplapha、pET-2p-ATPaseA、pET-2p-ATPaseE、pET-2p-egfp的大肠杆菌表达载体在含有100 μg/mL卡那霉素的LB液体培养基中以体积比1∶100的比例扩大培养,于37℃ 220 r/min 条件下震荡培养3.5 h,即OD100=1.0时,按1∶1 000比例(v/v)添加已经配好的IPTG母液(母液浓度0.023 8 g/mL),至终浓度为0.1 mmol /L,继续恒温震荡4~5 h,以此过程获得新鲜dsRNA,dsRNA浓度约为50 μg /mL。选取饲养一致的2龄初的幼虫,分别设置超纯水与表达dsegfp稀释10倍菌液即浓度5 μg / mL为空白对照和阴性对照。将马铃薯甲虫二龄幼虫置于9 cm标准玻璃皿中,用菌液处理过的叶片进行饲喂。各处理浓度为50、5、0.5和0.05 μg / mL,每个处理5头幼虫,6组生物学重复。共计用虫1 500头。干扰24 h后喂食新鲜叶片。观察记录幼虫生长状况、取食率、死亡率。当幼虫出现化蛹迹象,将其转入土壤深度为10 cm的封闭环境中,观察化蛹率。
1.3 数据处理
研究数据处理采用Microsoft Excel、IBM spss statistics 20.0处理,做线性回归分析模型以及计算取食20%剂量AD20,化蛹中量PD50和致死中量LD50。存活率、化蛹率和羽化率通过ANOVA的Tukey-Kramer分析进行统计检验,显著性水平选择P<0.05。
2 结果与分析
2.1 马铃薯甲虫幼虫致死基因的序列信息
选定的10个基因,分别参与不同的生物学功能,其中L1为参与细胞间的粘合;L2参与Toll免疫信号通路;L3为mRNA前体剪切体复合体2蛋白Pcf11,参与mRNA的剪切;L4为三核苷酸重复蛋白,参与miRNA的调节;L5、L9参与蛋白酶体的构成;L6为GTP酶,参与细胞内吞;L7参与细胞膜上的信号识别;L8参与突触信号的转导;L10为丝/苏氨酸磷酸酯酶。对每个基因设计了dsRNA,dsRNA引物及序列长度。表2
表2 马铃薯甲虫致死基因序列信息Table 2 Information
Table of Lethal Genes ofLeptinotarsadecemlineata
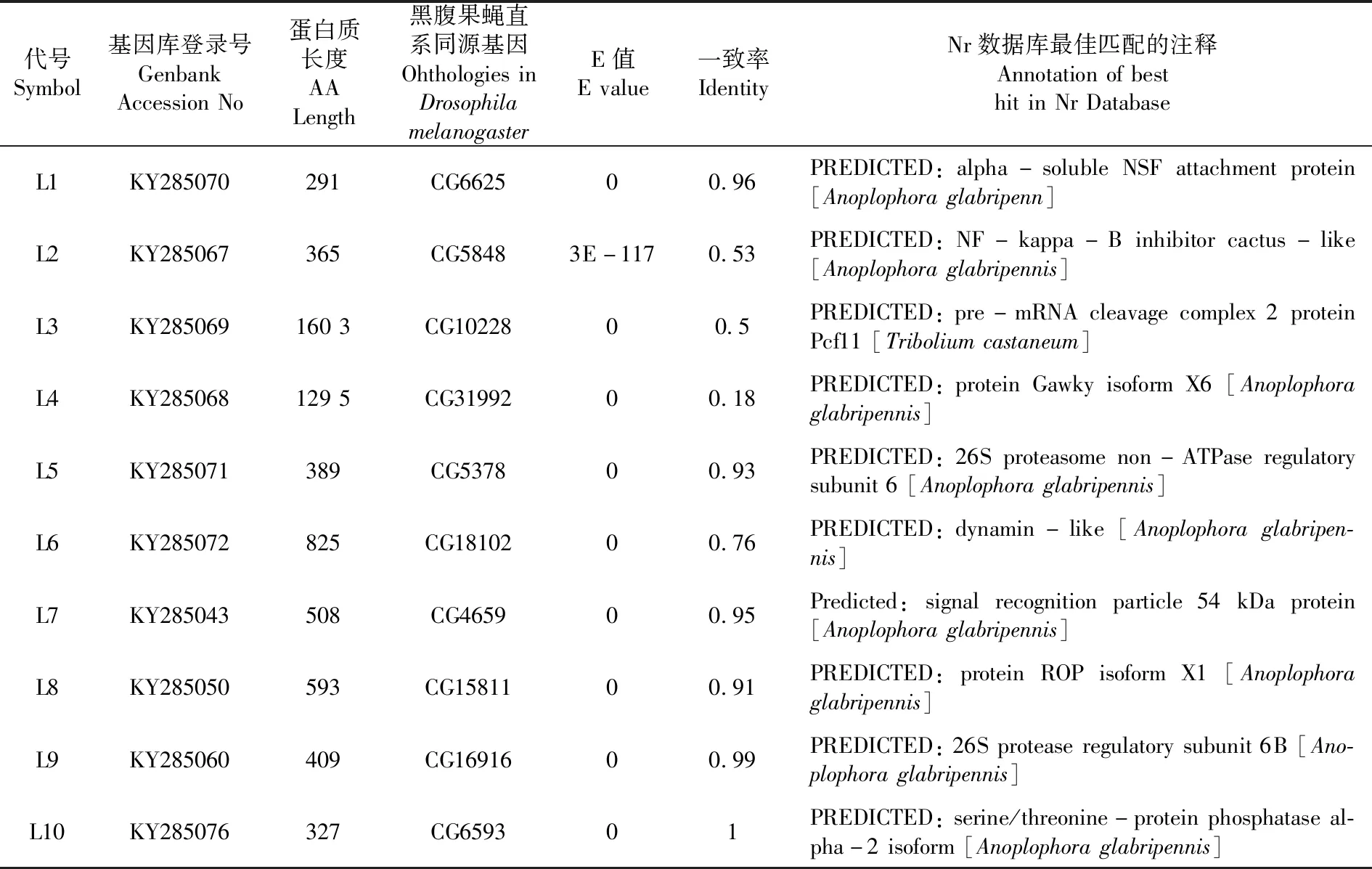
代号Symbol基因库登录号GenbankAccessionNo蛋白质长度AALength黑腹果蝇直系同源基因OhthologiesinDrosophilamelanogasterE值Evalue一致率IdentityNr数据库最佳匹配的注释AnnotationofbesthitinNrDatabaseL1KY285070291CG662500.96PREDICTED:alpha-solubleNSFattachmentprotein[Anoplophoraglabripenn]L2KY285067365CG58483E-1170.53PREDICTED:NF-kappa-Binhibitorcactus-like[Anoplophoraglabripennis]L3KY2850691603CG1022800.5PREDICTED:pre-mRNAcleavagecomplex2proteinPcf11[Triboliumcastaneum]L4KY2850681295CG3199200.18PREDICTED:proteinGawkyisoformX6[Anoplophoraglabripennis]L5KY285071389CG537800.93PREDICTED:26Sproteasomenon-ATPaseregulatorysubunit6[Anoplophoraglabripennis]L6KY285072825CG1810200.76PREDICTED:dynamin-like[Anoplophoraglabripen-nis]L7KY285043508CG465900.95Predicted:signalrecognitionparticle54kDaprotein[Anoplophoraglabripennis]L8KY285050593CG1581100.91PREDICTED:proteinROPisoformX1[Anoplophoraglabripennis]L9KY285060409CG1691600.99PREDICTED:26Sproteaseregulatorysubunit6B[Ano-plophoraglabripennis]L10KY285076327CG659301PREDICTED:serine/threonine-proteinphosphataseal-pha-2isoform[Anoplophoraglabripennis]
2.2 喂食致死基因dsRNA对马铃薯甲虫2龄幼虫取食量的影响
连续喂食一周表达L1~L12菌液后,马铃薯甲虫幼虫表现出拒食、发育迟缓的情况。在4个剂量50、5、0.5和0.05 μg的dsRNA处理中,在剂量50与5 μg处理叶片上的幼虫取食率呈明显下降趋势,极显著低于对照组、dsegfp处理组和低浓度处理组叶片上幼虫的取食率。
党的十九大报告把党的政治建设纳入新时代党的建设总体布局,明确要求要以党的政治建设为统领、把党的政治建设摆在首位,为坚持和加强党对高校的全面领导、推进高校党的建设指明了方向、提供了遵循。对高校来讲,强化党的政治建设的统领地位,要突出加强政治领导、增强政治能力、把握政治方向、强化政治功能四大重点。
处理24 h时后,50 μg的各处理组叶片取食率与dsegfp处理组叶片上取食率差异不显著(P>0.05),取食率均在25%以下,危害等级为Ⅰ;0.05 μg 的处理组与对照组取食率差异不显著(P>0.05),但与其它处理浓度与dsegfp处理组的取食率有差异(P<0.05)。处理48 h后,各处理组取食率随幼虫生长均有上升,其中Ldalphasnap与LdSrp54k处理组较其他处理组取食率增长微效且缓慢,仍表现出最强的取食抑制,与对照组和dsegfp处理组存在极显著差异(P<0.05)。其余各处理组在48 h时取食率大小依次为:LdGawky>Ldshi>Ldcact>LdRop>Ldinr-a>LdRpt3>LdRpn6>LdATPaseA>LdATPaseE。处理72和96 h后,Ldalphasnap、Ldcact、LdRpn6、LdSrp54k、LdRpt3、LdATPaseA、LdATPaseE处理组幼虫取食量随天数增长呈明显下降趋势,浓度越高抑制反应越强,而在对照组和dsegfp处理组幼虫取食率则呈继续上升,接近甚至达到IV级的取食为害。图1A-D
幼虫在喂食表达dsRNA菌液后,于处理后第3 d出现显著的的取食抑制表型,各处理组浓度加大,拒食率升高,即以处理后第3 d作为抑制取食表型的分析时刻。运用SPSS 20.0对幼虫3 d的拒食率进行回归分析。除LdRop处理组和拒食活性较低的Ldinr-a,其余各处理组中在dsRNA浓度为50 μg/mL与5 μg/mL是取食率均低于达12.5%,甚至不取食。其中LdSrp54k处理组拒食活性最高,拒食率回归分析为:Y=2.711x-1.353,取食20%剂量为(1.39±0.13) μg。表3

图1 喂食浓度梯度的dsRNA后第1~4 d(A-D)幼虫取食的为害等级
Fig. 1 Larvae feed intake 1-4 days(A-D) after feeding dsRNA at gradient concentrations
表3 拒食活性统计分析与线性回归方程
Table 3 Regression and D20analysis of 3-day after feeding dsRNA to 2nd instar CPB larvae

代号Symbol基因Gene拒食率回归方程LinearregressingequationAD20AD20稀释倍数DilutionmultipleL1Ldalpha-snapY=5.873x-3.0641.51±0.06 33.2±0.7L2LdcactY=4.523x-2.3021.57±0.09 31.9±2.8L3Ldinr-aY=9.892x-3.102228.13±6.72 0.2±0.1L4LdGawkyY=2.858x-1.371.61±0.0031±0.5L5LdRpn6Y=4.523x-2.3021.57±0.0331.9±0.3L6LdshiY=5.873x-3.0641.51±0.0133.2±0.7L7Ldsrp54kY=2.711x-1.3531.39±0.1335.9±3.0L8Ldrop---L9LdRpt3Y=7.403x-3.8351.78±0.0728±1.5L10LdpplaphaY=5.273x-2.4942.61±0.1519.2±0.9L11LdATPaseAY=3.46x-1.1875.29±0.279.5±3.2L12LdATPaseEY=4.076x-1.713.47±0.0614.4±0.8
注:AD20与稀释倍数后的值为±SE
2.3 喂食致死基因dsRNA对马铃薯甲虫2龄幼虫致死效果的评价
各处理组干扰后幼虫减少取食甚至停止进食,迫使其生长发育得到抑制,最后导致死亡。 每日统计死亡头数,待老熟幼虫入土化蛹前,即dsRNA喂食处理第7 d后统计死亡率。各基因对马铃薯幼虫在入土前均具有一定的毒杀作用,其中处理组LdSrp54k、LdRpn6、LdRpt3、Ldalphasnap在dsRNA浓度为50 μg /mL下对马铃薯甲虫2龄幼虫表现出高致死活性,致死率高达90%~93%。LdGawky、LdRop、Ldcact、LdRpn6、LdRpt3、LdATPaseA、LdATPaseE、Ldalphasnap、LdSrp54k处理组在dsRNA浓度为50 μg /mL与5 μg /mL下致死率均超过50%,致死活性随浓度增高而增大,表现出剂量依赖效应。与对照组存在显著差异(P< 0.05)。图2
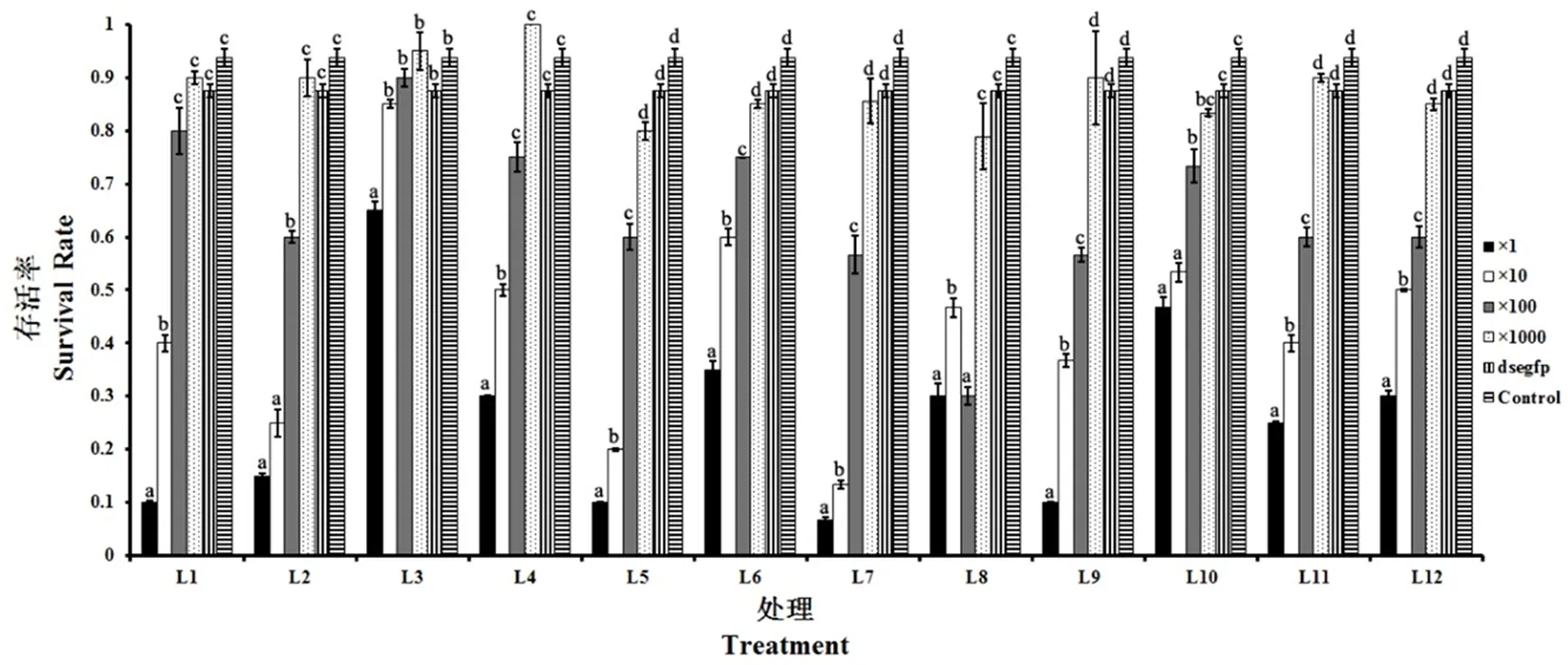
注:误差线为±SE,误差线上端不同字母表示处理组内显著性水平不同
Note:Bars means ±SE, different letters depict different significant level
图2 喂食马铃薯甲虫2龄幼虫dsRNA菌液后第7 d的存活率
Fig. 2 7-day survival rate of 2nd instar larvae after treated with dsRNA-expressing bacterial solution
运用SPSS20.0对处理后7 d的死亡率进行显著性分析与回归分析。入土化蛹前时间大约为处理后的第7 d,各致死基因LD50具体数值。表4
表4 致死活性统计分析与线性回归方程
Table 4 Linear regression equation for medium mortality of 2nd instar larvae ofLeptinotarsadecemlineata

代号Symbol基因Gene死亡率回归方程Linearregressingequation致死中量LD50稀释倍数DilutionmultipleL1Ldalpha-snapY=3.45x-1.5933.52±0.3614.2±0.7L2LdcactY=3.708x-2.0341.84±0.3027.1±3.0L3Ldinr-aY=4.491x-0.99961.07±10.170.8±0.1L4LdGawkyY=5.797x-2.865.42±0.529.2±1.6L5LdRpn6Y=4.087x-2.4621.18±0.1042.4±3.1L6LdshiY=5.174x-2.10812.59±0.484±0.7L7Ldsrp54kY=3.227x-1.8861.3±0.0638.3±1.8L8LdropY=4.164x-2.4111.48±0.0033.8±3.7L9LdRpt3Y=3.814x-2.0791.93±0.0725.9±3.4L10LdpplaphaY=6.195x-2.6216.63±0.733±0.5L11LdATPaseAY=4.308x-2.1833.08±0.2316.2±0.2L12LdATPaseEY=4.681x-2.2454.54±0.5411±0.3
2.4 喂食致死基因dsRNA对马铃薯甲虫幼虫化蛹率的影响
老熟幼虫入土化蛹后第7 d统计化蛹率。结果表明,各基因对马铃薯幼虫化蛹率均具有一定抑制作用,与对照组存在显著差异(P<0.05)。且化蛹率随处理浓度的增加而减小,其中处理组Ldalpha-snap、LdSrp54k、Ldcact、LdRpn6、LdSrp54k、LdATPaseA、LdATPaseE、在dsRNA浓度为50 μg /mL下对马铃薯甲虫老熟幼虫化蛹率低至0。Ldpp1alpha-96a、LdRpt3、Ldalphasnap、LdSrp54k、LdRpn6、LdRop、LdGawky、Ldshi、Ldcact、处理组在dsRNA剂量为50 μg与5 μg下化蛹率均未超过50%。即使剂量低至0.05 μg,也能相比对照降低幼虫20%~30%的化蛹率。图3

注:误差线为±SE,误差线上端不同字母表示处理组内显著性水平不同
Note:Bars means ±SE, different letters depict different significant level
图3 喂食dsRNA菌液的马铃薯甲虫幼虫化蛹率
Fig. 3 Pupation rate of larvae of fed with dsRNA bacterial solution
运用SPSS21.0对老熟幼虫入土化蛹率进行显著性分析与回归分析。入土时间大约为7 d,各致死基因PD50具体数值。表5
表5 处理dsRNA后幼虫化蛹率的线性回归方程
Table 5 Linear regression and PD50analysis for pupation rate

代号Symbol基因Gene化蛹率回归方程Linearregressingequation化蛹中量PD50稀释倍数DilutionmultipleL1Ldalpha-snapY=5.073x-3.4430.39±0.01128.4±5.7L2LdcactY=3.633x-2.2620.81±0.0861.5±0.0L3Ldinr-aY=6.064x-2.13231.20±1.891.6±0.3L4LdGawkyY=6.934x-5.3440.06±0.01788.5±61.9L5LdRpn6Y=5.581x-4.5180.07±0.00758.6±130.0L6LdshiY=4.779x-3.0290.67±0.0874.2±9.9L7Ldsrp54kY=2.708x-1.8050.65±0.1076.7±11.3L8LdropY=3.987x-2.3930.98±0.0851.0±4.2L9LdRpt3Y=3.697x-2.1191.24±0.2440.5±6.8L10LdpplaphaY=2.976x-1.7880.98±0.1951.0±4.3L11LdATPaseAY=3.551x-2.4280.50±0.09100.8±11.7L12LdATPaseEY=3.21x-2.2610.46±0.02109.8±15.9
2.5 备选基因dsRNA的致死效果的综合分析和致死效应的关键指标
L1~L10基因与LdATPaseA、LdATPaseE的拒食活性、致死活性、 抑制化蛹活性对比分析。Ldalpha-snap、LdSrp54k、LdRpn6、LdRpt3、LdGawky、Ldcact、Ldshi总计7个基因的dsRNA取食20%剂量显著低于LdATPaseA与LdATPaseE;Ldcact、LdSrp54k、LdRpn6、LdRpt3、Ldrop总计5个基因的dsRNA致死中量低于LdATPaseA与LdATPaseE;Ldalpha-snap、LdRpn6、Ldcact总计三个基因的dsRNA化蛹中浓度显著低于LdATPaseA与LdATPaseE。在综合比较对叶片减少为害的速效性和致死效率来看,Ldcact、LdSrp54k、LdRpn6、LdRpt3、Ldrop五个基因在表现上优于LdATPaseA与LdATPaseE。表6
表6 备选致死基因拒食活性、致死活性、 抑制化蛹活性对比
Table 6 Comparison and analysis of repulsion, lethal and Chrysalis activities

代号Symbol基因名称Genename取食20%剂量ID20致死中量LD50化蛹中量PC50L1Ldalpha-snap1.51±0.063.52±0.360.39±0.01L2Ldcact1.57±0.091.84±0.300.81±0.08L3Ldinr-a228.13±6.7261.07±10.1731.20±1.89L4LdGawky1.61±0.005.42±0.520.06±0.01L5LdRpn61.57±0.031.18±0.100.07±0.00L6Ldshi1.51±0.0112.59±0.480.67±0.08L7Ldsrp54k1.39±0.131.3±0.060.65±0.10L8Ldrop-1.48±0.000.98±0.08L9LdRpt31.78±0.071.93±0.071.24±0.24L10Ldpplapha2.61±0.1516.63±0.730.98±0.19L11LdATPaseA5.29±0.273.08±0.230.50±0.09L12LdATPaseE3.47±0.064.54±0.540.46±0.02
3 讨 论
目前RNA干扰技术在基因功能方面的研究已经较为成熟[15]。然而,在RNA干扰技术应用于害虫防治方面,还面临着诸多问题[16-17]。例如所选取的RNA干扰的靶标基因,作用时间过于缓慢,往往需要7 d甚至更久才能使昆虫出现拒食,蜕皮或不能正常化蛹等表型,作用方式类似于生长调节剂。因此,需要进一步对高效快速的致死基因进行挖掘。先前对LdATPase的研究,其致死中浓度为dsRNA表达菌液的0.001 2倍,处理LdATPase的幼虫均会在处理后第2 d出现拒食表型,在较高浓度处理下的马铃薯甲虫幼虫行动力下降,全部不能入土化蛹,在中低浓度处理下马铃薯甲虫能够入土,但是在土中部分甚至全部不能正常化蛹[12]。实验选定的赤拟谷盗致死效率最高的10个基因中的Ldalpha-snap、LdRpn6、LdSrp54k、LdRpt3基因在马铃薯甲虫上表现的致死效果高于LdATPaseA和LdATPaseE。
Tcpp1alpha-96a、TcRpt3、Tcalphasnap、TcSrp54k、TcRpn6、TcRop、TcGawky、Tcshi、Tccact、Tcinr-a以上10个基因在赤拟谷盗上注射8 d即可达到100%的死亡率[11]。而在研究中没有在马铃薯甲虫上表现出如此高的致死活性。考虑可能是以下几个方面导致。一方面,dsRNA的递送方式不同,Ulrich等对赤拟谷盗的研究[11]采用注射dsRNA的方法。其优点是dsRNA迅速精准到达组织,干扰效率相对高,但是在干扰过程中对幼虫造成了机械损伤,该损伤是否对RNA干扰的效果造成协同的影响不可而知。而研究采用的喂食dsRNA的方法虽然操作容易、成本低、省时、对虫体不会造成机械性损伤[18-20],但是由于需要经过肠道消化吸收,基因沉默效率相比较于注射法会低。另一方面,物种差别也可能导致RNA干扰的差异,不同昆虫由于血淋巴和肠道环境差异大导致dsRNA降解消化和摄取的效率差异也大。如烟草天蛾Manducasexta相比德国小蠊Blattellagermanica,血淋巴和肠道中具有更高活性的双链核酸酶。而赤拟谷盗是杂食性的仓储害虫,而马铃薯甲虫属于专食性的食叶害虫,虽然同属于鞘翅目但是食性差别仍然较大。此外,dsRNA所用的剂量也有差异,Ulrich等对赤拟谷盗的研究[11]注射dsRNA剂量为3 ng/μL、30 ng/μL、300 ng/μL、1 μg/μL。研究通过饲喂法向马铃薯甲虫喂食50 μg /mL、5 μg /mL以及0.5 μg /mL浓度剂量的dsRNA,摄取剂量不同差异也会较大。因此,未来应对原核表达dsRNA的系统,建立一套在虫体、植株内和环境中的dsRNA的定量检测技术,利于注射法、喂食法的平行比较。
此外,RNA干扰虽然作用过程缓慢,普遍要5~7 d才会导致幼虫死亡[11,12],但是研究对易获得的表型指标进行了量化,包括叶片的取食量、7 d的致死率和化蛹率。发现在适当的剂量下,致死基因的dsRNA能够在2~3 d即可导致幼虫的取食量大幅下降,甚至绝食,在第7 d导致幼虫的完全死亡,这足以达到田间防控的目的。因此,研究提出的AD20和7 d幼虫的LD50,尤其是AD20是评价致死基因效果的关键指标。
4 结 论
通过RNA干扰从马铃薯甲虫中筛选获得了Ldcact、Ldalpha-snap、LdRpn6、LdSrp54k、LdRpt3五个具有较高抑制取食活性和致死效果的基因。提出并推荐AD20和LD50是评价备选基因dsRNA对幼虫致死效果的关键指标。

