移植心脏血管病的发病率和相关危险因素分析
陈文倩,孙彭赛男,黄洁,廖中凯,吕滨,乔树宾,宋云虎,王巍,郑哲,刘盛,胡盛寿
移植心脏血管病(CAV)是心脏移植术后长期存活的主要限制因素之一[1]。目前各移植中心报道的CAV 发病率不同,国际心肺移植协会(ISHLT)登记注册数据90%来自北美和欧洲的白种人,报道心脏移植术后第5、10 年CAV 的发生率分别为30%、50%[2],目前亚洲各移植中心关于CAV 发生率的报道较少,仅有中国台湾、中国香港及韩国等报道,其中规模最大的研究纳入了297 例患者。报道显示,亚洲人群CAV 的发生率低于西方国家(术后第5 年:17.6% vs 30.0%;术后第10 年:39.7% vs 50.0%)[3-4]。CAV 发生发展的相关病理生理机制至今仍未完全阐明,尤其是亚洲人群CAV 的危险因素尚未达成共识。本研究回顾性分析了中国医学科学院阜外医院525例心脏移植患者的CAV 发病率、相关危险因素以及与长期生存率的关系。
1 资料与方法
研究对象:连续入选2004 年6 月至2017 年4月于阜外医院接受心脏移植的670 例患者,排除25例围术期死亡患者、4 例非CAV 原因再次移植患者、116 例未行冠状动脉CT 血管成像(CTA)患者(包括27 例因肾功能不全患者),最终纳入525 例患者。研究终点为发生CAV,并就CAV 阳性组和阴性组两组患者的一般情况和近期和远期的生存情况等进行了比较分析。
免疫抑制治疗方案:所有患者均在术前1 h 和术后4 d 分别应用1 次巴利昔单抗(20 mg/次)行免疫诱导。维持免疫抑制治疗采用他克莫司(或环孢素)+吗替麦考酚酯(或硫唑嘌呤)+皮质激素的三联免疫抑制方案。合并肾功能不全的患者加用西罗莫司,并将他克莫司或环孢素的目标血药浓度减为原浓度的2/3。本中心未采用撤除激素方案。
CAV 的诊断和分级:在心脏移植术后第1 个月内行CTA 除外供体冠状动脉病变,分别在心脏移植术后第1、3、5、7、10年行CTA或冠状动脉造影(CAG)检查。CAV 定义为CTA 或CAG 发现任意一支冠状动脉狭窄。按照ISHLT 分级标准分为CAV 0~3 级:CAV 0 级为CTA 或CAG 未发现明显的冠状动脉狭窄;CAV 1 级(轻度)为左主干狭窄<50%,或主要血管狭窄<70%,或任何分支血管狭窄<70%(包括弥漫性狭窄),不伴移植心脏功能障碍;CAV 2 级(中度)为左主干狭窄<50%,且单个主要冠状动脉血管狭窄≥70%或2 支冠状动脉血管中均存在孤立的分支血管狭窄≥70%,不伴移植心脏功能障碍;CAV 3级(重度)为左主干狭窄≥50%,或≥2 处主要冠状动脉血管狭窄≥70%,或3 支冠状动脉血管中均存在孤立的分支血管狭窄≥70%,或CAV 1 级和CAV 2 级伴移植物功能障碍(左心室射血分数≤45%,通常伴有节段性室壁运动异常),或移植心脏存在严重的限制性功能障碍。
统计学分析:应用SPSS 22.0 统计软件进行统计学处理。正态分布的计量资料以均数±标准差表示,偏态分布的计量资料以中位数表示。计数资料以率或构成比表示。组间正态分布的计量资料采用单因素方差分析,组间非正态分布者采用非参数检验分析,组间计数资料均采用卡方检验。对所有在单因素分析中P<0.10 的重要的连续变量及分类变量随后进行多因素分析。使用Kaplan-Meier 方法分析计算心脏移植术后生存率。P<0.05 为差异有统计学意义。
2 结果
接受心脏移植术患者及供者的一般情况:525 例心脏移植患者中位年龄46 岁,年龄最大者为70 岁,最小者为4 岁,平均年龄(43.69±13.84)岁,男性419 例(79.8%)。心脏移植供者中位年龄为29.85(5~50)岁,男性509 例(97.0%)。525 例患者移植前病因为心肌病者411 例(78.3%),病因为冠心病者86 例(16.4%)。
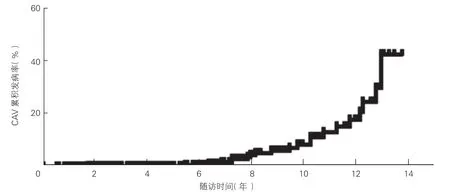
图1 CAV 的累积发病率
CAV 发生和生存情况的分析(图1、2):平均随访(65.8±40.7)个月期间,共22 例(4.2%)心脏移植患者术后发生CAV,术后1、3、5、7、10 年累积发病率分别为0.2%、1.2%、2.7%、4.0%、10.4%(图1),从心脏移植到发生CAV 的平均时间为(66.5±35.9)个月。Kaplan-Meier 曲线显示,CAV 阴性组累积生存率高于CAV 阳性组(Log-rankP=0.039),CAV 阳性组患者5 年生存率(90.9% vs 93.3%)、10 年生存率(61.2% vs 86.8%)明显低于CAV 阴性组患者(P均<0.05)。CAV 阳性组患者中有10 例CAV 3 级,5 例CAV 2 级,7 例CAV 1 级;8 例CTA 结果提示其冠状动脉从末端开始狭窄或呈弥漫性狭窄,其中5 例既有局部狭窄也有弥漫性狭窄。CAV 阳性组患者诊断CAV 后平均随诊(47.7±22.3)个月期间,共有8例死亡,包括6 例CAV 3 级,2 例CAV 2 级,诊断CAV 后平均生存时间为(42.3±26.7)个月;6 例患者存在左心室收缩功能不全(左心室射血分数<50%),其中5 例死亡。
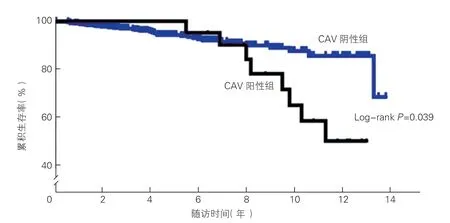
图2 CAV 阳性组及阴性组的累积生存率
经皮冠状动脉介入治疗(PCI)情况:CAV 阳性组中7 例行PCI,其中5 例系CVA 3 级,2 例系CVA2 级;随访期间死亡3 例,死因分别为猝死、消化道出血及心功能不全。此外该组中10 例CAV 3 级患者中5 例因冠状动脉严重弥漫性狭窄而未行PCI,诊断CAV 后随访期间,3 例死亡,其中1 例猝死,2 例死于心功能不全。
CAV 阳性组及阴性组的单因素分析(表1):CAV 阳性组及阴性组的患者年龄、性别、体重指数以及供体年龄、性别,移植前病因,术前群体反应性抗体(PRA)阳性及术后PRA 阳性,人类白细胞抗原(HLA)位点错配和供心冷缺血时间等差异均无统计学意义(P均>0.05)。此外,CAV 阳性组患者中也未观察到更多术前新生供体特异性抗体(donorspecific antibody,DSA),鉴于本中心DSA 检测例数较少,此次未能分析新生DSA 与CAV 的关系。单因素分析结果表明,术后总胆固醇水平异常、术后未坚持服用他汀类药物、术后吸烟史、术后免疫抑制剂选择与CAV 的发生相关(P均<0.05)。与CAV阴性组患者相比,阳性组患者术后总胆固醇水平异常的比例(50.0% vs 15.9%,P<0.01)、术后总胆固醇平均值[(5.76±1.02)mmol/L vs(4.91±1.37)mmol/L,P<0.01],术前吸烟史的比例(68.2% vs 47.1%,P=0.05)均更高。CAV 阳性组患者中未观察到更多的术前外周血管疾病、术前糖尿病史及更高的术后糖化血红蛋白水平。
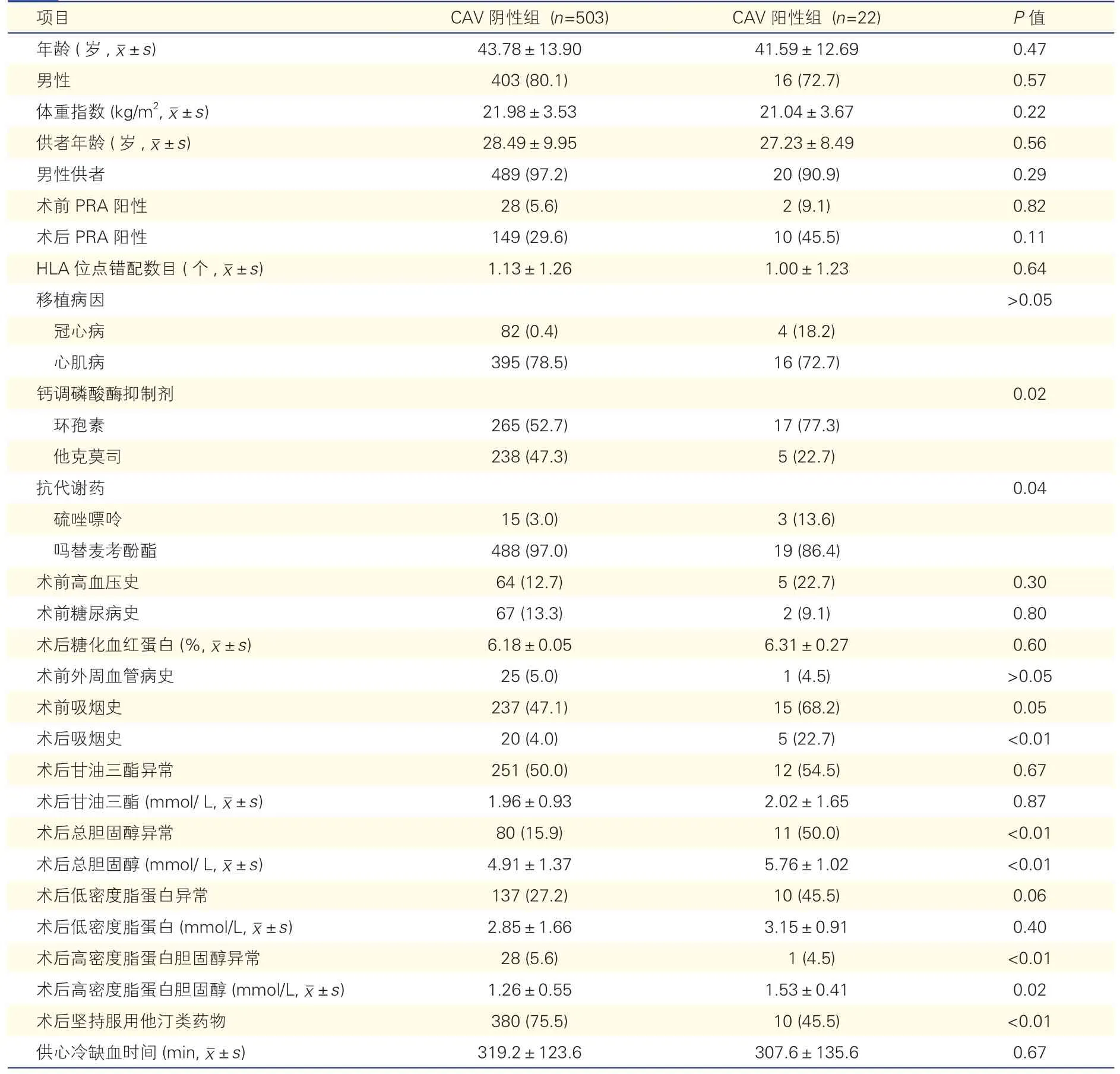
表1 CAV 阴性组及阳性组的单因素分析 [例(%)]
多因素回归分析:结果显示,术后吸烟史(HR=4.957,95%CI:1.718~14.296,P=0.003)、术后未坚持服用他汀(HR=4.273,95%CI:1.736~10.517,P=0.002)及术后环孢素的使用(与术后使用他克莫司相比)(HR=2.748,95%CI:1.010~17.474,P=0.048)与CAV 的发生有关。CAV 阳性组在高胆固醇血症(P=0.062)方面的差异无统计学意义。
急性细胞排斥反应分析:185 例连续心脏移植患者术后1 年内采用心内膜活检诊断急性细胞排斥反应,并按照1990 年版ISHLT 急性细胞排斥反应(ACR)分级系统评价急性排斥反应的严重程度,分为0 级、Ⅰa 级、Ⅰb 级、Ⅱ级、Ⅲa 级、Ⅲb 级和Ⅳ级,分别标记为 0、1、2、3、4、5、6 分,计算每位患者ACR 评分(ACR 评分总分/心肌活检次数),CAV 阳性组中未观察到有更高的ACR 评分[(0.41±0.37)分 vs(0.69±0.62)分,P=0.048]。发生CAV 的患者中2 例有明确的术后1 年后停用免疫抑制剂的病史,其中1 例新生PRA 阳性。另外,与术后服用环孢素的患者相比,服用他克莫司的患者CAV 的发病率低(2.1% vs 6.0%,P=0.02);与术后服用硫唑嘌呤的患者相比,服用吗替麦考酚酯的患者CAV 的发病率低(3.7% vs 16.7%,P=0.04)。
3 讨论
本中心心脏移植CAV 的发生率明显低于ISHLT登记注册数据(术后5 年:2.7% vs 30%,术后10 年:10.4% vs 50%),可能是由于:(1)本中心心脏移植患者中以冠心病为病因者所占比例小(16.4%),ISHLT注册登记中占37.0%[5-7]。(2)本中心心脏移植患者中位年龄为46 岁,明显低于ISHLT 注册登记的54岁[7-8]。(3)种族和民族的差异也可能参与其中。(4)未行CTA 的患者未纳入到研究中,可能也是本中心CAV 发生率偏低的参与因素之一。
本研究单因素分析发现术后总胆固醇升高的患者CAV 的发病率更高,CAV 阳性组术后总胆固醇平均值更高。国外一项纳入297 例患者的研究,也发现术后胆固醇升高是CAV 发生的重要危险因素之一[9]。这可能与高胆固醇血症可促进纤维脂质增生有关[10]。多因素分析显示术后是否坚持服用他汀类药物与CAV 的发生有关。根据国际指南建议心脏移植患者若无他汀类药物使用禁忌证术后均常规加用[11]。Kobashigawa 等[12]纳入125 例患者平均随访48 个月的多中心研究,发现血管内膜厚度小于0.5 mm 组他汀类药物的使用比例较大于0.5 mm 组更高(41% vs 25%,P<0.05)。此外,还有研究表明他汀类药物还可通过免疫调节作用减缓CAV 的进展[13-15],以及被证明能抑制促炎细胞因子的活性并保护人心脏移植患者的冠状动脉内皮功能[16]。
单因素及多因素危险因素分析均表明有术后吸烟史的患者CAV 发生率增加。Botha 等[17]纳入了526 例心脏移植患者平均随访(10.1±4.4)年的研究,发现移植后吸烟史是CAV 发生的重要预测因子。可能与吸烟导致全身性炎症和氧化应激增加,从而导致心肌和血管的破坏有关[18-19]。
本研究未发现术前高血压史、术前糖尿病史及术后糖化血红蛋白水平与CAV 的发生存在统计学相关性。可能与本中心术前高血压史患者比例较低且术后血压控制好有关。本中心患者术后随访时间相对较短,糖尿病病史与CAV 的关系可能需要更长期的观察。
有研究发现排斥反应评分越高、排斥反应发作次数越多,是CAV 发生的独立危险因素[8,20],但也有研究表明急性排斥反应与CAV 的发生无关[21],目前急性排斥反应与CAV 发生的关系仍存在争议[22]。本研究并未发现术后第1 年CAV 阳性组有更高的排斥反应评分,可能与急性细胞排斥反应发生率低有关,本中心一项纳入214 例受体的研究,发现采用巴利昔单抗联合经典三联免疫抑制方案,心脏移植术后1 年急性细胞排斥反应发生率为8.4%[23],明显低于ISHLT 报道的24.2%[24]。本中心患者在术后第1 年内依从性较好,但心脏移植1 年内无急性细胞排斥反应的患者,在心脏移植术后中晚期,若自行减量或停用免疫抑制治疗可能都会影响急性细胞排斥反应的发生。
在非免疫因素中,目前很多研究表明供者年龄与CAV 的发生有关[25-28],本研究中CAV 阳性组及阴性组在供体年龄无显著性差异,原因可能是本中心供者年龄低于西方国家(供者年龄中位数,30 岁vs 42 岁)[7]。本研究未发现CAV 与HLA 位点错配、术前及术后PRA 阳性及供心冷缺血时间等明显相关,可能与CAV 阳性组例数不够多、观察时间较短、术前PRA 阳性率低和PRA 阳性患者的抗体水平亦较低等有关。本次研究没有统计热缺血时间,需要进一步研究。
目前尚不清楚钙调磷酸酶抑制剂在CAV 预防方面是否存在差异。一项在343 例首次接受心脏移植的患者进行的多中心随机试验表明,虽然环孢素A+吗替麦考酚酯组和他克莫司+吗替麦考酚酯组术后1 年生存率没有显著性差异,他克莫司+吗替麦考酚酯组排斥反应发生率明显低于环孢素A+吗替麦考酚酯组[29]。另一项单中心前瞻性随机试验纳入了60 例心脏移植患者,发现术后10 年使用他克莫司+吗替麦考酚酯组未发生CAV 的比例明显高于环孢素A+吗替麦考酚酯组(45.8% vs 8.0%,P=0.003)[30]。本中心单因素分析发现相比于环孢素A,使用他克莫司的患者CAV 的发生率更低,本研究的结果与上述国外研究相似。本研究还发现,相比于使用硫唑嘌呤,使用吗替麦考酚酯的患者CAV 的发生率更低。Kaczmarek 等[31]在一项单中心前瞻性研究中证实,吗替麦考酚酯与硫唑嘌呤相比能够显著地降低CAV 的发生率。Johnsson 等[32]发现吗替麦考酚酯是唯一一种几乎能完全抑制成纤维细胞增殖的免疫抑制药物,具有优异的免疫抑制特性,通过抑制成纤维细胞增殖和保护血管内皮来预防CAV。此外Rose等[33]观察到与硫唑嘌呤相比,吗替麦考酚酯能减少抗内皮波形蛋白抗体产生。本中心使用西罗莫司的患者较少,未能得到其与CAV 的关系。
本研究的不足之处在于为回顾性分析,非随机对照研究,且CAV 阳性组和阴性组例数差异较大,导致结果可能存在偏倚。本中心在2011 年5 月后未再常规行心内膜活检诊断排斥反应,因此仅分析了2004 年6 月至2011 年5 月连续心脏移植患者心内膜活检结果与CAV 关系。因为去神经作用,CAV通常表现为无症状心肌梗死、严重心律失常及猝死,本中心生存率明显高于国际数据,CAV 的发病率及致死率可能稍被低估。

