1株微生物絮凝剂产生菌的分离、鉴定与絮凝剂的成分分析
李娜 范祎立 李雪


摘要:从活性污泥中筛选分离得到产微生物絮凝剂的菌株G1-3。经形态观察、生理生化特性分析以及基于16S rDNA系统进化分析,该菌株鉴定为交替单胞菌属(Alteromonas)。该菌株能在特定培养基中产生一种白色絮状沉淀,其产率为2.4 g/L,且该絮状胞外产物对高岭土悬液的絮凝率可达93.06%。经呈色反应分析,该产物主要成分为多糖和蛋白质,其中多糖含量为31.38%,蛋白质含量为16.52%。通过高效液相色谱分析,该胞外产物主要由天冬氨酸、亮氨酸、谷氨酸等17种氨基酸,以及葡萄糖、核糖、半乳糖等10种单糖组成。
关键词:微生物絮凝剂;产絮菌;分离;鉴定;成分分析
中图分类号: X172 文献标志码: A 文章编号:1002-1302(2019)13-0288-05
絮凝技术是污水处理中效率高、应用广泛且成本低廉的常用方法之一。在含有悬浮颗粒(>1.0 μm)和胶体物质(1.0~1.0 μm)水体的处理过程中,絮凝剂能与这些颗粒物质及色素、重金属离子等污染物结合,形成较大絮凝体沉降至水底,以净化水体[1]。而微生物絮凝剂是利用生物技术,通过微生物发酵、分离提取而得到一种新型、高效、价廉的新型水处理絮凝剂[2]。与传统絮凝剂相比,微生物絮凝剂的二次污染小、安全性高、易被微生物降解、对环境友好,应用领域比其他絮凝剂宽泛[3],使得其成为当下开发研究的重点。
本研究从活性污泥中筛选出1株生物絮凝剂产生菌 G1-3,该菌在肉汤培养基中产生一种特殊的胞外产物,呈白色絮状,该产物具有优良的絮凝特性。本研究通过形态特征、生理生化特性及基于16S rDNA系统进化分析,对该菌进行菌株鉴定,并对白色絮状沉淀物进行成分分析,旨在为微生物絮凝剂提供一种新材料,扩大应用范围。
1 材料与方法
1.1 材料
1.1.1 菌株 絮凝剂产生菌G1-3,由笔者所在实验室从活性污泥中分离、筛选所得,由中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)保藏,编号为CGMCC No:14457。
1.1.2 培养基 肉汤培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,固体培养基琼脂添加量为20.0 g,H2O 1 000 mL,pH值为7.2~7.4,121 ℃灭菌20 min。
PDA固体培养基:去皮马铃薯200.0 g,葡萄糖20.0 g,琼脂20.0 g,H2O 1 000 mL,pH值自然,121 ℃条件下灭菌 20 min。
1.2 方法
1.2.1 微生物絮凝剂产生菌的筛选 取天津市某污水处理厂的活性污泥,取合适浓度的经无菌水稀释的稀释液分别在肉汤固体培养基和PDA固体培养基平板上涂布,于37 ℃培养24 h。挑选其中形态各异的单菌落进行分离纯化,将纯化后的菌株接种于100 mL肉汤培养基中,于37 ℃、200 r/min摇床培养20 h,备用。
在100 mL量筒内加入0.4 g高岭土、4 mL 1%的CaCl2溶液、2 mL菌株发酵液,在200 r/min转速快速搅拌5 min,然后80 r/min,慢速搅拌10 min,静置一段时间,测上清液在 550 nm 处的吸光度,根据吸光度计算絮凝率。计算公式为
μ=(A-B)/A×100%。
其中,μ表示絮凝率,A表示参照上清液的浊度,B表示加入发酵液絮凝之后上清液的浊度[4]。
1.2.2 菌株形态观察 将菌株接种于肉汤固体培养基上,通过3区划线得单菌落,观察其形态。
扫描电镜下观察菌株G1-3的微观形态:2.5%戊二醛固定,0.1 mol/L PBS清洗3~4次,1% OsO4固定,0.1 mol/L PBS清洗3~4次,分别用50%、70%、80%、90%、100%乙醇,体积比为2 ∶ 1的乙醇与醋酸戊酯、体积比为1 ∶ 1的乙醇与醋酸戊酯依次脱水,纯戊酯脱水30 min,临界点干燥,喷金,于扫描电镜下观察[5]。
1.2.3 胞外絮状产物成分分析 样品的多糖定性采用莫氏试验、斐林试验,蛋白质定性采用茚三酮试验、双缩脲反应,糖的定量测定采用苯酚-硫酸法,蛋白质定量测定采用考马斯亮蓝法,具体操作参见文献[6]。
1.2.4 高效液相色谱分析氨基酸与单糖 发酵液中的白色絮状物5 000 r/min离心经3次无菌水离心、洗涤,用真空冷冻干燥器干燥,取固体,经水解预处理后,采用高效液相色谱法分析其中的氨基酸与单糖组成。
1.2.4.1 单糖组成测定 称取冻干的样品2 mg,加入 2 mol/L 三氟乙酸溶液0.5 mL,在120 ℃条件下水解 120 min,氮吹仪吹干。向水解干燥后得到的单糖样品中加入溶于无水甲醇、0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(PMP)试剂和0.3 mol/L NaOH溶液各0.5 mL,充分混匀后,水浴70 ℃反应30 min。冷却至室温,加入0.3 mol/L HCl 0.5 mL,充分混匀,加入0.5 mL氯仿,充分震荡萃取,离心后用0.22 μm滤膜过滤后上机。
1.2.4.2 氨基酸组成测定 取一定质量样品于20 mL水解管中,加入16 mL 6 mol/L的盐酸溶液,真空脱气30 min,充氮封管,110 ℃下水解22~24 h,冷却后定容至50 mL。取1 mL水解液于小瓶中,真空脱酸抽干,加入1 mL 0.02 mol/L 盐酸溶液,充分溶解。精密量取上述溶液 500 μL,置于5 mL塑料离心管中,加入1 mol/L三乙胺乙腈溶液250 μL,混匀,加入0.1 mol/L异硫氰酸苯酯乙腈溶液 25 μL,混匀,室温放置1 h后,加2 mL正己烷,剧烈振摇,放置10 min,取下層溶液用0.22 μm的水相膜滤膜过滤后上机分析。
2 结果与分析
2.1 菌株的分离
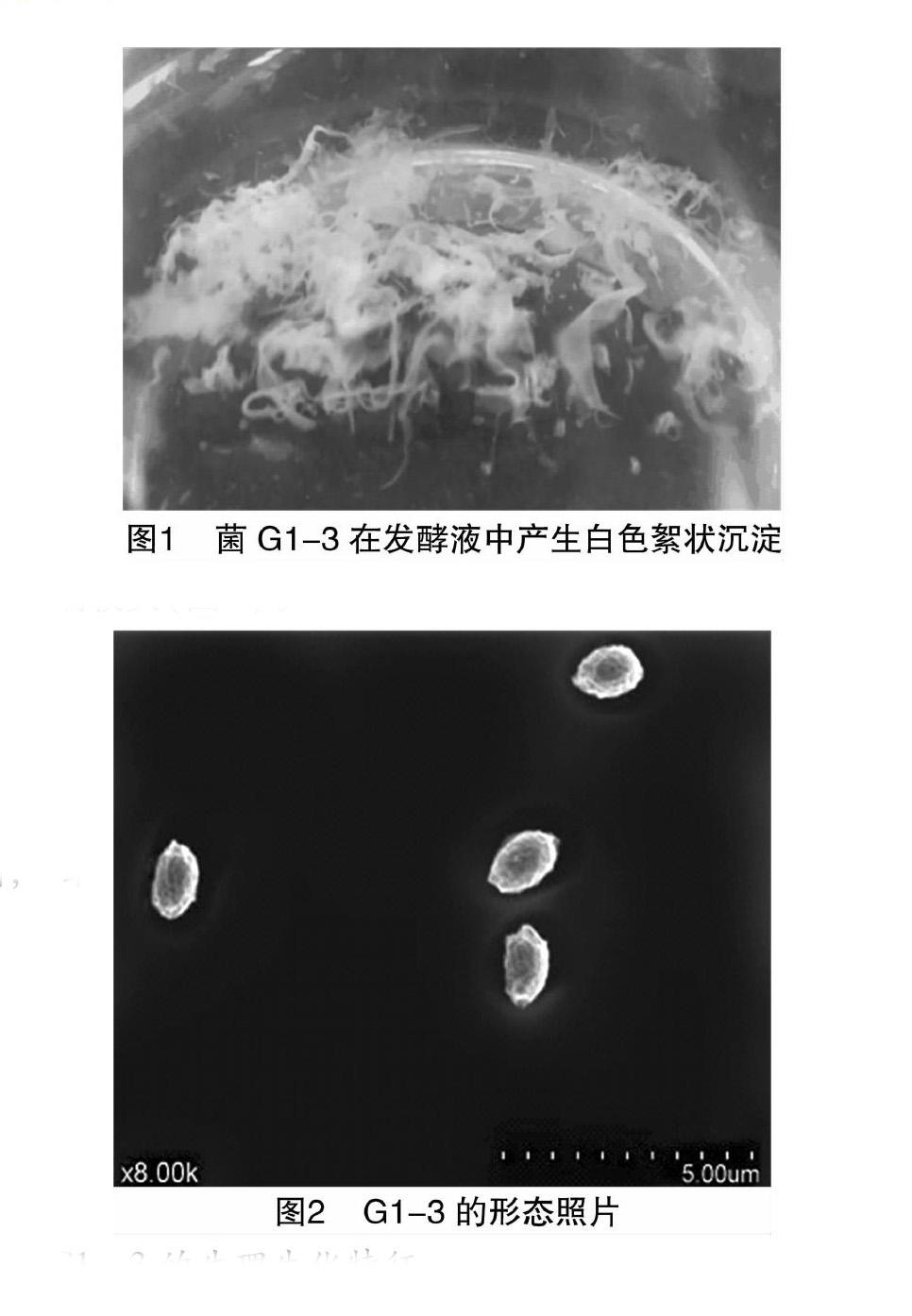
经固体平板划线分离,从活性污泥中得到5株菌株,经纯化、培养后,发现其中1株菌能在液体培养基中产生一种白色絮状沉淀(图1)。以对高岭土悬浊液的絮凝活性为指标,该絮状沉淀的絮凝率可达93.2%,且该菌絮凝特性稳定,将该菌命名为G1-3。
2.2 形态观察
G1-3菌株在肉湯固体培养基上呈白色圆形不透明菌落,其表面光滑、有黏性、边缘整齐,菌落大小为1~2 d/mm。通过扫描电镜观察菌株G1-3表面形态呈椭圆状,一端较圆,一端较尖(图2)。
2.3 G1-3的生理生化特征
对菌株G1-3进行生理生化分析,根据VITEK全自动微生物检测系统的分析,菌株G1-3的生理生化特征见表1。菌G1-3可利用葡萄糖为唯一碳源生长,但不能利用麦芽糖、蔗糖、甘露糖、阿拉伯糖等作为唯一碳源生长;在生长过程中,能产生H2S,且L-脯氨酸芳胺酶、L-苹果酸盐同化为阳性。鉴定结果表明,G1-3菌株的形态和生理生化特性与交替单胞菌属较为一致。
2.4 16S rDNA序列测序
对菌株G1-3测序,经过提取DNA、PCR扩增、连接转化等操作,应用BLAST程序、NCBI数据库里的信息进行同源性搜索,进行分子生物学鉴定,绘制出系统进化树见图3。根据Blast结果,G1-3属于γ-变形菌纲(Gammaproteo bacteria)交替单胞菌属(Alteromonadales),与Alteromonadales bacterium DN3-1亲源关系最近。
2.5 G1-3菌株的生长特性
将菌株G1-3接种至100 mL肉汤培养基中,于 200 r/min 3 ℃条件培养,测定菌株G1-3菌体在2、4、6、8、10、12、24 h的生长情况。根据发酵液在波长600 nm处的吸光度,制得该菌株生长曲线,由图4可知,G1-3仅培养 6 h就呈现指数生长,培养至18 h达到稳定期。
采用干重法,测定菌株G1-3菌体在肉汤培养基中生长2、4、6、8、10、12、24 h时菌株胞外絮状产物的产量。胞外产物较菌株生长晚2 h,培养至8 h时开始快速生成,而至22 h就基本停止,产量在此时达最高,为2.4 g/L。且当培养超过 48 h 时,发酵液中无该白色絮状物,该胞外产物被分解。
2.6 絮凝率测定
根据来源不同,生物絮凝剂可分为3类[7]:微生物细胞,如某些细菌、酵母;微生物细胞提取物,如酵母细胞壁的葡聚糖;微生物细胞代谢产物。为探究该菌株絮凝活性成分的分布情况,对比发酵液、胞外絮状产物、菌细胞悬液、去菌体上清液对高岭土悬浊液的絮凝效果。由图6可知, 胞外产物对高
岭土的絮凝效率高达93.06%,而发酵液原液只有 65.48%,菌细胞悬液以及去菌体上清液的絮凝率仅为10%左右,这充分说明G1-3菌株的絮凝特性与菌体细胞无关,主要由其细胞代谢产物产生。
该絮凝菌产生的生物絮凝剂为白色絮状物,存在于菌体外的培养液中,由微生物分泌到胞外。根据絮凝机理,这些胞外产物可能与水中的杂质通过吸附架桥作用、电中和作用、卷扫作用等[8-10]对水中杂质进行絮凝沉降,以达到水质澄清目的。
2.7 成分分析
2.7.1 外形观察 G1-3菌株的白色絮状物在培养过程中,沉淀聚集在一起,肉眼观察为半透明膜状(图7)。经真空冷冻干燥后,呈乳白色疏松层叠状,在电子显微镜下进行扫描观察,可以观察到絮凝物质呈现折叠膜状结构(图8)。
2.7.2 蛋白质与糖定性定量分析 根据文献报道,当下生物絮凝剂的化学组成可分为以下几类[11]:糖类物质,多肽、蛋白质和DNA,脂类物质,目前已发现的以多糖类物质为主,脂类最少。为探究G1-3菌株胞外絮状产物的成分,对其进行分析。蛋白质定性试验时,样品在茚三酮试验中出现蓝紫色,结果呈阳性;且在双缩脲试验中,出现紫玫瑰色,呈阳性,确定G1-3胞外絮状物中含有蛋白质。糖定性试验时,样品在莫氏试验中出现紫红色环,为阳性,在斐林试验中,无红色或黄色的氧化亚铜沉淀生成,可认定该G1-3胞外絮状产物中含有多糖,但还原糖含量微弱。
根据考马斯亮蓝试验结果,测定样品中蛋白质含量为16.52%;根据苯酚-硫酸试验,测定其总糖含量为31.38%。上述结果表明,该产物以糖类物质为主。
2.7.3 氨基酸与单糖的分析 样品经水解预处理后,通过高效液相色谱分析其氨基酸含量(表2)。经水解后,发现该胞外产物含有17种氨基酸,其中天冬氨酸含量最高,达 1.993 g/kg,而亮氨酸和谷氨酸分别为1.908、1.760 g/kg,精氨酸、丙氨酸、脯氨酸、甘氨酸和苯丙氨酸的含量均达 1.000 g/kg 以上。
采用高效液相色谱分析单糖含量,由表3可知,经水解后,发现该胞外产物含有10种单糖,以葡萄糖、核糖、半乳糖为主,其含量明显高于其他糖类,葡萄糖含量高达 428.37 mg/kg,而核糖与半乳糖含量分别为 270.59、224.95 mg/kg。
3 结论
从活性污泥中分离得到1株生物絮凝剂产生菌 G1-3,经形态特征、生理生化特性和16S rDNA基因序列鉴定,其属于交替单胞菌属(Alteromonadales)。
关于G1-3菌株絮凝活性成分的分布,以高岭土絮凝率为指标,其胞外产物絮凝率为93.06%,其发酵液原液絮凝率较低,且菌细胞悬液以及去菌体上清液无絮凝特性。
生物絮凝剂的化学性质:茚三酮显色试验呈蓝色,双缩脲反应呈阳性;莫氏反应中浓硫酸与样品试剂混合液分界面有清晰的紫环出现。表明G1-3菌株的胞外絮状产物中含有多糖和蛋白质,根据试验,多糖含量明显高于蛋白质含量,糖与蛋白质比为1.9 ∶ 1。
G1-3菌株的白色絮状产物经分离、真空冷冻干燥后,呈乳白色疏松层叠状,经高效液相色谱分析,該白色絮状沉淀中含17种氨基酸,以天冬氨酸、亮氨酸、谷氨酸、精氨酸为主,含10种单糖,以葡萄糖、核糖、半乳糖为主。
参考文献:
[1]封 培,王世梅,周立祥. 生物絮凝剂产生菌的分离鉴定及其在饮用水除浊上的作用[J]. 环境科学学报,2009,29(8):1666-1671.
[2]赵 凤,张蔚萍,胡庆华. 微生物絮凝剂的絮凝机理及应用研究[J]. 环境与可持续发展,2009(2):6-8.
[3]孙鹏轩. 微生物絮凝剂的研究进展及应用现状[J]. 环境保护与循环经济,2013(1):53-55.
[4]王 雪. 生物絮凝剂混菌发酵条件优化及动力学分析[D]. 哈尔滨:哈尔滨工业大学,2009.
[5]孙镇平,李 佳,刘洪红,等. 不同处理技术对环境扫描电镜下细菌原始形态的影响[J]. 扬州大学学报(农业与生命科学版),2013(1):41-43.
[6]王 薇. 产絮菌合成生物絮凝剂特性及絮凝成分解析[D]. 哈尔滨:哈尔滨工业大学,2009.
[7]马 放,段姝悦,孔祥震,等. 微生物絮凝剂的研究现状及其发展趋势[J]. 中国给水排水,2012,28(2):14-17.
[8]董晓斌. 新型生物絮凝剂的研究与应用[J]. 甘肃联合大学学报(自然科学版),2006,20(1):52-54.
[9]Li Y M,Li Q,Hao D K,et al. Characterization and flocculation mechanism of an alkali-activated polysaccharide flocculant from Arthrobacter sp. B4[J]. Bioresource Technology,2014,170:574-577.
[10]Kumar C G,Joo H S,Choi J W,et al. Purification and characterization of an extracellular polysaccharide from haloalkalophilic Bacillus sp. I-450[J]. World Journal of Microbiology and Biotechnology,2004,34:673-681.
[11]王 兰,唐 静,赵 璇. 微生物絮凝剂絮凝机理的研究方法[J]. 环境工程学报,2011,5(3):481-488.

