转基因棉花MON88701 品系特异性实时荧光PCR 检测方法的建立
雷水娟, 刘二龙, 卢 丽, 吕英姿, 蒋 湘, 李嘉琪, 夏柔菲江西科技师范大学生命科学学院,江西 南昌008; 黄埔海关,广东 广州5070;广州海关, 广东 广州506
棉花是一种富含蛋白质、油和料纤维的高附加值经济作物,其含纤维素87%~90%,常作为纺织和服装的一种重要原料(毕美超,2016)。 2018 年我国棉花种植面积为335.23 万hm2,全国棉花总产量609.6万t (国家统计局,2018),2017 年我国累计进口棉花115.48 万t,比2016 年增长29%(搜棉网,2018)。
MON88701 是一种耐受麦草畏和草铵膦2 种除草剂的转基因棉花品系,由孟山都公司研发。MON88701 经由农杆菌介导PV-GHHT6997 质粒转入Coker 130 棉花研发而成,其T-DNA 含有dmo 基因盒和bar 基因盒,分别编码麦草畏单加氧酶和膦丝菌素N-乙酰转移酶,它们在转基因植株内均为1个拷贝。 MON88701 最早于2013 年在美国上市,目前在巴西、澳大利、新西兰、加拿大、哥伦比亚等国家已经获得批准种植或允许用作食品、饲料原料,但在我国尚未获得农业部批准。
2016 年欧盟转基因食物与饲料基准实验室建立了一种MON88701 品系特异性的实时荧光聚合酶链反应(polymerase chain reaction,PCR)检测方法(European Union, 2016), 但 目 前 国 内 尚 未 见MON88701 品系特异性检测方法的报道。 为打破其他国家和地区设置的转基因产品贸易技术壁垒,完善我国转基因产品品系识别及定量检测技术体系,保护消费者对转基因产品的知情权,本研究基于MON88701 5′端邻接区序列,建立MON88701 品系特异性实时荧光PCR 检测方法,为相关部门监管转基因棉花MON88701 品系提供技术支持。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 供试材料 转基因油菜MON88302、转基因油菜DP-073496-4、转基因棉花MON88913、转基因大豆A2704-12、转基因大豆GTS 40-30-2、转基因玉米MIR162、转基因玉米MON810、转基因玉米NK603、转基因玉米BT11、转基因甜菜H7-1、非转基因大米和非转基因棉花新陆早51 号。 供试材料为本实验室购置保存;棉花内源基因棉花乙醇脱氢酶C 基因(AdhC 基因)(Mazzara,et al.,2007)和转基因棉花MON88701 品系特异性片段双基因阳性质粒样品为本实验室构建。
1.1.2 主要试剂 Primex Ex Taq(2×) for qPCR(大连宝生物);DNA 提取试剂盒(北京天根公司);终浓度10 μmol·L-1的引物和探针工作液(闪晶生物公司)。
1.1.3 主要仪器与设备 实时荧光定量PCR 仪ABI 7500、ABI 7500FAST(美国应用生物系统公司);微滴式数字PCR 系统QX 200 (美国伯乐公司);微量分光光度计nanodrop 2000c(美国Thermo公司);研磨机(德国IKA)。
1.2 实验方法
1.2.1 样品基因组DNA 的提取与纯化 称取100 mg 研磨好的样品,使用基因组DNA 提取试剂盒提取样品中的基因组DNA,然后采用微量分光光度计测定提取基因组DNA 的浓度,最后将已测定好浓度的DNA 溶液置于-20 ℃条件下备用。
1.2.2 引物和探针设计 根据相关基因数据库所述转基因棉花MON88701 品系转入的基因盒5′端与棉花基因组邻接区序列,设计引物和探针通过Primer 5.0 软件。 然后在NCBI 网站上将设计好的引物、探针通过Blast 比对,确定引物和探针的理论特异性;用棉花内源基因AdhC 对棉花来源样品DNA 进行检测。
1.2.3 实时荧光PCR 反应体系退火温度及引物探针配比的优化 采用宝生物酶系混合物推荐的引物探针比,采用不同体积的引物探针进行优化。
A 组的扩增反应体系为:25 μL,包括Premix Ex TaqTM12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol·L-1检测引物MON88701-F 和MON88701-R 各0.5 μL,10 μmol·L-1检测探针MON88701-P 1 μL,34000 拷贝·μL-1DNA 模板(转基因棉花MON88701品系基因组DNA)2 μL 和ddH2O 8.3 μL。
B 组的扩增反应体系为:25 μL,包括Premix Ex TaqTM12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol·L-1检测引物MON88701-F 和MON88701-R 各0.4 μL,10 μmol·L-1检测探针MON88701-P 0.8 μL,34000 拷贝·μL-1DNA 模板(转基因棉花MON88701品系基因组DNA)2 μL 和ddH2O 8.7 μL。
C 组的扩增反应体系为:25 μL,包括Premix Ex TaqTM12.5 μL,ROX Reference Dye II 0.2 μL,10 μmol·L-1检测引物MON88701-F 和MON88701-R 各0.2 μL,10 μmol·L-1检测探针MON88701-P 0.4 μL,34000 拷贝·μL-1DNA 模板(转基因棉花MON88701品系基因组DNA)2 μL 和ddH2O 5.9 μL。
退火温度分别设置为58、60 ℃,反应程序为95℃30 s,95 ℃5 s,58 ℃34 s,40 个循环,于58、60℃分别收集荧光信号。
1.2.4 实时荧光PCR 检测方法的特异性 提取转基因油菜MON88302、转基因油菜DP-073496-4、转基因棉花MON88913、转基因大豆A2704-12、转基因大豆GTS 40-30-2、转基因玉米MON810、转基因玉米BT11、转基因玉米MIR162、转基因玉米NK603、转基因甜菜H7-1、非转基因棉花的基因组DNA 为模板,阳性对照为Adhc-MON88701 质粒,阴性对照为非转基因大米DNA。 通过己建立的转基因棉花MON88701 品系特异性实时荧光PCR 检测方法进行扩增, 对该检测方法的特异性进行鉴定。
1.2.5 实时荧光PCR 方法的灵敏度及标准曲线建立 将提取的Adhc-MON88701 质粒DNA 稀释后用微滴数字PCR 进行定量,然后用TE 缓冲液分别稀释至340000、34000、17000、3400、1700、340、170、34 和17 拷贝·μL-1,进行线性范围测试、可重复性测试和灵敏度检测。 上述9 个浓度DNA 溶液进行实时荧光PCR 扩增,每个浓度3 个平行孔。
1.2.6 可重复性测试 对1.2.5 中倍比稀释的DNA 溶液, 测定本实验建立的方法的可重复性,并统计分析其标准偏差、相对标准偏差。
2 结果与分析
2.1 实时荧光PCR 检测方法的建立与优化
2.1.1 PCR 检测方法的建立与优化 该实验设计的多对引物和探针,是通过分析转基因棉花MON88701 品系转入的基因盒5′端与棉花基因组邻接区序列(图1),然后分析引物与探针的反应效率、扩增曲线和扩增效果,对引物和探针进行筛选,最终选择MON8870-F/R/P 引物和探针建立转基因棉花MON88701 品系特异性检测方法,序列见表1。
2.1.2 PCR 反应体系退火温度及引物探针配比优化 退火温度为58 ℃时(图2),从左到右分别为B、A 和C 组的扩增曲线,3 组均扩增良好,B 组Ct值最小;退火温度为60 ℃时(图3),从左到右分别为A、B 和C 组的扩增曲线,3 组均可有效扩增,但Ct 值均比58 ℃时稍高,所以基于经济性和扩增效率,考虑选择58 ℃作为退火温度、B 组引物探针配比为本研究的扩增反应体系比较合适。

图1 MON88701 特异性序列Fig.1 Specfic sequence of MON88701
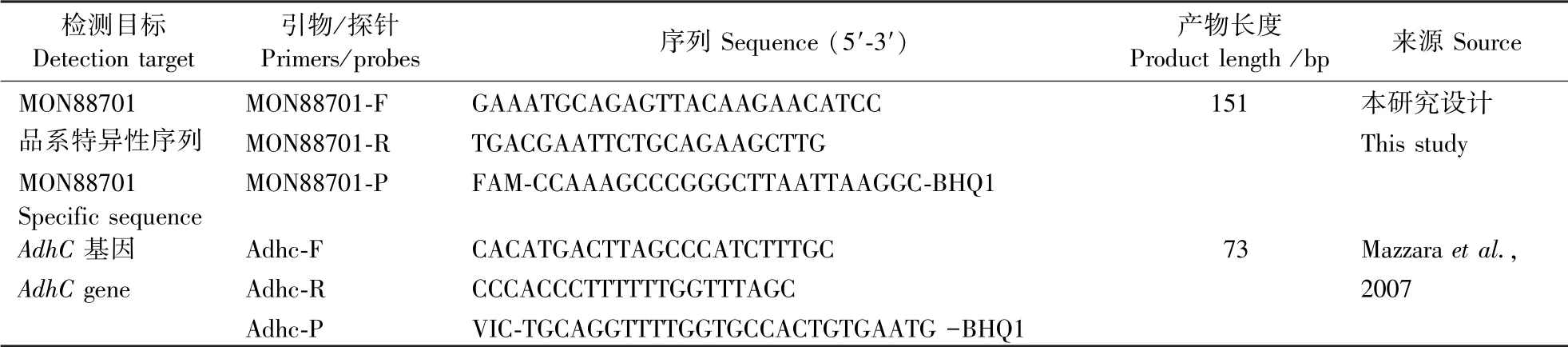
表1 实时荧光PCR 的引物、探针Table 1 Primers and probes for real-time fluorescent PCR

图2 退火温度为58 ℃时的扩增图Fig.2 Amplification plots of A, B and C prime/probe group at 58 ℃

图3 退火温度为60 ℃时的扩增图Fig.3 Amplification plots of A, B and C prime/probe group at 60 ℃
2.2 特异性测试
采用1.2.4 中14 种样品的DNA 测定本实验建立的转基因棉花MON88701 品系特异性检测方法的特异性,结果(图4) 表明:采用转基因棉花MON88701 品系特异性引物MON88701-F/R 和探针MON88701-P 进行实时荧光PCR 时,典型荧光扩增曲线的只有阳性样品Adhc-MON88701,无典型曲线的均为其他农作物材料样品,说明本实验的检测方法特异性良好。

图4 MON88701 的特异性测试Fig.4 Specific test of MON88701
2.3 灵敏度测试
将提取的Adhc-MON88701 质粒DNA 溶液分别稀释至340000、34000、17000、3400、1700、340、170、34和17 拷贝·μL-1共9 个浓度梯度进行检测(图5)。9 个浓度梯度均有典型扩增曲线,其最低检测拷贝数为34 拷贝(25 μL 反应体系上样量2 μL)。 扩增图从左至右分别为340000~17 拷贝·μL-1扩增曲线。
2.4 制备标准曲线
利用2.3 中9 个浓度梯度DNA 作为模板,进行转基因棉花MON88701 品系实时荧光PCR 检测,建立转基因棉花MON88701 品系特异性序列标准曲线(图6),以实现对转基因棉花MON88701 品系的相对定量分析。 测试结果的Ct 值如表2 所示,根据表2 中的Ct 值数据与在34 ~680000 拷贝(25 μL 体系中上样量为2 μL)范围内9 个浓度的对数值与所得Ct 值建立标准曲线如图6 所示,线性回归方程为y=-3.48x+ 39.91,R2=0.99,扩增效率为94%(介于90% ~110%),表明本实验建立的MON88701 品系特异性实时荧光PCR 检测方法在模板量34~680000 拷贝范围内线性相关性良好,扩增效率高,符合ENGL(european network of gmo laboratories)相关要求(Grl-gmff,2009);在模板量为34~680000 拷贝的线性范围内,其Ct 值的SD 介于0.22~0.62,RSD 介于0.78%~2.90%,表明在线性范围内最低模板量34 拷贝时,其SD 和RSD 均小于25%,所以确定本实验的定量检测下限为34 拷贝。
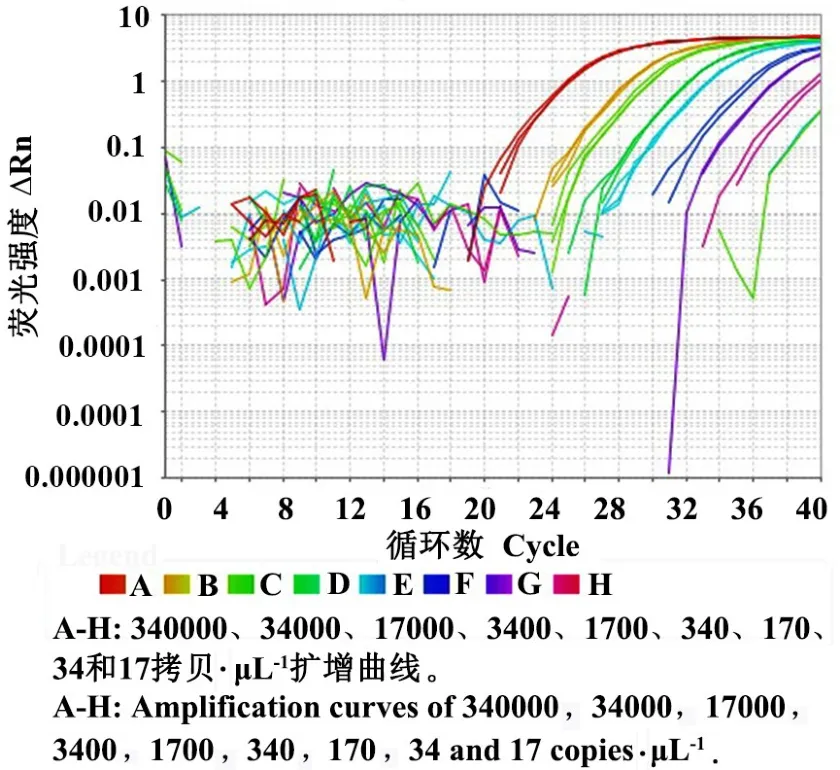
图5 MON88701 的灵敏度测试Fig.5 Sensitivity test of MON88701

图6 MON88701 实时荧光PCR 标准曲线Fig.6 Standard curve of real-time PCR method for MON88701
3 讨论
为保证转基因产品标签制度顺利实施,需要建立准确、稳定的检测方法来对转基因作物进行有效鉴别(刘二龙等,2015)。 目前各国均研究和发展了一些基于不同技术平台的转基因检测方法,其中以基于核酸基础上的PCR 方法为主流(吴永彬等,2011)。 品系特异性实时荧光PCR 能对外源基因插入受体基因组位点的唯一性特征来设计引物探针进行检测(Kluga et al.,2012),具有特异、快速、高灵敏性和高能量等特点(Anklam et al.,2002),因此是目前被广泛认可和采用的一种检测方法。 目前已有多种转基因作物品系建立了实时荧光PCR 方法,如转Bt 基因大米(吴孝横等,2009)、转基因玉米Bt176(李葱葱等,2007)、转基因大豆(吴影等,2007)等。
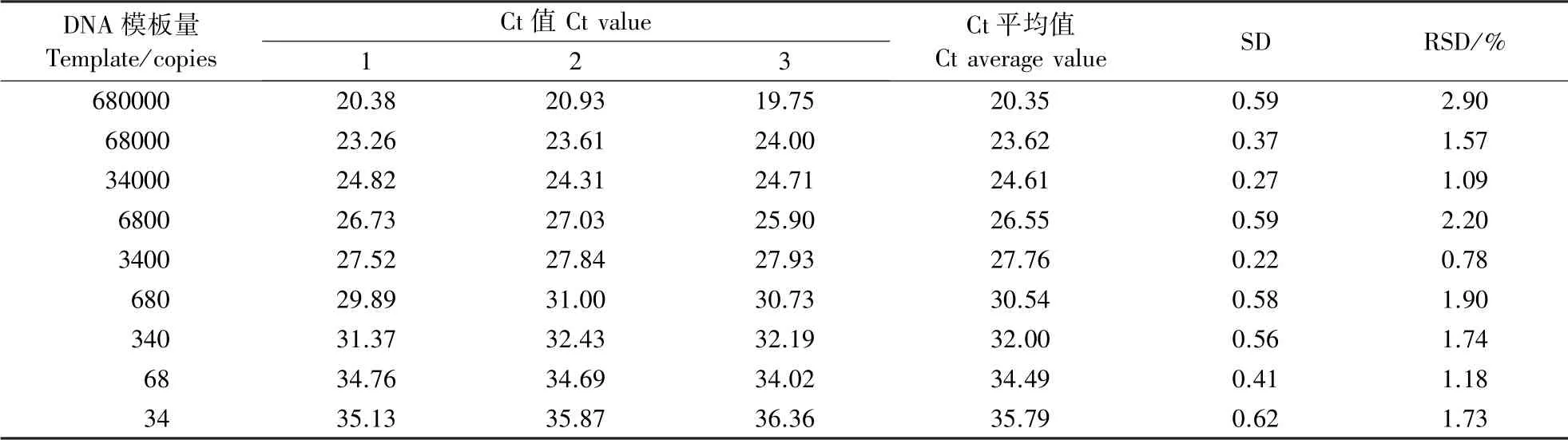
表2 实时荧光PCR 方法的灵敏度及可重复性测试Table 2 Sensitivity and repeatability test of real-time fluorescent PCR method
本研究针对转基因棉花MON88701 品系转入的基因盒5′端与棉花基因组邻接区序列来设计检测引物和探针,建立转基因棉花MON88701 品系特异性实时荧光PCR 检测方法,最低定量检测下限为34 拷贝,其扩增效率为94% (介于90% ~110%),重复性实验的SD 和RSD 均符合ENGL 要求,表明该方法具有良好的特异性、高灵敏度和稳定性强的优点,可应用于进出境口岸、农产品监管中转基因棉花MON88701 的检测。

