花期短期低氮处理对黄瓜抗坏血酸及可溶性糖含量的影响
李云云,李 强,余宏军,蒋卫杰
(中国农业科学院蔬菜花卉研究所,北京 100081)
黄瓜是我国保护地生产中栽培面积最大的蔬菜作物之一,其维生素、矿质元素及其他营养成分含量丰富,抗坏血酸(AsA)和可溶性糖含量是黄瓜果实重要的品质指标。研究表明,蔬菜的AsA和可溶性糖含量受到生物学特性、环境条件和施肥等因素影响,其中氮素营养供给是调控其含量变化的重要栽培措施之一。研究发现在菠菜[1]、生菜[2]、白菜[3]等叶菜类蔬菜中,不同氮素供给水平可以显著影响蔬菜叶片中可溶性糖、可溶性蛋白、有机酸、AsA等物质的含量,随着氮素供给水平的提高,蔬菜风味品质明显下降,可溶性糖、AsA含量并没有随着氮素供给的增加而增加,相反在低浓度氮素供给水平下,其可溶性糖和AsA含量提高,风味品质改善。刘玉梅等[4]研究发现,在黄瓜栽培中也有相同现象,氮肥过量施用会引起黄瓜果实风味品质下降(可溶性糖含量、可溶性固形物减少),低浓度氮素供给条件下,黄瓜幼苗叶片中可溶性糖含量和AsA含量增加[5-6],但是低氮供给对黄瓜果实中可溶性糖和AsA含量的影响及其调控还鲜有报道。
本试验通过营养液栽培方式对黄瓜进行短期低氮处理,探究黄瓜中AsA和可溶性糖含量的变化,希望为黄瓜栽培生产中合理使用氮肥,提高氮肥利用效率,改善果实品质提供有价值的理论依据和科学参考。
1 材料与方法
1.1 材料及处理
试验于2016年5~7月在中国农业科学院蔬菜花卉研究所无土栽培课题组玻璃温室内进行,所用材料为黄瓜“9930”(中国农业科学院蔬菜花卉研究所黄瓜育种课题组提供)。2016年5月21日选取饱满的黄瓜种子进行催芽,50℃温水浸泡30 min,5%次氯酸钠溶液遮光浸泡15 min,清水清洗3次后置于28℃恒温培养箱中孵育约24 h,种子露白后在穴盘中进行育苗。黄瓜植株长至一叶一心时选取长势一致的幼苗移植到29 cm×12.5 cm×7.5 cm的长方体水培槽中,每个水培槽中定植两株黄瓜植株。其中营养液为改进的hoagland营养液,其中各营养元素组分及浓度如下:Ca2+4 mmol/L,NH+41 mmol/L,K+6 mmol/L,PO43-1 μmol/L,SO42-3.5 μ mol/L,Mg2+2 mmol/L,Fe3+79.01 μ mol/L,Mo6+0.11 μmol/L,Cu2+0.32 μmol/L,Zn2+0.77 μmol/L,Mn2+9.59 μ mol/L,B3+46.26 μ mol/L。配制营养液所需水均为蒸馏水,并调整营养液pH值为5.8~6.0,水培期间采用电动通气泵装置为植株进行间歇供氧。
试验共分为3个处理,各处理的氮素供应浓度分别为 CK,12 mmol/L;T1,0 mmol/L;T2,3 mmol/L。除氮素浓度不一样外,其他营养元素含量一致。在黄瓜植株雌花开放当天进行短期(7 d)不同营养液处理,并将雌花开花当天记为0 d,分别在处理的0、1、3、5、7 d对黄瓜植株的叶片和果实进行取样和相关指标测定。其中,植株生长期间,每隔3 d更换一次营养液,处理之前将植株底部节位的根瓜摘除,取样果实及叶片统一保持在第5~8节位之间,其他栽培管理技术同日常生产管理一致。
1.2 测定指标及方法
1.2.1 黄瓜AsA的提取及测定
分别在处理的0、1、3、5、7 d取各处理植株叶片和果实,并用锡纸包裹后迅速置于液氮中,保存在超低温冰箱中,用于AsA含量测定,其中AsA相关提取和测定方法参考Kampfenkel等[7]的方法,稍加改进。
AsA和总量抗坏血酸(T-AsA,包括抗坏血酸氧化型AsA和还原型DHA)的提取:准确称取叶片样品0.3~0.6 g,果实样品1.0~3.0 g,加入6%(w/v)的预冷TCA溶液(含1 mmol/L的EDTA),在冰上研磨至匀浆,后定容至5 mL,于4℃下11 000 r/min离心20 min,收集上清液用于AsA和T-AsA 含量测定。
T-AsA含量测定反应体系:首先在离心管中加入0.8 mL 0.2 mol/L的磷酸钾缓冲液(pH值7.4)和0.2 mL待测样品上清液,然后依次加入0.2 mL 6 mmol/L的二硫苏糖醇溶液(DTT,用0.2 mol/L的磷酸缓冲液配制,并含有3%冰醋酸,现用现配),42℃温水浴15 min,取出后加入0.1 mL 0.5% 的N-ethylmaeimide溶液(NEM,用预冷的0.2 mol/L的磷酸钾缓冲液配制),室温静置2 min,而后分别依次加入1 mL 10%的TCA,0.8 mL 42%的磷酸,0.8 mL 2%的2,2’-双吡啶溶液(用70%乙醇配制溶液),0.4 mL 3% FeCl3溶液(现配现用),充分混匀后42℃水浴60 min,短暂离心后取上清液在525 nm波长处测定其吸光值,其中以0.2 mL磷酸缓冲液作为空白对照。根据T-AsA的标准曲线计算待测样品中的T-AsA含量。
T-AsA浓度的计算公式为:A525=0.735 9×C(T-AsA)-0.027 3,R2=0.993 6。 其 中,A525代 表525 nm波长处的吸光值,C(T-AsA)代表样品中T-AsA浓度。根据待测样品鲜重,进一步计算样品中T-AsA含量。
AsA含量测定反应体系:首先在离心管中加入0.8 mL 0.2 mol/L的磷酸钾缓冲液(pH值7.4)和0.2 mL待测样品上清液,然后依次分别加入1 mL 10%的TCA,0.8 mL 42%的磷酸,0.8 mL 2%的2,2’-双吡啶(用70%乙醇配制溶液),0.4 mL 3%FeCl3溶液(现配现用),充分混匀后42℃水浴60 min,短暂离心后取上清液在525 nm波长处测定其吸光值,其中以0.2 mL磷酸缓冲液作为空白对照。根据AsA的标准曲线计算待测样品中的AsA含量。
AsA 浓度:A525=0.837 2×C(AsA)-0.021 7,R2=0.996 8。其中,A525代表525 nm 波长处的吸光值,C(AsA)代表样品中AsA浓度。根据待测样品鲜重,进一步计算样品中AsA含量。
DHA含量即为T-AsA与AsA含量差,并根据AsA和DHA含量计算样品中氧化还原比率即AsA/DHA。
1.2.2 黄瓜可溶性糖的提取及测定
样品中可溶性糖的提取:准确称取叶片样品3~5 g,果实样品10 g,其中果实样品置于研钵中冰上研磨至匀浆,叶片样品中加入与样品质量等比例(w∶v=1∶1)的灭菌ddH2O冰上研磨至匀浆,将匀浆样品置于80℃热水浴1 h,水浴后12 000 r/min离心20 min,然后收集上清液经0.22μ m的滤膜过滤后,上样至高效液相色谱(HPLC)用于可溶性糖组成及含量测定。
样品可溶性糖的测定方法及其色谱条件:每个样品进样体积为10 μ L,上样至Waters 2695系列高效液相色谱仪(Waters,USA),仪器分别使用Enpower Pro工作站和Waters 2414示差折光监测器,色谱柱为Agilent Polaris 3 NH2(250×460 mm,3μ m),柱温为25℃,检测池温度为35℃,流动相为乙腈∶水=80∶20(v∶v),流速保持1 mL/min。
可溶性糖标准品共测定7种可溶性糖(图1),根据保留时间分别是木糖、果糖、葡萄糖、半乳糖、蔗糖、麦芽糖、乳糖,实际样品测定中共测出木糖、果糖、葡萄糖、蔗糖4种糖,部分样品测定出半乳糖,每个上样样品重复测定两次,每个处理均有3个生物学重复,计算3次重复的平均值作为最后结果。
数据处理及结果分析采用SPSS 16.0软件进行,采用DUNCAN法进行多重比较及差异显著性分析,其中,*和**分别表示处理与对照之间的差异显著性,即显著和极显著(P<0.05,P<0.01)。

图1 7种可溶性糖高效液相色谱图
2 结果与分析
2.1 短期低氮处理对黄瓜AsA含量的影响
短期低氮处理下,T1和T2黄瓜果实中的T-AsA和AsA含量均高于CK,但是随着处理时间延长和果实膨大发育,T-AsA、AsA、DHA含量均呈现下降的趋势(图2)。T1果实中T-AsA含量在处理第3、5 d显著高于CK,分别增加了16.4%和69.5%;T1和T2中 的AsA含 量 在 处 理 第1、3 d显著增加,其中第1 d T1和T2分别增加21.2%和19.9%,第3 d T1和T2分别增加24%和19%;与CK相比,处理果实DHA含量在处理起始阶段变化不大,与CK无显著差异,但是在处理后第5 d两处理果实中DHA含量均显著高于CK,分别增加了112%和81.7%;此外,处理期间T1和T2果实中AsA/DHA随着处理时间延长呈现下降趋势,且在处理起始阶段T1和T2的AsA/DHA略高于CK,但是随着处理时间延长CK中AsA/DHA上升,可能是随着低氮处理的持续,处理果实中AsA的氧化能力增强,被相关的氧化酶氧化为DHA,不能及时还原为AsA。
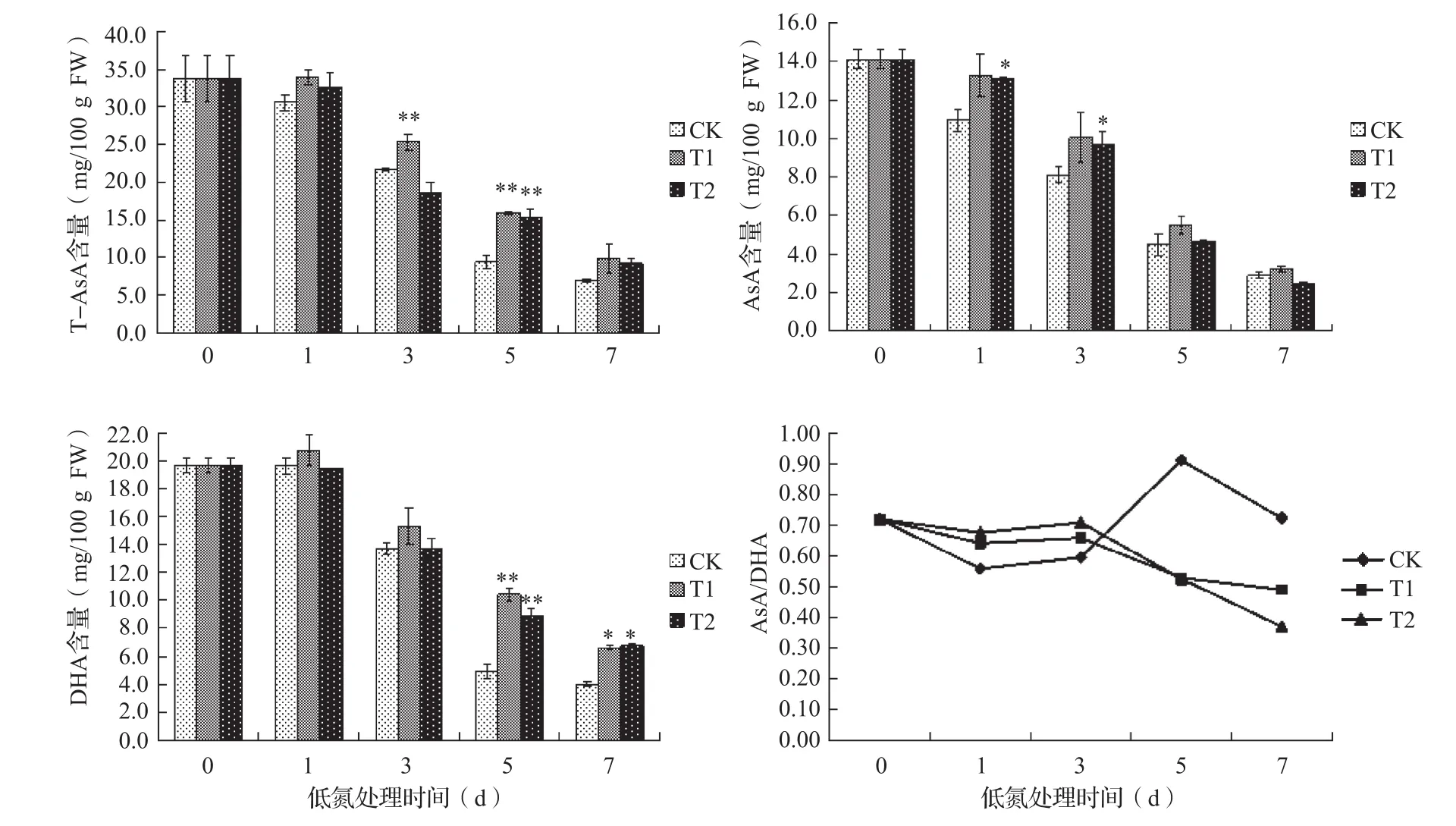
图2 处理期黄瓜果实中AsA含量变化
与果实AsA含量变化不同,处理期间叶片中AsA含量保持平稳增加(图3),这可能是因为结果期果实处于迅速膨大期和发育期,果实中水分含量增加明显,而叶片作为光合组织不断通过光合作用合成光合产物。在处理期间,处理叶片T-AsA含量均高于CK,T1在处理第5、7 d T-AsA含量显著提高,分别增加22.4%和16.9%;而处理起始阶段AsA含量则并无显著差异,在第5 d T1叶片中AsA含量提高了20.7%,在第7 d T2叶片中AsA含量提高了10.4%。叶片中DHA含量变化与果实类似,在处理期表现出增多的趋势,T1在处理第5、7 d比对照提高了24.6%和65.2%。叶片AsA/DHA变化与果实变化不同,其中T1叶片的AsA/DHA在处理期间呈现先上升后下降的趋势,在处理第5 d达到最大值,在处理第7 d显著低于T2和CK,而T2的AsA/DHA变化与CK的变化相似。
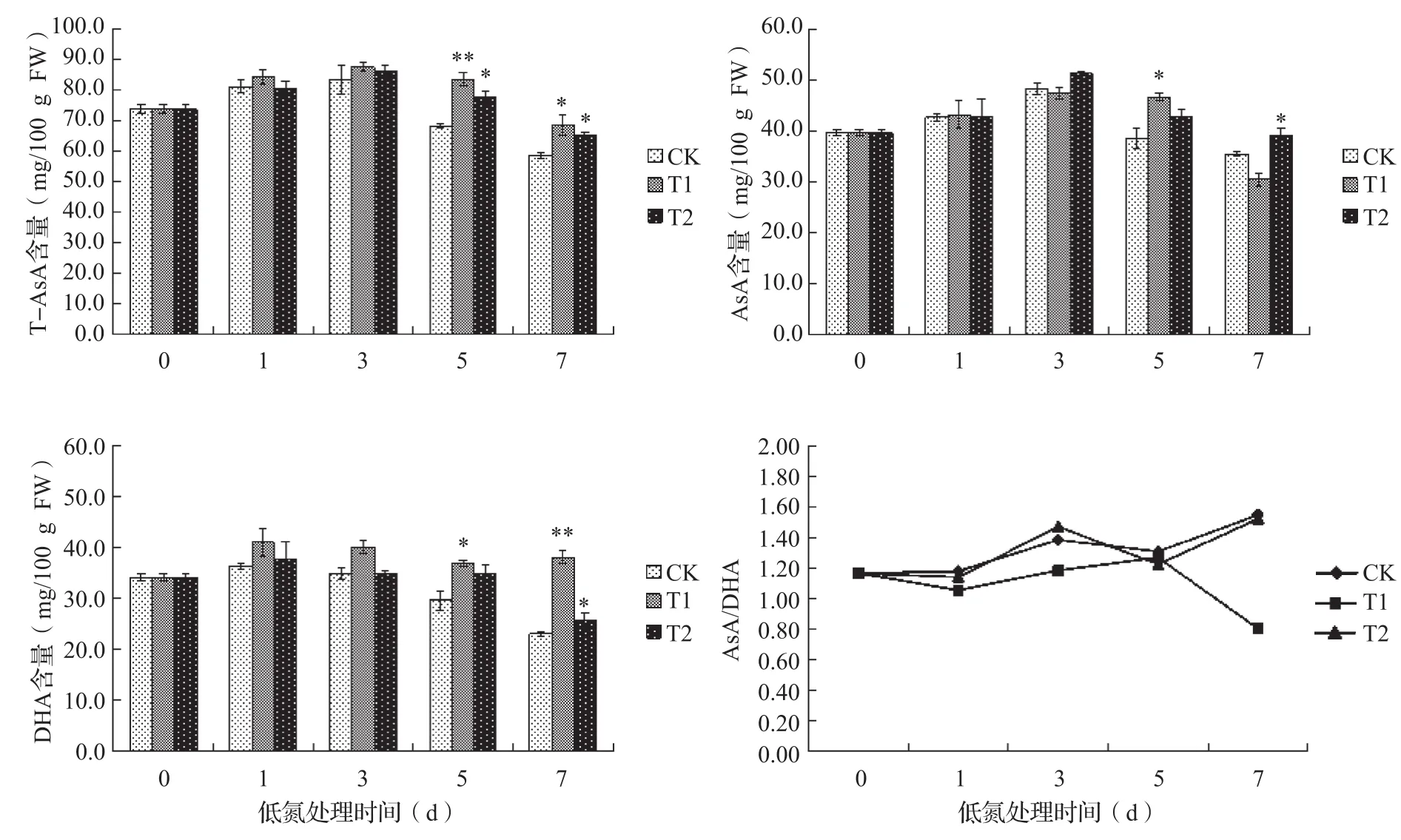
图3 处理期黄瓜叶片中AsA含量变化
2.2 短期低氮处理对黄瓜可溶性糖含量的影响
短期低氮处理后,黄瓜果实和叶片中总的可溶性糖含量呈现先增加后减少的趋势,且叶片中的可溶性糖含量远高于果实。在果实和叶片中,总可溶性糖含量在处理第3 d迅速增加,分别比CK增加了1倍和27.6%,达到极显著水平。在处理第5、7 d,果实和叶片中可溶性糖含量迅速回落,第7 d含量分别降至CK含量的50%和65%(图 4)。
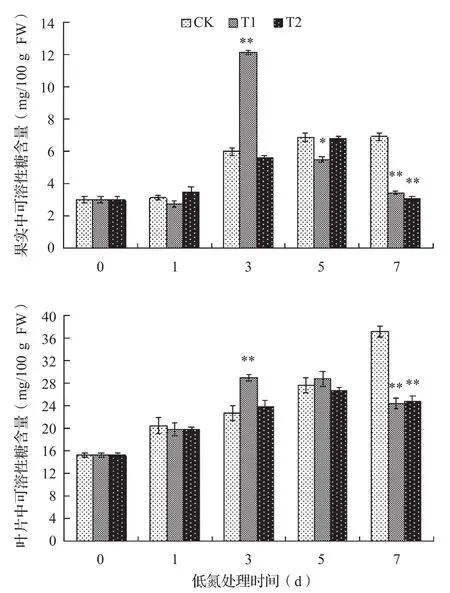
图4 处理期黄瓜果实和叶片中可溶性糖含量变化
结果表明,黄瓜叶片和果实中最主要的可溶性糖为葡萄糖、果糖、蔗糖、木糖和半乳糖(图5,图6),其中葡萄糖和果糖是含量较多的两种可溶性糖,是黄瓜中参与代谢和积累的主要糖,而半乳糖含量最少,甚至在黄瓜幼果期(雌花开花当天,处理第1 d)果实中没有检测到半乳糖(图5)。随着处理时间延长和果实膨大发育,处理果实中木糖含量明显减少,葡萄糖和果糖在处理3 d之后含量显著提高,果实中T1处理的葡萄糖和果糖含量均在处理第3 d达到最大值而后下降,T2与T1相比有一定滞后性,在处理第5 d含量最高。除此之外,处理果实中蔗糖含量无明显变化,而CK果实蔗糖含量则一直增加;相反,半乳糖在处理果实中含量明显增加,而CK果实中则无显著积累。
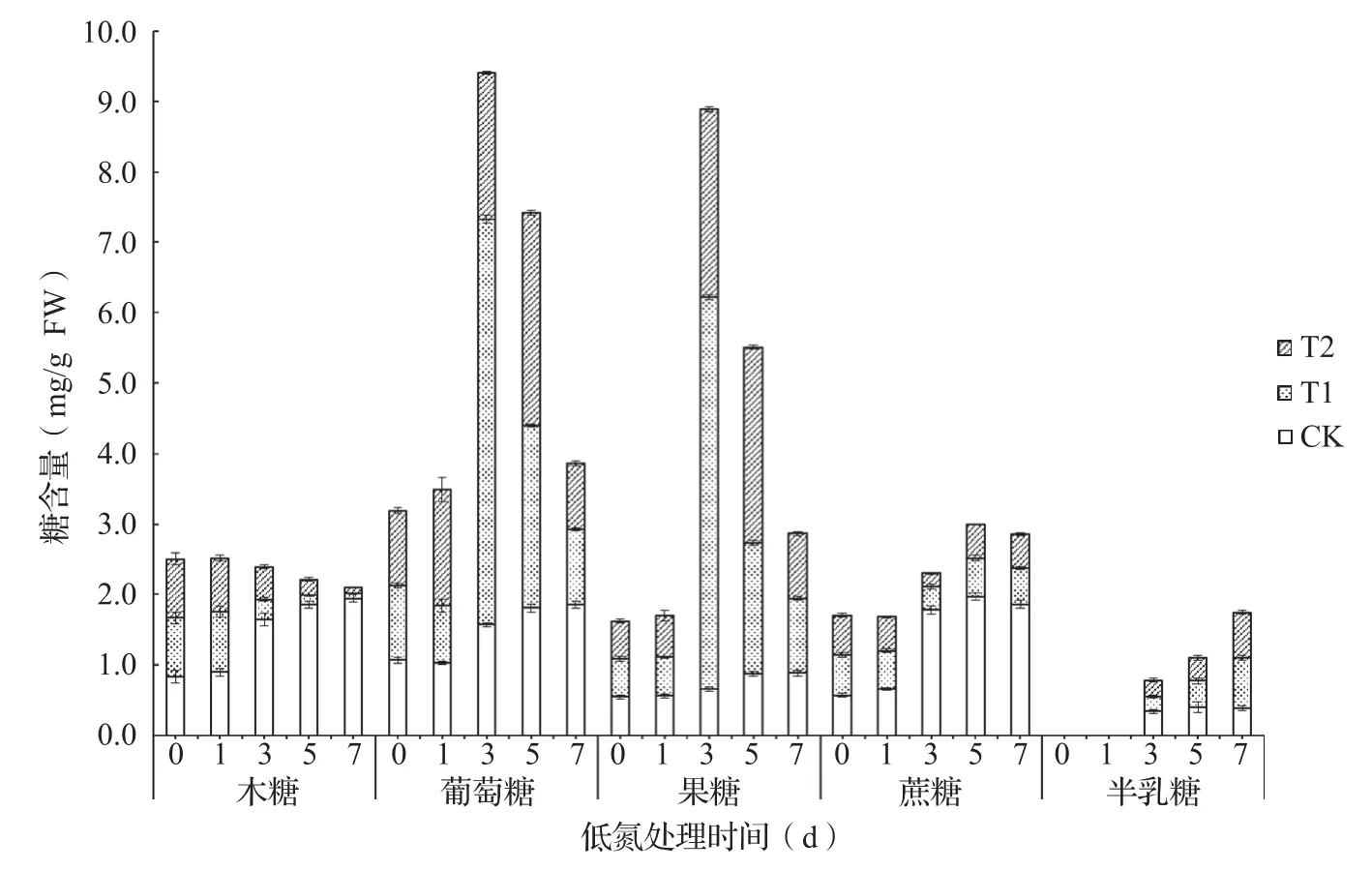
图5 处理期黄瓜果实中5种可溶性糖含量变化
黄瓜叶片中葡萄糖和果糖含量明显高于其他可溶性糖(图6)。处理期间叶片中木糖含量显著降低,半乳糖、果糖和葡萄糖含量增加,在处理第3、5 d增加明显;其中蔗糖含量变化与果实不同,果实中蔗糖含量较高,叶片中果糖含量明显高于蔗糖,叶片在T1处理的3~5 d果糖含量增加明显,T2中果糖含量与CK无显著差异。

图6 处理期黄瓜叶片中5种可溶性糖含量变化
3 讨论
很多研究表明适宜浓度的氮素不仅有利于蔬菜[8]、作物[9]植株的生长发育,而且对提高果实产量、可溶性糖含量、蛋白质含量等品质改善及降低硝酸盐积累有重要作用。研究发现氮素营养的供应与蔬菜作物体内可溶性糖、淀粉等碳水化合物及蛋白质、氨基酸等物质的合成积累有密切关联。目前在黄瓜[4]、菠菜[1]、白菜[3]、生菜[2]等蔬菜作物中均发现供氮水平越高,可溶性糖越低,且在菠菜中发现过高和过低的氮素供应使得其叶片中AsA含量降低[1]。在本试验中发现,短期低氮处理的3、5 d时处理黄瓜中T-AsA、AsA含量均高于CK;同样在黄瓜叶片中T1处理第7 d DHA含量明显高于T2和CK。处理黄瓜中T-AsA、AsA、DHA含量的变化说明短期低氮处理在一定程度上促进了叶片和果实中AsA含量的增加,这可能与AsA对植物逆境胁迫的响应有关。Shalata等[10]、Conklin等[11]、刘志礼等[12]、Zhang等[13]、孙娜等[14]研究发现在低盐、臭氧、紫外线、低氮等环境胁迫下,番茄、拟南芥、黄瓜幼苗等叶片中AsA含量增加,提高了其植株对逆境胁迫的抗性。本试验研究中短期低氮处理的黄瓜植株可能会以外界氮素营养供应水平的显著降低(T1处理为完全氮胁迫,T2处理为低氮胁迫)作为信号来激活并调控其抗氧化物质(AsA),从而使黄瓜植株对低氮处理这一短期养分胁迫作出响应,但是随着处理时间的持续,在后期T2处理叶片和果实中AsA/DHA提高,这说明在处理后期AsA的还原再生速率高于其氧化速率,促进了DHA的还原和AsA再生积累,因此维持了T-AsA含量的稳定甚至增多。
可溶性糖是绿色植物光合作用的重要产物,能够参与植物体内诸多重要的代谢过程。在瓜果类蔬菜中,可溶性糖是果实生长发育的重要物质基础,其组成和含量不仅影响了果实的风味和品质,而且可以作为上游底物和原料参加下游物质代谢与合成,同时也是细胞内的重要信号分子参与调节植物生长发育[15]。黄瓜果实中主要以水苏糖和棉子糖作为转运的光合产物,但是最终进入果实并参与代谢过程的是葡萄糖、果糖和蔗糖。吴树玲[15]研究发现在黄瓜果实中主要是葡萄糖和果糖的积累,含量比蔗糖要高,没有检测到棉子糖和水苏糖。在本试验中,通过高效液相色谱法(HPLC)在黄瓜叶片和果实中共检测到葡萄糖、果糖、蔗糖、木糖、半乳糖5种可溶性糖,其中含量较高的是葡萄糖和果糖,在CK植株中木糖含量也较高,而半乳糖含量最低,但在发育初期的幼嫩果实中没有检测到半乳糖,这与文献报道结果相似[16]。此外,由植物AsA合成途径可知,AsA合成的最上游底物是葡萄糖,而氮素供应水平可直接影响植物光合产物积累和碳氮代谢。已有研究表明,糖代谢为植物中的很多抗氧化物质合成提供了物质基础和原料,其中葡萄糖供给使植物氧化还原能力增强,提高了植物抗性[17]。Smirnoff等[18]研究发现外源葡萄糖供给可以保持暗处理下植物叶片中AsA含量,Nishikawa等[19]研究结果表明外源蔗糖供给可以延缓采后花椰菜中AsA含量的损失,AsA含量增加;Loreti等[20]、Blokhina等[21]发现在缺氧胁迫下,外源糖供给能提高拟南芥幼苗对氧化胁迫的抗性,对植物起到保护作用。这些研究表明,可溶性糖不仅仅是植物碳水化合物的供给,同时也在植物遭受逆境胁迫时发挥重要作用。
4 结论
本试验发现短期低氮处理黄瓜中葡萄糖、果糖、半乳糖含量提高,同时AsA含量增加。可溶性糖是AsA合成的重要原料和中间底物,由此可知,处理黄瓜中糖含量的积累给下游AsA合成提供了物质基础,因此黄瓜果实和叶片中可溶性糖含量和AsA含量均有所增加,这对通过有效使用氮肥来改善黄瓜果实的部分品质指标有一定的指导意义。

