杂交石斑鱼干扰素调节因子3(IRF3)基因的克隆及表达分析
卢晓颖 黄宝松 马骞 陈刚 王忠良 黄建盛 ERIC AMENYOGBE 谢瑞涛,2 邓文鑫,3
(1. 广东海洋大学水产学院,湛江 524088;2. 广东恒兴饲料实业股份有限公司,湛江 524000;3. 广东粤海饲料集团有限公司,湛江 524088)
先天性免疫是低等脊椎动物机体抵抗病毒和细菌的第一道防线[1],而先天性免疫抵抗病毒的入侵主要依赖于模式识别受体对病毒成分的识别,模式识别受体(Pattern recognition receptor,PRRs)主要有Toll样受体、NOD样受体和RIG-I样受体[2]。一旦PRRs识别到病毒核酸,可导致由干扰素调节因子3(Interferon regulatory factor3,IRF3)介导的I型干扰素(Interferon,IFN)的分泌,从而阻止病毒的复制,即病毒感染后,IRF3在C端富含丝氨酸的区域被多个丝氨酸和苏氨酸残基磷酸化激活,导致磷酸化的IRF3从细胞质到核的易位,并与IFN-β基因的特定启动子原件结合,启动该基因的转录。而I型干扰素的的正反馈调节是由IFN-β基因通过激活JAK-STAT信号通路传导的。干扰素调节因子家族(Interferon regulatory factor,IRF)具有抗病毒和免疫调节的生物学功能,在鱼类IRF家族中,主要有11个成员(IRF1-11),其中IRF3在先天免疫抵抗病毒的系统中扮演着重要的角色[3]。有研究表明,过表达欧洲鲫鱼IRF3可以激活IFN产生,进而通过STAT1通路触发干扰素刺激基因(IFN-stimulated genes,ISGs)转录[4]。IRF3是广泛表达的转录因子,在病毒识别后,控制着IFN和ISGs的表达[5],在大多数哺乳动物中,IRF3在所有组织中均有表达。
聚肌胞苷酸(PolyI:C)是双链RNA(dsRNA)的类似物,具有诱导产生干扰素(IFN)的能力和增强巨噬细胞吞噬、杀菌功能的作用。目前,国内外研究获得了鱼类中IRF家族的多个基因[6],已有许多关于IRF3基因序列分析及功能研究的报道。例如,脂多糖(Lipopolysaccharide,LPS)和聚肌胞苷酸(PolyI:C)都可以使虹鳟IRF3基因表达量上调[7];大黄鱼中,IRF3和IRF7在LPS和PolyI:C刺激后表达量均显著性上调[8],在大西洋鲑中,MyD88基因与IRF3和IRF7相互作用,调节IRF诱导的IFN应答[9];PolyI:C刺激的情况下,过表达IRF3能很大提高IFN的转录活性,结果表明在双链病毒刺激后,I型IFN的转录调控是由IRF3调节的[10];研究表明IRF3在鱼类机体抗病毒中扮演着重要的角色。
石斑鱼(Epinephelusspp.)主要分布在沿岸岛屿附近的岩礁、砂砾和珊瑚礁地质的海区,以其味道鲜美,营养丰富成为热带和亚热带地区最受欢迎的品种之一,也是中国沿海重要的海水养殖品种之一,在中国和东南亚国家广泛养殖。近年来由于虹彩病毒(Singapore grouper iridovirus,SGIV)和神经坏死病毒的出现、使石斑鱼死亡率超过90%,给石斑鱼养殖业带来了巨大的损失[11-12]。种质资源的退化表现之一为抗病力的下降,为解决这些问题,杂交技术已被引入到石斑鱼育种中。本课题组前期开展了褐点石斑鱼(E. fuscoguttatus,♀)× 清水石斑鱼(E.polyphekadion,♂)杂交育种研究,并成功培育出杂交子一代,在杂交石斑鱼仔、稚鱼阶段的摄食与生长状况进行了研究[13]。
本研究选取了杂交石斑鱼作为研究对象,克隆了杂交石斑鱼IRF3基因的全长、序列分析,以及IRF3在健康杂交石斑鱼不同组织中的表达情况,检测了PolyI:C(病原模拟物)刺激外周血淋巴细胞IRF3的时序性表达,进一步了解杂交石斑鱼IRF3基因应对病毒刺激的表达情况,旨在为IRF3在杂交石斑鱼抵御病毒的后续研究中奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物及试剂 杂交石斑鱼取自于广东海洋大学东海岛海洋生物研究基地,平均体重(250±5g),暂养于水温为27±2℃的循环水系统中一周,每日早晚各投喂1次。
反转录试剂盒、胶回收试剂盒和RNA提取试剂盒购自北京全式金生物有限公司,DH5α感受态细胞、LA Taq DNA 聚 合 酶、pMD18-Tvector、SMARTer®RACE 5'/3' Kit均购自TaKaRa公司,polyI:C购自sigma公司,SYBR®Select Master Mix购自罗氏公司,percoll细胞分离液购自MPBIO公司。
1.1.2 外周血淋巴细胞(PBL)和组织的收集 首先,将鱼置于50 mg/L丁香酚中麻醉,用75%酒精棉球擦拭体表,用肝素钠润洗过的一次性针管抽取尾静脉外周血,与PBS(含有1%肝素钠)轻轻颠倒混匀(PBS∶血液=1∶1),取2 mL 25% percoll分离液于15 mL离心管中,缓慢加入2 mL稀释的血液置于分离液上层,水平离心机2 000 r/min离心15 min,收集白膜层细胞,PBS洗涤3次。用L-15细胞培养液重悬PBL(10×106cell/mL),96孔板中每孔加入100 μL 细胞悬液(106cells/well)[14],实验组加入50 μg/mL PolyI:C 刺激[15],对照组加入等量 PBS,于22℃培养,0 h、1 h、4 h、8 h和12 h分别收集实验组和对照组细胞,加入800 μL TRIzol,-80℃超低温冰箱保存。脾脏、胃、肠、鳃、肝脏、心脏、脑、肌肉和头肾等9个组织分别采集于4尾健康的杂交石斑鱼,收集到的组织立即投入液氮中冷冻,随后转移至-80℃保存、备用。
1.2 方法
1.2.1 总RNA的提取和cDNA第一链合成 运用TRIzol法提取杂交石斑鱼各组织和PBL(7×107cell)总RNA,用紫外分光光度计和1.5%琼脂糖凝胶电泳检测其浓度和质量,根据EasyScript First-Strand cDNA Synthesis SuperMix使用说明书合成cDNA;按照 SMARTer®RACE 5'/3' Kit说 明书制备 cDNA,-20℃保存。
1.2.2IRF3基因的克隆 从本实验室已构建的转录组文库中筛选出注释为IRF3的unigene。经Blast比对验证后,设计特异性引物用于中间片段和全长序列的扩增(表1),采用IRF3-F1与IRF3-R1,IRF3-F2与IRF3-R2为引物扩增中间片段,测序、拼接,成功验证了中间片段,根据已知片段各设计两条5'/3'RACE 引物(GSP3'-F1/F2和 GSP5'-R1/R2,表1)。运用巢式PCR技术获取5'和3'末端序列,首先以GSP3'-F1和Long primer、GSP5'-F1和Long primer引物进行第一次扩增,引物GSP3'F2和Short primer、GSP5'-F2和Short primer进行第二次扩增,反应条件为:94℃预变性 5 min;94℃变性 30 s,60℃退火 30 s,72℃延伸2 min,35个循环;72℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳检测后,利用全式金胶回收试剂盒回收目的条带,并将片段导入到pMD-18vector中,再转化到DH5α感受态细胞中37℃培养16 h,挑取3个单克隆菌落送上海生物工程有限公司测序。

表1 本实验所用引物序列
1.2.3 生物信息学分析 根据杂交石斑鱼IRF3测序结果,序列以DNAMAN软件进行拼接,得到该基因全长cDNA序列。应用BLAST网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比对分析;开放阅读框(ORF)和氨基酸序列预测采用在线网 站(ORF finder:https://www.ncbi.nlm.nih.gov/orffinder/);SMART(http://smart.embl-heidelberg.de/)在线查找蛋白质结构域;通过Blastp(http://blast.ncbi.nlm.nih.gov/Blast.cgi)搜寻同源氨基酸序列,采用Clustalx1.83进行序列的多重比对;使用MEGA6.0软件邻位相连法(Neighbor-joining method)构建系统进化树。
1.2.4IRF3基因组织差异表达和PolyI:C浸染后IRF3基因在PBL中的时序性表达 根据已获得的杂交石斑鱼IRF3基因cDNA序列,设计qPCR引物为qIRF3-F、qIRF3-R(表1),以杂交石斑鱼β-actin为内参,用SYBR Green I荧光定量试剂盒(聚研生物科技有限公司)在实时荧光定量扩增仪(Light cycler 96)上进行qRT-PCR扩增检测。检测IRF3基因在杂交石斑鱼肝、胃、鳃、肠、脾脏等9种组织中的表达,以及在PolyI:C刺激0 h、1 h、4 h、8 h和12 h后杂交石斑鱼IRF3基因在PBL中的表达水平情况。反应程序:95℃预变性10 min,95℃变性10 s,60℃退火20 s,72℃延伸20 s,共45个循环。每组样品重复3次,实验数据分析采用2-ΔΔCT方法。结果使用SPASS 19.0软件对相同时间点实验组和对照组的表达量进行单因素方差分析。
2 结果
2.1 IRF3基因全长cDNA序列的克隆和氨基酸序列分析
用DNAMAN软件进行序列拼接得到杂交石斑鱼IRF3基因cDNA序列(GenBank序列登录号为MK040456)全长为2 529 bp,含有1 377 bp的开放阅读框,5'非编码区(Untranslation region)长度为325 bp,3'非编码区长度为916 bp,在该基因PolyA上游629 bp处发现脊椎动物中常见的终止信号(AATAAA)(图1)。ORF-finder在线分析结果显示,杂交石斑鱼IRF3基因ORF编码458个氨基酸(图1),利用SMART在线分析软件,发现IRF3氨基酸序列含有1个N-末端DNA结合区(N-terminal DNA binding region,DBD)(1-108 aa)、1 个 C-末端干扰素相关区(C-terminal interferon related region,IAD)(255-435 aa)以及色氨酸富含区(Tryptophan rich region,SRD)(440-450 aa)。
2.2 IRF3基因的氨基酸同源比对和系统进化分析
Blastx比对结果显示:杂交石斑鱼IRF3与鮸 鱼(Miichthys miiuy)IRF3和 花 鲈(Lateolabrax japonicus)IRF3同源性最高,分别为90%和89%、与鳜鱼(Siniperca chuatsi)IRF3、大黄鱼(Larimichthys crocea)IRF3、金鲳(Trachinotus ovatus)IRF3、大菱鲆(Psetta maxima)IRF3、象鼻科(Paralichthys olivaceus)IRF3和 三 刺 鱼(Gasterosteus aculeatus)IRF3同源性分别为为87%、85%、84%、82%、81%和80%。进化树结果如图2,杂交石斑鱼IRF3与花鲈IRF3聚为一支,亲缘关系较近,与其他物种亲缘关系较低;高等哺乳动物IRF3聚为一簇,鱼类IRF3也聚为一支。

图2 杂交石斑鱼(Epinephelus fuscoguttatus♀×E.polyphekadion♂)IRF3氨基酸序列聚类分析
使用NCBI数据库的BlastP对杂交石斑鱼IRF3氨基酸序列比对分析显示,杂交石斑鱼IRF3与花鲈同源性为85%、鳜鱼84%、金鲳鱼79%、大黄鱼和鮸鱼78%、月光鱼(Xiphophorus maculatus)68%、红点鲑(Salvelinus leucomaenis)59%,应用Clustalx进行氨基酸多序列比对,结果显示(图3),杂交石斑鱼IRF3的DBD和IAD两个结构域都较为保守。
2.3 IRF3基因组织表达分析
实时荧光定量PCR技术结果(图4)显示,杂交石斑鱼IRF3在9种组织都有表达,在肝、胃。肠中表达量最高;其次是鳃、脾脏、心脏、肌肉和脑,头肾表达量最低。
2.4 PolyI:C浸染后IRF3基因在PBL中时序性表达
杂交石斑鱼PBL在PolyI:C刺激后,IRF3在不同时间点的表达情况如图5所示。结果显示,IRF3在PolyI:C刺激后1 h逐渐升高,表达量在4 h达到最大值,与对照组(约为对照组的9.3倍)显著差异表达(P<0.05),8 h后表达量开始下降。
3 讨论
IRF3是IRF家族中重要成员,在先天免疫中抵抗病毒攻击的关键调节因子[16]。本研究通过RACE技术从杂交石斑鱼中成功克隆出IRF3全长cDNA序列,含有1 377 bp ORF,共编码458个氨基酸。3'端附近含有一个脊椎动物常见的终止信号(AATAAA)和3个mRNA不稳定基序(ATTTA),在许多促炎性因子中也发现含有多个mRNA不稳定结构[17],Sachs[18]发现该结构是具有炎性反应的调控编码基因。生物信息学分析表明,杂交石斑鱼IRF3氨基酸序列与同属鲈形目的花鲈同源性最高,SMART在线分析显示,该基因含有3个保守结构域,即DNA结合区(N-terminal DNA binding region,DBD)、干扰素相关区(C-terminal interferon related region,IAD)色氨酸富含区(Tryptophan rich region,SRD),在海鲈(Lateolabrax japonicus)中,IRF3也包含这3个结构域,与该结果相同,说明IRF3的3个结构域相对保守[19]。
应用ClustalX程序对杂交石斑鱼IRF3与7种已知鱼类IRF3氨基酸序列进行多重比对分析显示,杂交石斑鱼IRF3的DBD、IAD和SRD三个结构域与其他鱼类IRF3高度保守。DBD介导特异性结合到干扰素刺激应答原件(IFN stimulated response element,ISRE)对应于IFNb和干扰素刺激基因(IFN-stimulated genes,ISGs)启动子内的DNA序列;IAD是激活后IRF3分子同源二聚化的必需位点;SRD可以诱导磷酸化IRF3的细胞质-核易位,刺激DNA结合和转录活性。此外,MEGA6.0软件显示,7种哺乳动物IRF3聚在一起,8种鱼类IRF3聚为一簇,其中,杂交石斑鱼IRF3与花鲈聚为一支,进一步说明本实验IRF3序列属于鱼类IRF家族成员。

图3 杂交石斑鱼(Epinephelus fuscoguttatus♀×E. polyphekadion♂)IRF3 氨基酸序列多重序列比对分析
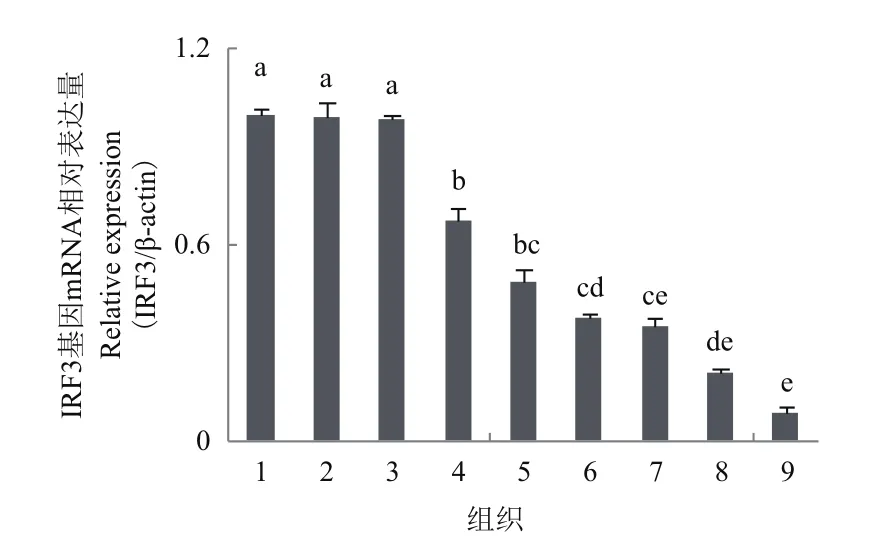
图4 杂交石斑鱼(Epinephelus fuscoguttatus♀×E. polyphekadion♂)IRF3组织差异分布
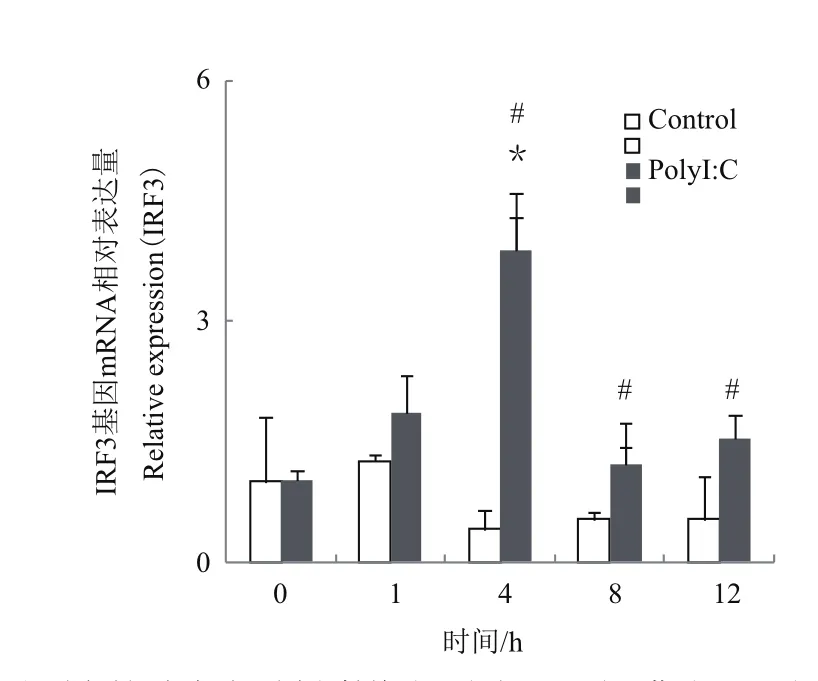
图5 杂交石斑鱼(Epinephelus fuscoguttatus♀×E. polyphekadion♂)PBL在PolyI:C浸染后IRF3基因的相对表达量
杂交石斑鱼IRF3在肝、鳃、肠、心脏、脾脏、脑、头肾、肌肉和胃9个组织中都有不同程度的表达,且在不同组织中存在较大差异,在肝、胃、肠和鳃的表达量最高,且明显高于其他组织,这可能与IRF3基因在不同组织中有着不同的生物学功能有关。肝脏在营养物质的代谢和静脉血液的汇流中起着重要的生理作用,且血液循环系统较发达,所以认为肝脏可进行病原体的检测和宿主防御,在免疫检测中扮演着重要的角色[20],IRF3基因在肝中的表达量最高,可能说明IRF3在杂交石斑鱼免疫应答中起着重要的作用。鳃富含黏膜淋巴组织,是鱼类机体抵抗病原体入侵天然屏障[21],胃、肠和鳃这些组织都是病原菌最容易入侵的部位,表明杂交石斑鱼IRF3在鱼体抵御病原体侵入发挥着重要的作用。Huang等[22]对IRF3基因在斜带石斑鱼(Epinephelus coioides)的组织特异性表达与本研究结果一致,IRF3在斜带石斑鱼的鳃中高表达,但在牙鲆[23](Paralichthys olivaceus)中,IRF3在头肾、脾脏和肾脏表达量最高,该结果可能说明IRF3在杂交石斑鱼和牙鲆的表达模式存在差别。
PBL主要由T细胞和B细胞组成,是一类具有免疫识别功能的细胞系。用PolyI:C(聚肌胞苷酸)对杂交石斑鱼外周血淋巴细胞进行免疫刺激后,杂交石斑鱼IRF3表达量在浸染1 h后便迅速升高,在4 h时达到最大值,之后逐渐减弱,说明IRF3参与PBL对PolyI:C刺激的免疫应答反应。陈学杰等[24]研究发现,用PolyI:C刺激半滑舌鳎(Cynoglossus semilaevis)PBL后,GRP3基因表达量在6 h时达到最高,与本研究结果类似,但对于LPS(脂多糖)、PGN(肽聚糖)和WGP(葡聚糖)3种病原模拟物刺激的PBL中,半滑舌鳎GRP3的表达量都在24 h达到峰值,说明外周血淋巴细胞内的免疫基因在短时间内就对PolyI:C作出免疫应答反应,以上结果说明PBL可能对病毒敏感性更强。
4 结论
本研究成功克隆了杂交石斑鱼IRF3cDNA全长序列、通过氨基酸序列比对发现,IRF3序列在不同物种间的保守性高,9种组织中均有表达(肝、胃、肠和鳃最高),PBL经过PolyI:C刺激后,IRF3表达量明显升高,刺激4 h时,实验组IRF3表达量是对照组(0 h)9.3倍,说明IRF3参与了杂交石斑鱼病毒免疫应答反应。

