危重患者疼痛观察工具在颅脑肿瘤开颅术后疼痛评估中的应用
杨燕琳 陈光强 何 璇 史中华 徐 明 周建新
(首都医科大学附属北京天坛医院重症医学科,北京 100050)
近年来,危重患者的镇痛问题在重症加强医疗病房(intensive care unit,ICU)受到了越来越多的关注[1-3]。除原发疾病、手术等因素导致的疼痛外,ICU患者常常还会经历不同程度的致痛性操作影响[4]。有研究[5-7]表明, 疼痛问题在脑损伤患者,特别是神经外科开颅术后患者中同样有着较高的发生率。然而, 由于担心对术后病情变化观察造成影响,对开颅术后患者的镇痛问题仍然存在一定的争议[8]。不恰当的镇痛治疗(不足或过度)与住院时间延长、机械通气时间延长、生活质量下降以及慢性疼痛的发生等不良转归相关[9-11],而如何对患者进行准确的疼痛评估是治疗的重要前提[12]。
目前认为,患者对疼痛的主观感受以及由此衍生的主观评估量表仍然是疼痛评估最可靠的方法[12-13]。然而,ICU患者常常由于疾病严重程度、保留人工气道以及应用镇静治疗等原因,存在不同程度的表达障碍。因此,临床中常应用危重患者疼痛观察工具(critical-care pain observation tool,CPOT)和疼痛行为学量表等行为学评估工具对表达障碍的ICU患者进行疼痛评估,并且其可靠性和有效性得到了充分的证实[3,10,14]。近期的研究[15-17]表明,CPOT对于脑损伤患者的疼痛评估也具有一定的潜在价值。然而,这些研究中并未对不同的脑损伤类型进一步分析。颅脑肿瘤作为开颅手术的常见原因之一,有学者[18]认为其手术后患者的疼痛感觉不同于其他术后患者。因此,CPOT在这一患者群体中的评估价值有待进一步明确。
本研究选择收治于首都医科大学附属北京天坛医院ICU的颅脑肿瘤开颅术后进行机械通气支持的患者,采用随机交叉的方式先后进行致痛性操作和非致痛性操作,由2名研究者在操作前后分别各自完成CPOT的评价。研究目的包括:①评估CPOT在不同的评价者之间的信度;②对能表达疼痛的患者以疼痛主诉为标准,评价CPOT的校标效度;③对不能表达疼痛的患者,通过比较操作前后CPOT的变化评价其区变效度。
1 对象与方法
1.1 研究对象
选择2017年1月至2017年12月收治于本院ICU的颅脑肿瘤行择期开颅手术后并进行机械通气支持的患者为研究对象。本研究经首都医科大学附属北京天坛医院伦理委员会审批,符合医学伦理学标准,并获得患者或家属的知情同意。
1.1.1 排除标准
年龄<18岁;孕产妇;精神病史;过量饮酒或药物滥用史;四肢瘫痪;躁动状态(镇静躁动评分≥4)[19];癫痫发作;临终状态。
1.2.2 资料收集
人口学资料,颅脑肿瘤类型,急性生理与慢性健康状况评分Ⅱ(Acute Physiology and Chronic Health Evaluation Score Ⅱ,APACHE Ⅱ),人工气道和机械通气方式以及镇痛镇静药物的使用情况。
1.2 研究流程
1.2.1 操作流程
对纳入研究的患者以随机交叉的方式分别先后进行气管内吸引(致痛性操作)和右肩处轻贴电极(非致痛性操作)。操作先后顺序的随机化采用在线数字生成器完成(https://www.99cankao.com/numbers/random-number-generator.php)。气管内吸引采用密闭式吸痰管,预先给予1 min纯氧,吸痰负压-150 mmHg(1 mmHg=0.133 kPa),吸痰深度15 cm,吸痰时间10 s。为保证两种操作前的条件一致,在轻贴电极前同样给予患者1 min纯氧吸入。每次操作前平衡30 min,两次操作之间洗脱期为30 min。为保证不受到其他因素的影响,研究期间避免其他气管内吸引、翻身等护理操作,避免调整呼吸机设置和镇痛镇静药物的剂量等治疗措施。每次操作前后记录患者的生命体征如平均动脉压(mean arterial pressure, MAP)、心率(heart rate,HR)和呼吸频率(respiratory rate,RR)。
试验终止条件:患者在操作期间或平衡过程中出现严重的病情恶化,则终止试验并根据临床情况进行治疗。
1.2.2 CPOT评价
每次操作前后对患者进行CPOT评价,包括面部表情、肢体动作、肌肉张力和机械通气同步性4个方面[20-21],每项记为0~2分,总分共计8分,由两名经过培训的专科医师各自独立完成。CPOT评分的范围在0~8分,分值越高提示疼痛程度越明显。
1.2.3 主观疼痛评价
操作后对患者进行主观疼痛评价,即询问患者是否感觉疼痛,患者可通过点头或摇头等方式表达。根据能否表达分为能表达疼痛和不能表达疼痛两组。
1.3 统计学方法

2 结果
纳入颅脑肿瘤术后行机械通气支持的ICU患者243例,平均年龄(44 ± 14)岁,其中男性占56.4%,体质量指数(body mass index,BMI)为 (23.5 ± 3.8)kg·m-2, APACHE Ⅱ 16 (12, 19),幕下肿瘤占81.1%,机械通气模式以压力支持通气(pressure support ventilation,PSV)为主,详见表1。
比较两名研究者之间的CPOT评价信度,能表达疼痛组在致痛性操作前后的ICC分别为0.922 (0.896~0.942)和0.928 (0.903~0.946),非致痛性操作前后分别为0.927 (0.903~0.946)和0.945 (0.926~0.959);不能表达疼痛组在致痛性操作前后的ICC分别为0.790 (0.685~0.863)和0.895 (0.838~0.933),非致痛性操作前后分别为0.831 (0.742~0.891)和0.849 (0.769~0.903),详见表2。
能表达疼痛组患者171例(70.4%),致痛性操作后表达疼痛151例(88.3%),非致痛性操作后表达疼痛34例(19.9%)。以患者疼痛主诉为标准进行ROC分析,CPOT的AUC及95%CI为0.805(0.759~0.852)(P<0.001),详见图1,取CPOT为2时灵敏度和特异度分别为0.741和0.758(表3)。MAP、HR和RR的AUC和95%CI分别为0.573(0.512~0.633)(P<0.001)、0.625(0.565~0.684)(P<0.021)、0.649(0.590~0.707)(P<0.001),详见表3。

表1 纳入患者的基本资料Tab.1 Patient characteristics
A/C: assist/control ventilation;SIMV: synchronized intermittent mandatory ventilation:PSV: pressure support ventilation.
不能表达疼痛组患者72例(29.6%),致痛性操作前后的CPOT分别为0(0,1)和3(2,5)(P<0.001),MAP、HR和RR分别为(93±13)mmHg和(99±15)mmHg(P=0.013)(1 mmHg=0.133 kPa)、(97±21)次/min和(107±22)次/min(P=0.011)、(20±6)次/min和(22±7)次/min(P<0.05);非致痛性操作前后CPOT、MAP、HR和RR的变化差异均无统计学意义(P>0.586),详见图2。比较致痛和非致痛性操作后,CPOT、MAP、HR和RR的变化,差异均有统计学意义。
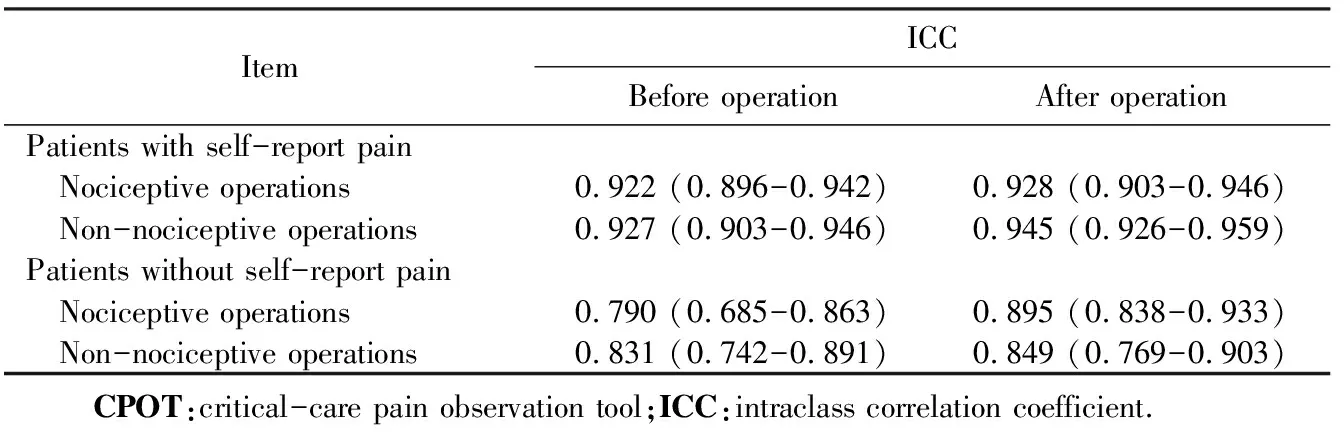
表2 两名研究者之间CPOT评价的相关系数Tab.2 Intraclass correlation coefficient of CPOT between two researchers

图1 能表达疼痛组在操作后CPOT及生命体征的ROC曲线Fig.1 ROC of CPOT and vital signs after operations in patients with self-reported pain
ROC:receiver operating characteristic;CPOT:critical-care pain observation tool;MAP:mean arterial pressure;HR:heart rate;RR:respiratory rate.
3 讨论
本研究发现,对于颅脑肿瘤开颅术后机械通气的患者,应用CPOT进行疼痛评估具有较好的信度和效度,特别是存在表达障碍的患者中区辩效度良好,可以用于此类患者操作痛的评估。
CPOT作为一种常用的行为学疼痛评估工具,最早由Gélinas等提出[23]。随后有研究[1,3,24]验证了其在危重症患者中的应用价值,并得到了国内外指南的推荐。CPOT同样适用于脑损伤患者的疼痛评估。对可表达的脑损伤患者,CPOT具有较好的准确性[15-16];对不可表达的脑损伤患者,CPOT对操作痛同样具有较好的判别能力[17,25]。而作为脑损伤中一类相对特殊的群体,颅脑肿瘤开颅术后患者由于原发疾病、手术部位和方式等因素不同,其对疼痛的感觉和表达也与其他类型的脑损伤患者存在差异[26-27]。本研究证实,CPOT在颅脑肿瘤开颅术后机械通气的患者中同样具有较好的校标效度和区辨效度。在可表达疼痛的颅脑肿瘤开颅术后患者以疼痛主诉为标准,AUC及95%CI为0.805(0.759~0.852),CPOT为2时灵敏度和特异度分别为0.741和0.758,提示与主观感觉相比,CPOT评估具有较好的校标效度。另外,在不能表达疼痛的患者中,本研究通过采用不同类型的操作前后进行比较发现,致痛性操作后CPOT较操作前明显升高,而在轻贴电极前后则无明显变化,提示CPOT对操作痛具有较好的区辨效度,能够区分操作带来的疼痛变化,临床医师通过评价CPOT的变化可以了解操作对患者的影响,并借此进一步调整镇痛治疗。
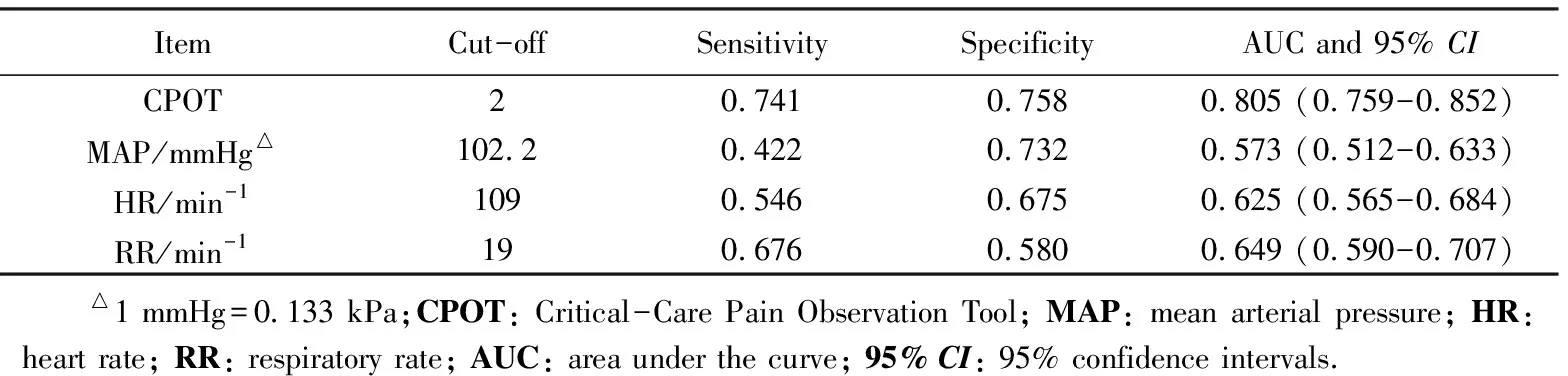
表3 能表达疼痛组在操作后CPOT及生命体征的AUC和cut-off值Tab.3 AUC and cut-off of CPOT and vital signs after operations in patients with self-reported pain
多项研究[7,17]表明,不同研究者之间的CPOT评价在不同类型的患者中具有较好的信度。本研究采用两名研究者各自独立完成CPOT评价后,通过比较发现不同组别的患者在不同类型操作前后的ICC在0.790~0.945之间,证实了CPOT评价在颅脑肿瘤开颅术后的患者中同样具有较好的信度。另外,为了减少研究中偏移,笔者还采取了以下几点措施。首先,对操作痛的主观评价采用了点头或摇头的简单方式表达,这是因为考虑到颅脑肿瘤术后患者因不同脑区受累,可能无法准确完成数字量表等主观评价量表。其次,本研究所选择的致痛性和非致痛性操作(即气管内吸引和轻贴电极),以及两次操作之间洗脱期的选择均在以往的研究[17,28]中得到了验证,其目的是为了明确区分不同的操作类型和两次操作之间的相互影响。
有研究者[29]认为,除主观的感受外,疼痛还会引起患者的行为和生理学指标的一系列变化,因而也可以通过生命体征的变化进行疼痛评估。目前,对这一观点的研究结果并不一致,疼痛刺激后生命体征的变化可能受到多种因素的影响。本研究发现,在能表达疼痛的患者中,MAP、HR和RR的AUC在0.573~0.649之间,生命体征作为疼痛评估的校标效度欠佳。而在不能表达疼痛的患者中,生命体征在致痛性操作前后的变化虽然大于非致痛性操作,但笔者认为这一变化可能并不仅仅与患者的疼痛感觉有关。

图2 不能表达疼痛组在不同操作前后CPOT及生命体征的变化Fig.2 Difference of CPOT and vital signs between pre-and post-operations in patients without self-reported pain△1 mmHg=0.133 kPa;CPOT: critical-care pain observation tool; HR: heart rate; RR: respiratory rate.
本研究包括以下两点不足:首先,并未对不同的颅脑肿瘤类型进一步分类,虽然不同脑区受累的患者可能对疼痛的反应有所不同,但如果仅对肿瘤部位分类,可能会存在手术入路方式和肿瘤类型等混杂因素的存在;另外,本研究主要比较了CPOT在操作痛中的评估价值,其是否能够准确反映患者静息痛的变化,有待进一步研究证实。

