超声对胰腺浆液性囊腺瘤和黏液性囊腺瘤的鉴别诊断价值
郭文凤 王永琪 马亚 胡群 朱献忠 孟德莉
1浙江省安吉县第三人民医院超声科,安吉 313300;2浙江省金华广福医院超声科,金华 312000 ;3浙江省绍兴市立医院超声科,绍兴 312000
【提要】 浆液性囊腺瘤(SCN)多为良性,而黏液性囊腺瘤(MCN)具有恶性潜能,二者治疗方案及预后存在较大差异,准确的鉴别诊断常需行内镜超声引导下的囊肿穿刺。超声检查无创、操作简单、肿瘤检出率高。虽然SCN与MCN的超声图在病灶部位、边界、形态、大小、囊壁特征方面均无明显差异,但病灶内的囊腔数、囊壁钙化、结节以及血流信号可作为MCN与SCN多普勒超声检查的主要鉴别点。
浆液性囊腺瘤(serous cystic neoplasm, SCN)、黏液性囊腺瘤(mucinous cystic neoplasm, MCN)均为胰腺常见的胰腺囊性肿瘤(pancreatic cystic neoplasm,PCN),占所有胰腺囊性病变的10%~15%[1]。PCN解剖位置往往较深,早期缺乏特异性症状,极易被漏诊、误诊。PCN病理类型复杂,不同病理类型肿瘤的手术、治疗方案及患者预后存在较大差异。目前对于肿瘤囊液性质的判断多采用内镜超声引导下细针穿刺活检术(EUS-FNA)行生物化学及细胞学检查,但其属于侵入性检查且操作难度大,应用受到一定限制[2-3]。近年来超声在PCN的诊断及鉴别诊断中扮演重要的角色[4]。本研究回顾性分析SCN与MCN患者的二维超声及彩色多普勒超声成像资料,探讨超声在SCN诊断及其与MCN鉴别诊断中的临床价值。
一、资料与方法
1.一般资料:收集2008年1月至2018年6月间浙江省安吉县第三人民医院超声科收治的60例经病理证实的PCN患者,其中MCN 32例,SCN 28例。60例患者中男性33例,女性27例,年龄42~78岁,平均(57±5)岁;患者均有不同程度的上腹不适、腹痛、腹胀等临床症状;病灶位于胰头颈部26例,体部9例,尾部25例;病灶直径2.2~9.1 cm,平均(4.1±1.3)cm;单发病灶55例,多发病灶5例。
2.方法:采用百胜CLASS-C、飞利浦EPIQ5型彩色多普勒超声诊断仪,探头频率为3.0~5.0 MHz。患者取仰卧位,暴露上腹部,依次检查胰头、胰体、胰尾,了解病灶的位置、形态、大小、边界、内部结构回声及血流情况,必要时饮水观察病灶与周围组织器官的关系。依据Kimura等[5]分类法,按病理特征分为微囊型、大囊型、混合型。由2位高年资超声医师分别分析,判断为良性、可疑恶性及性质待定。若对结果存在异议,则由二者共同讨论后作出诊断。
3.统计学处理:应用SPSS 20.0统计软件包进行数据分析。计数资料组间比较采用χ2检验,P<0.05为差异有统计学意义。
二、结果
1.SCN、MCN的超声诊断结果:28例SCN患者中超声诊断良性20例,可疑恶性(囊腺癌)5例,性质待定3例,定性诊断符合率为71.4%(20/28)。20例良性病例中12例诊断为SCN(微囊型9例,混合型3例),5例误诊为MCN(均为大囊型),3例误诊为实性假乳头状瘤(均为微囊型,表1)。微囊型是SCN的典型表现,内部呈“蜂窝状”或“海绵样”改变,囊腔数多≥6个,每个囊腔直径<2 cm。
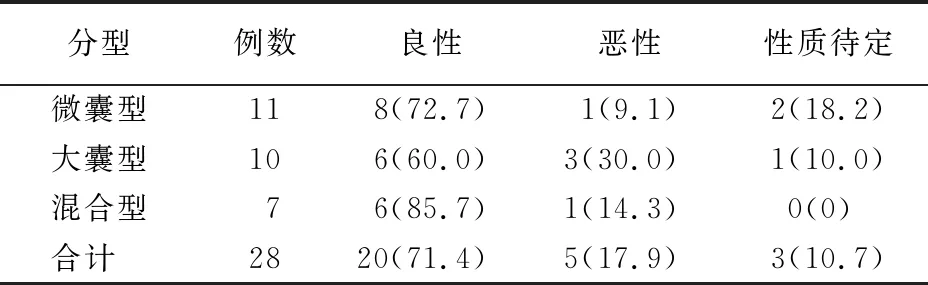
表1 SCN患者的超声诊断结果 [例(%)]
32例MCN患者中超声诊断良性24例,可疑恶性5例,性质待定3例,定性诊断符合率为75.0%(24/32)。24例良性病例中18例诊断为MCN(微囊型15例,混合型3例),4例误诊为SCN(均为大囊型),2例误诊为实性假乳头状瘤(均为微囊型)。
2.SCN和MCN的二维超声图像比较:SCN组的囊腔数、钙化明显多于MCN组,而囊壁结节明显少于MCN组,差异有统计学意义(P<0.05)。两组病灶部位、边界、形态、大小、囊壁特征比较,差异均无统计学意义(表2,图1)。

表2 MCN和SCN患者常规超声图像比较(例)
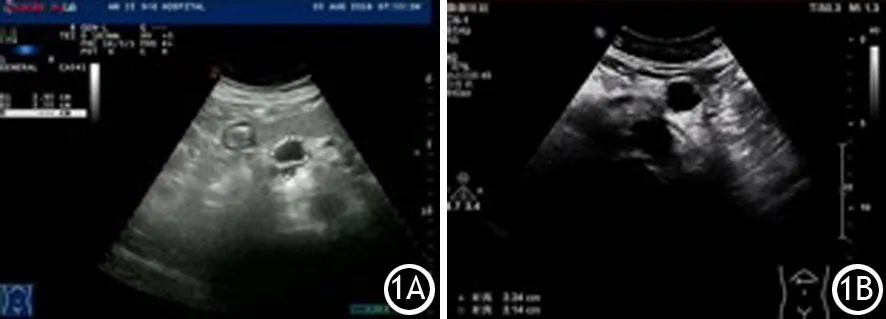
图1 混合型浆液性囊腺瘤(1A)及黏液性囊腺瘤(1B)超声图
3.MCN和SCN的彩色多普勒超声血流显像比较:28例SCN的彩色多普勒图像显示血流信号10例(35.7%)。11例微囊型中4例(36.4%)可见内部细小条状血流信号;10例大囊型中3例(30.0%)囊壁显示少许血流信号,1例(10.0%)内部分隔显示有血流信号;7例混合型中2例(28.6%)囊内部分隔上显示短棒状血流信号。32例MCN的彩色多普勒图像均未见血流信号。SCN与MCN的血流信号检出率的差异具有统计学意义(χ2=13.71,P<0.001)。
讨论近年来随着影像技术的快速发展,胰腺囊性肿瘤的检出率不断升高,其中SCN、MCN作为外分泌来源的肿瘤,因其起病隐匿,肿瘤生长缓慢,具有高度异质性,常被临床忽视,但随着病情的进展,多数患者由于腹胀、腹痛或腹部包块就诊或体检而发现[6-7]。SCN、MCN的影像学表现相似,二者的诊断与鉴别诊断一直未达到令人满意的程度。与MCN比较,SCN恶变的可能性较低,多数患者无需手术治疗,以随访观察为主[8]。SCN患者的5年存活率达100%,显著高于MCN的15.0%,约10%的SCN因误诊为MCN而接受外科切除手术[9-10]。因此,术前正确鉴别诊断SCN、MCN对于判断是否对患者采取临床干预及治疗方案的选择具有重要指导意义。
本研究结果显示,超声对SCN定性判断的符合率为71.4%。SCN病例中微囊型占39.3%(11/28),彩色超声图像多表现为高回声或混合回声,隐约可见内部病灶低-无回声的小囊样改变,但由于回声与实性病灶接近,3例SCN被误诊为实性假乳头状瘤,1例误诊为可疑恶性。大囊型SCN的囊腔直径均>2 cm,表现为少分隔的寡囊型或无分隔的单囊型,尤其是单囊改变的SCN与MCN区分难度较大[11-13]。本组大囊型占35.7%(10/28),5例误诊的MCN均为大囊型,1例性质待定,笔者认为此类型囊性肿瘤建议行EUS-FNA对囊液进行分析。混合型SCN通常呈中间小囊,周边大囊的形态,此类患者容易与分支型胰腺导管内黏液性乳头状瘤混淆[14]。
Malleo等[15]报道15例SCN中12例瘤体内部呈小囊肿样,囊肿数≥6个,且绝大多数直径<2 cm,而MCN瘤体内囊肿少而大,认为可根据瘤体内囊肿直径与个数初步鉴别SCN和MCN。骆洪浩等[16]报道,MCN的钙化率明显低于SCN,且MCN以囊壁钙化居多,而SCA 则多为中心分隔钙化。本研究显示,MCN与SCN在病灶部位、边界、形态、大小、囊壁特征方面均无明显差异,但SCN患者多呈少囊或寡囊型,且内分隔可表现出特征性的放射状钙化征[17-18],而MCN倾向于多囊型,呈分叶状,囊内为黏稠或韧性黏液、血液,囊内壁常较光滑,覆盖高柱状分泌黏液的细胞,常伴有乳头状突起或实性结节,超声可见囊壁结节样回声突入腔内[19],与文献报道一致。应用彩色多普勒超声,35.7%的SCN患者囊腺肿瘤中检测出血流信号,由于其外形多呈分叶状,内部常伴有多发分隔,在囊壁或分隔处可测及点线状血流曲线,而MCN均未探及,与孙亚等[20]研究结论一致。由此可见,病灶内的囊腔数、囊壁钙化、结节以及血流信号可作为MCN与SCN多普勒超声检查的主要鉴别点。
利益冲突所有作者均声明不存在利益冲突

