樱桃李组织培养快速繁殖技术研究
贺祥素,柴慈江,郭静,朱霖,王雪彤,冯涛
(天津农学院 园艺园林学院,天津300384)
樱桃李(Prunus cerasiferaEhrh.)为蔷薇科李属植物,俗称野酸梅,主要分布于新疆维吾尔自治区伊犁地区的野果林内[1]。樱桃李是一种珍贵的野生果树资源,也是中国稀有濒危树种之一,被列为国家Ⅱ级重点保护物种[2]。
樱桃李营养全面且价值较高[3],某些营养指标甚至高于蓝莓[4],还有医疗保健价值[5-8]。樱桃李花朵美丽,果色鲜艳,还可作为观赏树种在城市绿化中利用[9]。大量培育樱桃李优质苗木对樱桃李资源保护及其优良单株的引种推广具有重要意义。采用植物组织培养快速繁殖技术将是快速获得樱桃李大量优质苗木的有效途径[10]。目前,关于樱桃李组织培养快速繁殖技术的研究国内仅见少数报道。刘崇琪等对樱桃李茎段腋芽萌发生长、增殖及叶片培养再生植株进行了研究[11],李海臣等不仅研究了樱桃李茎段腋芽萌发生长及增殖外,还对樱桃李试管苗的生根培养进行了探讨[12],浦艳吉研究了影响樱桃李茎尖培养的因素[13],侍艺等对樱桃李茎段外植体的灭菌培养技术进行了探讨[14]。从目前研究状况看,樱桃李组培快繁技术距离生产应用还有很长的路。本研究对樱桃李茎段外植体灭菌、试管苗增殖、生根及移栽各个环节进行了初步探讨,以便为完善樱桃李组织培养快速繁殖技术提供依据。
1 材料与方法
试验材料为种植在天津农学院试验园内的樱桃李(Prunus cerasiferaEhrh.)6年生实生苗,已开花结果。该实生苗引自新疆。生根培养用土为取自东校区地被植物园的黏壤土,6月份取土后装入塑料花盆,放置在露天地表,经一个雨季的雨水淋洗后,风干,过1 mm筛后备用。从花卉市场购买细粒蛭石,同样过1 mm筛备用。
1.1 樱桃李新梢茎段灭菌中不同取材时期及酒精浸泡后处理方式的研究
不同取材时期的研究:分别于2018年5月15日和7月9日采集樱桃李当年生新梢茎段,去掉叶片后剪成带有2个侧芽的茎段,用洗衣粉清洗后用自来水洗净,晾干表面水分后在 70%酒精中浸泡约 10 s,然后用无菌水清洗一次,滤纸吸干表面水分后在2%次氯酸钠溶液中浸泡25 min,无菌水清洗4次,然后将茎段接种于培养基中。
酒精浸泡后处理方式的研究:7月9日采集的茎段另做一个酒精浸泡后不同的处理,即用 70%酒精浸泡10 s后,不经无菌水清洗,直接放入2%次氯酸钠溶液中浸泡25 min,无菌水清洗4次,然后将茎段接种于培养基中,与上述7月9日取材并在酒精浸泡后用无菌水清洗的进行比较。
上述 2项试验接种用培养基均为添加 6-BA 0.5 mg/L的MS培养基。接种后在培养室培养,培养室温度为23~28 ℃,光照1 500~3 000 lx,光照时间为14 h/d。培养2周后调查接种茎段的污染率及萌芽状况。
1.2 樱桃李试管苗增殖培养中适宜IBA浓度筛选
在1/2MS培养基中添加不同浓度的IBA,IBA浓度设计为6个处理:0、0.1、0.2、0.3、0.4、0.5 mg/L,各种培养基中均添加15 g/L蔗糖和7 g/L琼脂,pH调整至5.9,分装于100 mL三角瓶中,121℃下灭菌20 min。每瓶接种4根长约1 cm的樱桃李试管苗茎段,每处理接种7瓶共28个茎段。接种后在培养室培养,培养条件同试验1.1。培养20 d时调查试管苗生根率,60 d后调查试管苗茎长及繁殖系数。培养期间每隔20 d调查一次试管苗新生茎长,以便了解茎生长动态。
1.3 樱桃李试管苗土壤支撑生根培养试验
本项试验设2个处理:
黏壤土支撑培养:以方形PC瓶为培养瓶,将上述黏壤土与蛭石按照1∶2的体积比混和后加入培养瓶,每瓶加入100 mL。然后每瓶加入60 mL 培养液,培养液的成分为含有0.3 ml/L IBA和15 g/L蔗糖的蒸馏水,pH 6.5。培养基配制完成后在121 ℃下灭菌20 min,然后在超净工作台中接种樱桃李试管苗茎段,每瓶接入8根长约1 cm的樱桃李试管苗茎段,共接种4瓶32个茎段。
琼脂支撑培养(对照):以1/2MS培养基为基本培养基,培养基中添加0.3 mg/L的IBA和15 g/L的蔗糖,以7 g/L琼脂做固化剂,pH为5.9,以100 mL三角瓶为培养容器,每瓶装入培养基约40 mL,培养基配制完成后在121 ℃下灭菌20 min,然后在超净工作台中接种樱桃李试管苗茎段,每瓶接入4根长约1 cm的樱桃李试管苗茎段,共接种8瓶32个茎段。
上述两处理接种后在培养室培养,培养条件同试验1.1。培养40 d后调查试管苗的生根率、根长、茎长、叶数等各项指标。同时在显微镜下观察根毛发生状况并拍照。
1.4 樱桃李试管苗移栽试验
将试验 1.3中黏壤土支撑培养和琼脂支撑培养中生根的樱桃李试管苗,在进行根系长度的测定后裸根移栽入黏壤土与蛭石体积比为1∶1的移栽基质中,移栽后用塑料薄膜覆盖保湿并放于向阳的室内,室内温度为20~30 ℃,移栽3周后调查试管苗成活率。
上述各项试验中,对调查的各项百分率指标用卡平方测验独立性,其他各项指标均按照完全随机试验单向分组资料的统计分析方法做方差分析,并用邓肯氏新复极差法进行多重比较。
2 结果与分析
2.1 取材时期对樱桃李新梢茎段灭菌培养效果的影响
由表1可见,5月15日和7月9日两个时期采集的樱桃李新梢茎段,用酒精和次氯酸钠灭菌后的污染率无显著差异,均低于10%。茎段的褐化率和萌芽率也无显著差异,褐化率低于5%,萌芽率为100%。上述结果表明,5月中旬和7月上旬两个采集时期对灭菌效果无明显影响。这两个时期采集樱桃李新梢茎段,用酒精和次氯酸钠灭菌均可 达到理想的灭菌效果。

表1 取材时期对樱桃李新梢茎段灭菌效果的影响
2.2 酒精浸泡后处理方式对樱桃李新梢茎段灭菌效果的影响
由表2可见,无菌水洗与不水洗两个处理茎段的污染率、褐化率与萌芽率等指标均无显著差异,污染率均低于10%、褐化率均低于5%,而萌芽率均为100%。上述结果表明,对于樱桃李新梢茎段,在用酒精(70%)浸泡后与用次氯酸钠(2%)浸泡前,用无菌水冲洗与否对灭菌效果无明显影响。因此,为了简化灭菌程序,在用酒精和次氯酸钠对樱桃李新梢茎段灭菌时,酒精浸泡后可以不用无菌水冲洗茎段,直接将茎段放入次氯酸钠中浸泡灭菌。图1为酒精浸泡后两种方式处理的樱桃李茎段灭菌培养状况。

表2 酒精浸泡后处理方式对樱桃李新梢茎段灭菌效果的影响

图1 酒精浸泡后处理方式对樱桃李茎段灭菌培养效果的影响
2.3 IBA浓度对樱桃李试管苗增殖的影响
由表3可见,不同浓度IBA各处理之间的茎长存在显著性差异,但是表现并不规律。IBA浓度为0.3 mg/L处理的茎长显著高于0.1 mg/L和0.2 mg/L两个浓度处理,但与对照无显著差异。IBA浓度为0.4 mg/L和0.5 mg/L两个处理的茎长与0.3 mg/L处理无显著差异,但均显著高于其他3个处理。各处理繁殖系数也存在显著差异,其变化规律与茎长相似。IBA浓度为0.3、0.4和0.5 mg/L 3个处理的繁殖系数差异不显著。0.4 mg/L的处理显著高于对照及0.1、0.2 mg/L两个处理。综合上述结果,以IBA浓度为0.4 mg/L的处理为最佳处理,形成的茎长最长,繁殖系数最高为4.2。由于本试验培养周期为60 d,按照4.2的繁殖系数,接种1个茎段一年内仅可获得约5 500个茎段,繁殖速度还不是很快。因此,繁殖系数还有必要进一步提高。
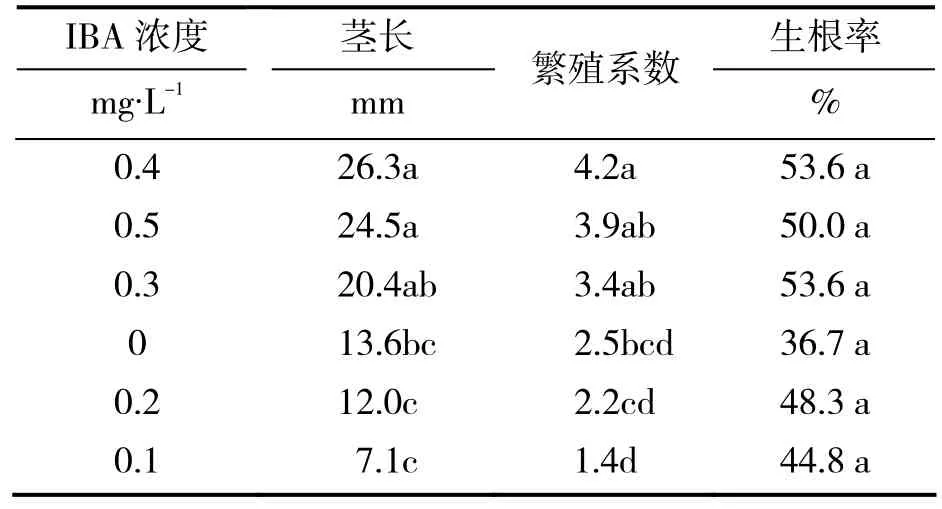
表3 不同IBA浓度对樱桃李试管苗增殖的影响
试验观察到,接种后20 d时各处理茎生长均不明显,接种后20~60 d茎的生长有逐渐加快的趋势(图2)。
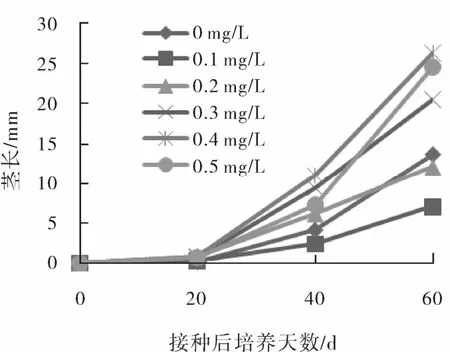
图2 樱桃李试管苗茎段接种后萌生新茎的生长动态
另外,试验中观察到,接种后培养20 d时,各处理生根率基本达到最大,但此时茎段基本没有萌芽生长。各处理均是先发根,后萌芽生长。没有生根的茎段也没有萌芽,个别茎段甚至最后枯死。由此看来,新生茎的生长与生根关系密切,为促进繁殖系数的提高,关键在于提高生根率。从本试验各处理生根率来看,除对照外均在 50%左右(表3),因此生根率还有很大的提高空间。从表3还可以看到,虽然IBA浓度为0.3、0.4 mg/L时的生根率较高,但与其他各处理及对照均无明显差异,说明本试验中添加IBA对樱桃李茎段的根系发生没有明显的促进作用。如何提高樱桃李茎段的生根率尚待进一步研究。
综合上述分析,IBA浓度为0.4 mg/L的处理为本试验最佳处理,繁殖系数最高,可达4.2。繁殖系数的进一步提高将依赖于生根率的提高。
本试验中各处理所形成的试管苗生长健壮,茎粗叶大,将对后期的生根培养十分有利(图3)。
2.4 樱桃李试管苗土壤支撑生根培养效果
由表4可见,以黏壤土做培养基支撑物的处理的生根率为 68.8%,显著高于琼脂做培养基支撑物的处理,根长、茎长及叶数与琼脂支撑培养的无显著差异,两个处理的萌芽率无显著差异。上述结果表明,与琼脂支撑生根培养对照相比,黏壤土做培养基支撑物可以明显促进樱桃李试管苗根系的发生(图4)。
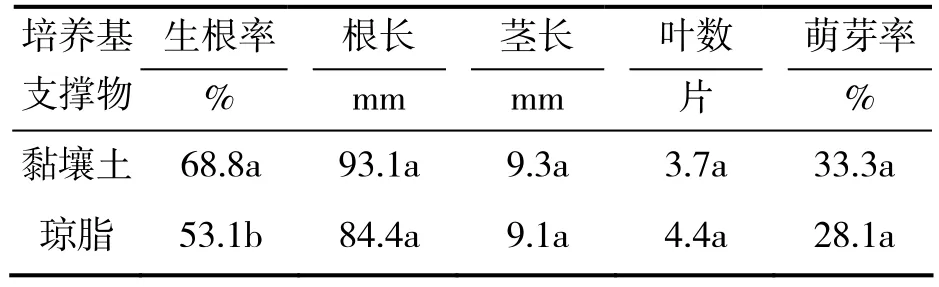
表4 土壤做培养基支撑物对樱桃李试管苗生根培养的影响

图4 两种培养基中樱桃李试管苗的生根状况
通过显微镜对根表面的观察,黏壤土支撑培养的樱桃李试管苗的根表面生有大量根毛,而琼脂支撑培养的根表面基本无根毛的发生(图5)。
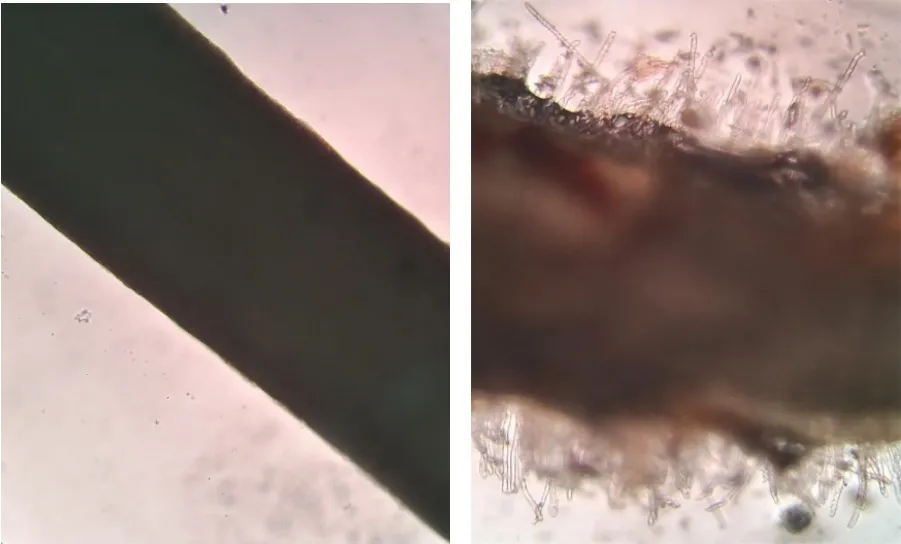
图5 两种培养基中樱桃李试管苗的根毛发生状况
综合上述分析,与琼脂支撑培养对照相比,以黏壤土做培养基支撑物进行樱桃李试管苗的生根培养,可以明显提高生根率,而且根表面生有根毛,同时可以降低成本,因此黏壤土做培养基支撑物是樱桃李试管苗生根培养的较佳处理。
2.5 樱桃李试管苗移栽效果
由表5可见,黏壤土支撑培养中获得的樱桃李试管苗的移栽成活率为 75%,显著高于琼脂支撑培养中获得的试管苗。分析其原因,一方面可能是黏壤土支撑物中生根的试管苗对移栽后的土壤基质适应性较强的缘故。另一方面,黏壤土中生根的试管苗生有大量根毛,增强了根系的吸收能力,因此有利于成活率的提高。对此尚待进一步研究。

表5 樱桃李试管苗移栽效果
3 讨论与结论
外植体灭菌接种以获得无菌茎芽是植物离体快速繁殖的首要环节。酒精(70%)是外植体常用的灭菌剂之一。酒精除了自身具有杀菌作用外,还可以湿润外植体表面,排除外植体表面的空气,利于其他灭菌剂的渗入[15]。因此,在使用其他灭菌剂浸泡灭菌之前,一般先用酒精浸泡一定时间。而且在酒精浸泡后,通常要用无菌水冲洗后再放入其他灭菌剂中浸泡[16-19]。但有一些研究中用酒精浸泡后没有用无菌水冲洗[20-21]。本项结果中酒精浸泡后使用无菌水冲洗与否对樱桃李茎段的灭菌效果无明显影响,因此可以在酒精浸泡后免去无菌水冲洗环节,使樱桃李茎段灭菌过程得以简化。
侍艺等研究表明,使用次氯酸钠做主要灭菌剂对樱桃李水培枝萌发嫩茎和5月下旬采集的新梢茎段有很好的灭菌效果[14]。本项研究中,对 7月上旬采集的樱桃李新梢茎段用次氯酸钠灭菌效果与5月份采集的无显著差异,而且污染率均低于10%,萌芽率达到100%,再次证明以次氯酸钠做主要灭菌剂可以获得令人满意的结果。同时也表明樱桃李新梢茎段外植体的取材适期可以由 5月份延长至7月上旬。
木本植物试管苗增殖的主要方式是促进腋芽发枝和单芽茎段扦插[10]。目前的研究中樱桃李试管苗的增殖多采用促进腋芽发枝的方式。但是这种方式形成的丛生芽缺乏明显的加长生长,会对后期的生根培养造成一定影响。浦艳吉等在培养基中加入0.03 mg/L GA3对丛生芽的伸长起到了一定的促进作用[13]。单节茎段扦插增殖方式一般形成一个单轴延伸的茎,增殖与生根同时进行,形成的试管苗也较健壮。在葡萄、枣等多种木本植物试管苗增殖中常用单节茎段扦插的方式[22-23]。本项研究表明,在含有IBA 0~0.5 mg/L的1/2MS培养基中樱桃李试管苗均可以形成单轴延伸的茎,而且试管苗茎粗叶大,个别茎长可达10 cm,平均茎长则以IBA浓度为0.4 mg/L的处理最长,繁殖系数也以该处理最高,达到4.2。尽管这一繁殖系数不是很高,但是试管苗生长健壮,有利于后续的生根培养。因此,此种增殖方式在进一步提高繁殖系数后有望成为樱桃李试管苗较好的增殖方式。
樱桃李试管苗的生根培养目前都是在琼脂培养基中进行的[11-13]。以土壤做培养基支撑物进行试管苗的生根培养,可以明显降低试管苗成本,提高生根质量,而且有利于移栽成活,已经在珠美海棠、栒 子等多个树种上试验成功[24-25]。以土做培养基支撑物还可以将试管苗的生根培养放在温室中[26-28]甚至露地环境中进行[29-30],从而进一步降低成本。本项结果以黏壤土做培养基支撑物进行樱桃李试管苗生根培养,生根率显著高于琼脂培养基中培养的试管苗,试管苗生有根毛,移栽成活率也显著高于琼脂培养基中的试管苗,这与柴慈江等人的研究结果基本一致[24-25]。
因此,本项研究初步得出以下结论:2018年5月15日和7月9日取樱桃李新梢茎段,用70%酒精和2%次氯酸钠灭菌,取材时期对灭菌培养效果无明显影响,这两个时期取材污染率均低于10%、萌芽率均达100%;酒精浸泡后用无菌水冲洗与否对灭菌效果无明显影响;在含有0.4 mg/L IBA的1/2MS培养基上培养60 d樱桃李试管苗繁殖系数为4.2;在黏壤土做支撑物的培养基上樱桃李试管苗的生根率为 68.8%,显著高于琼脂培养基;土壤支撑培养的樱桃李试管苗的移栽成活率为75%,显著高于琼脂支撑培养的试管苗(33.3%)。

