miR-206、miR-155在乳腺癌中的表达及其与激素受体相关性分析*
覃舒婷,莫军扬,张敏敏,唐 茜,卢林捷,陈 岩,韦业刚,杨 立
(广西壮族自治区柳州市人民医院普外三科 545006)
乳腺癌是一种激素依赖性肿瘤,其相关性激素受体,包括雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和Her-2的表达水平,是选择个体化内分泌治疗方案、评估愈后的重要依据。微小RNA(microRNAs,miRNA/miR) 是一种内源性非编码RNA,具有抑癌基因或类癌基因的功能。最近研究发现,miRNA在乳腺癌的诊断、转移、愈后、耐药等多方面起了重要作用[1]。本研究通过实时荧光定量PCR(RT-qPCR)检测乳腺癌组织中miR-206、miR-155的表达,比较其与ER、PR、无病生存期(disease free survival,DFS)的相关性,探讨其是否能成为一种新的预测内分泌治疗敏感度及患者预后评估的标记物,现报道如下。
1 资料与方法
1.1一般资料 选取2014年1-12月本院100例女性乳腺癌患者为研究对象,平均年龄(50.08±10.85)岁;所有患者均按WHO乳腺肿瘤分类标准进行病理学分型,TNM分期中Ⅰ期25例,Ⅱ期56例,Ⅲ期19例;无淋巴结转移48例,有淋巴结转移52例;病理类型:浸润性导管癌95例,中分化腺癌1例,小叶癌2例,导管内癌2例。所有患者在采集组织标本前均未经放、化疗,且无乳腺炎症等并发症。
1.2方法
1.2.1标本采集 收集100例女性乳腺癌组织石蜡标本,重新切片用于免疫组织化学。同时收集术中乳腺组织,取自病变非坏死部位,置于灭菌冻存管,液氮速冻,-80 ℃保存,用于RT-qPCR。
1.2.2试剂与仪器 Hipure FFPE miRNA Kit提取分离试剂盒购自广州Magen公司,ReverTra Ace ToYoBo qPCR RT Kit反转录试剂盒购自上海ToYoBo公司,PCR采用KAPA Probe Fast qPCR Master Mix试剂盒购自北京KAPA公司,RT-qPCR仪(型号Mx3005P)购自上海安捷伦公司。兔抗人ER、PR一抗购自美国Cell Signaling公司,羊抗兔二抗、多聚甲醛、石蜡、柠檬酸缓冲液、苏木素和伊红等免疫组织化学试剂购自北京中杉金桥生物技术公司。
1.2.3试验方法
1.2.3.1免疫组织化学检测乳腺癌组织ER、RP表达 乳腺癌组织标本进行切片,每张厚度4 μm。烤片、二甲苯脱蜡、梯度乙醇脱水。阻断内源过氧化物酶:3%H2O2,室温封闭5~10 min,磷酸盐缓冲液(PBS)冲洗3 min,共3次。抗原修复:0.01 mmol/L枸橼酸缓冲液(pH=6.0)中煮沸15~20 min,冷却20 min,PBS冲洗3 min,共3次。血清封闭:滴加5% BSA 封闭液,室温封闭15 min。加一抗:4 ℃过夜,PBS冲洗3 min,共3次。滴加辣根过氧化物酶(HRP)标记抗兔IgG二抗,室温孵育1 h。PBS冲洗3 min,共3次。DAB显色,苏木素复染,常规脱水、透明、干燥,中性树脂封片,室温保存。光学显微镜下观察染色结果,每张切片取至少5~8个视野,由两名副高职称的病理医生进行结果判定。ER、PR染色位于乳腺癌细胞的细胞核,其表达强度的不同,可呈浅棕色至深棕色。ER、PR阳性标准为:≥1%肿瘤细胞核阳性。
1.2.3.2miR-206、miR-155水平检测 取乳腺癌组织,应用Trizol试剂、氯仿、异丙醇、RNA提取分离试剂盒,按照isoTMplus及异丙醇按说明书步骤进行操作,提取总RNA。取2.0 μg 总RNA为模板,加入反转录引物合成cDNA。再取cDNA模板,进行PCR扩增,上游引物分别为U6、miR-206、miR-155。U6正向引物:5′-CAC TCA GCT CAC GCA AAT TCG TG-3′;miR-206正向引物:5′-CAC TCA GCT GTG GAA TGT AAG GAA GTG-3′;miR-155正向引物:5′-CAC TCA GCT GTT AAT GCT AAT CGT GAT AG-3′;下游共同引物为miR-27,miR-27反向引物:5′-CTG GTG TCG TGG AGT CG-3′。RT-qPCR条件:95 ℃ 3 min;95 ℃ 3 s,55 ℃ 30 s,读FAM荧光数值,40个循环;30 ℃ 30 s。以参照基因U6和miR-206、miR-155基因作为标准,利用RT-qPCR通过2-△△Cp方法分析相对基因表达差异,其中△Cp=[Cp(处理组目的基因)-Cp(处理组内参基因)]。U6、miR-206、miR-155的荧光定量标准曲线见图1~3。
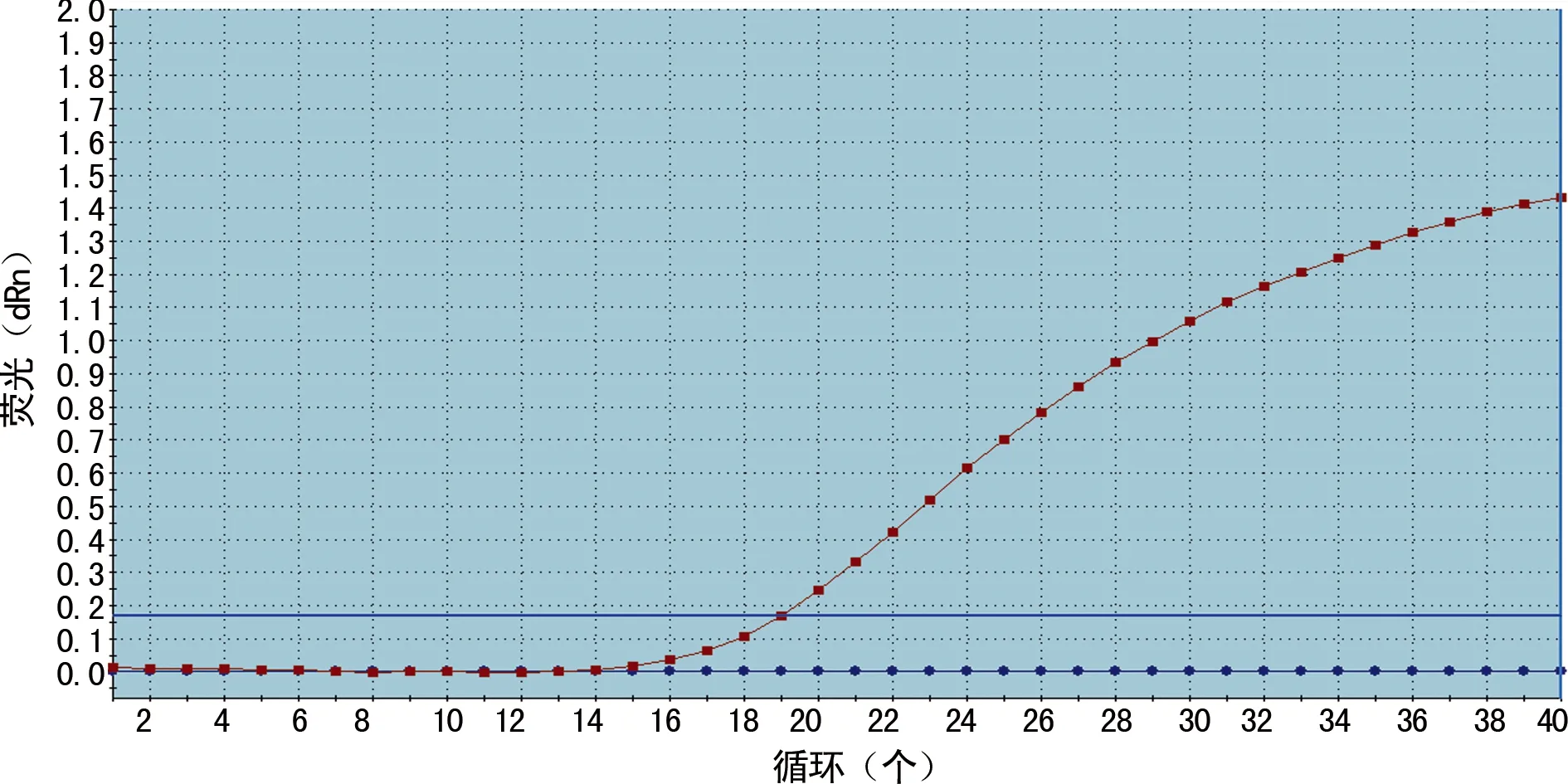
图1 U6的荧光定量标准曲线
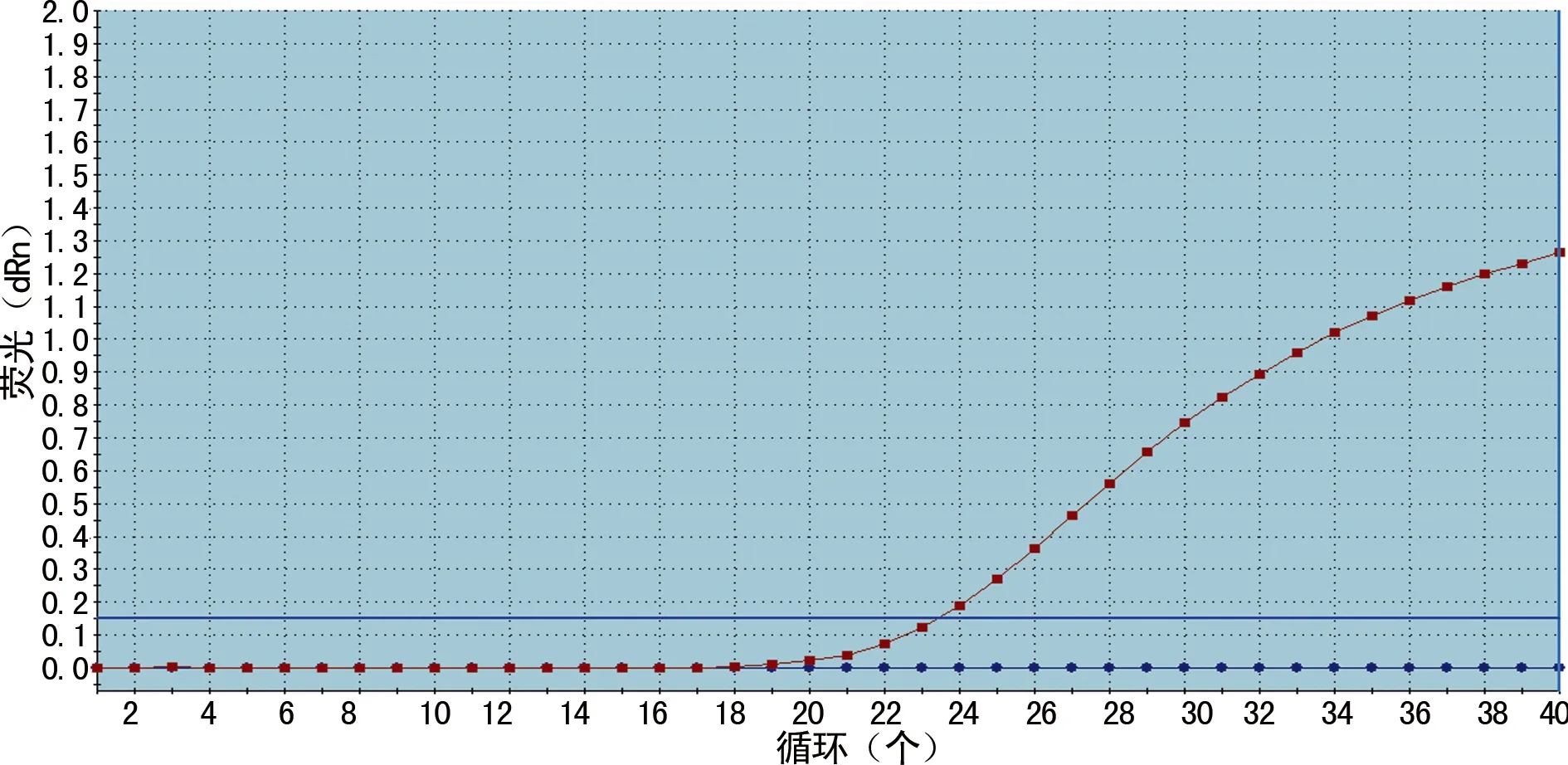
图3 miR-155的荧光定量标准曲线
1.2.4随访 采取门诊复查或电话随访,随访时间截止至2017年12月。失访10例,90例患者随访满36个月,随访率为90%。主要观察指标为DFS。

2 结果
2.1ER、PR在乳腺癌组织中的表达 100例乳腺癌患者中,ER表达阳性77例,阳性率77%。PR表达阳性66例,阳性率66%,见图4、5。
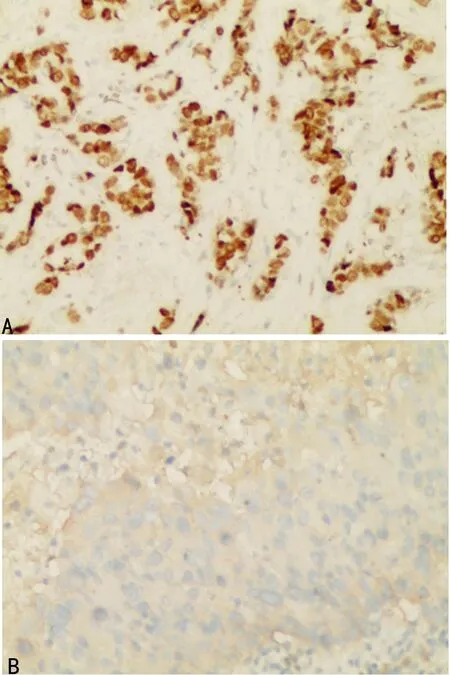
A:ER染色阳性;B:ER染色阴性
图4乳腺癌组织中ER染色结果(免疫组织化学法,×200)

A:PR染色阳性;B:R染色阴性
图5乳腺癌组织中PR染色结果(免疫组织化学法,×200)
2.2乳腺癌组织中miR-206和ER、PR表达的相关性 乳腺癌组织中miR-206的表达水平与ER表达水平呈负相关(P<0.05),而miR-206与PR表达无相关性(P>0.05),见表1。

表1 乳腺癌中miR-206和ER、PR表达相关性
2.3乳腺癌组织中miR-155和ER、PR表达的相关性 乳腺癌组织中miR-155的表达和ER、PR表达均呈负相关(P<0.01),见表2。

表2 乳腺癌中miR-155和ER、PR表达相关性
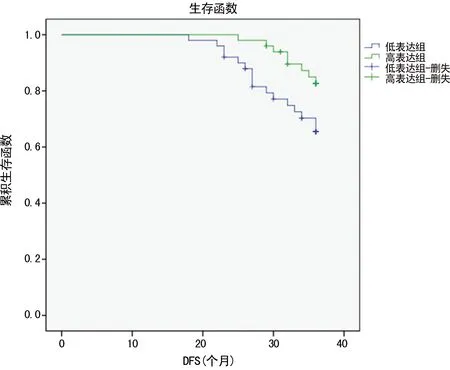
图6 miR-206表达水平与DFS相关性
2.4乳腺癌组织中miR-206、miR-155与DFS相关性 对乳腺癌患者进行36个月的追踪随访,以miR-206相对表达中位值2-△△Ct=-2.12作为截断值,Kaplan-Meier分析表明,癌组织中miR-206低表达者,无病生存率下降;低表达组平均无病生存时间为33.3(31.9,34.7)个月,高表达组为35.3(34.6,35.9)个月,两组比较差异有统计学意义(χ2=4.381,P=0.036)。以miR-155相对表达中位值2-△△Ct=-0.94作为截断值,Kaplan-Meier分析表明,癌组织中miR-155高表达者,DFS率下降;高表达组平均DFS时间为33.7(32.5,34.9)个月,低表达组为35.2(34.4,36.0)个月,两组比较差异有统计学意义(χ2=4.894,P=0.027),见图6、7。
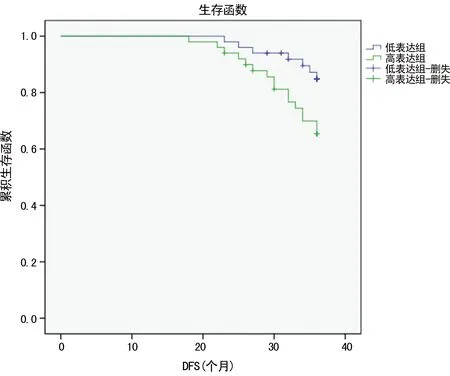
图7 miR-155表达水平与DFS相关性
3 讨论
目前,无论在国内或是国外,乳腺癌都是女性发病率最高的恶性肿瘤,术后有效的内分泌治疗和愈后评估对患者尤为重要。乳腺癌是一种激素依赖型肿瘤,雌激素和孕激素已证实与乳腺癌的发生、发展和转移密切相关。临床上,多依据癌组织ER、PR、Her-2的表达情况,来制订内分泌治疗方案及评估预后[2-3]。
miRNA是一种内源性非编码RNA,经基因芯片分析,部分miRNA具有激素应答功能[4]。最近研究发现,miRNA通过类癌基因或抑癌基因的方式参与了乳腺肿瘤细胞的生长发育及信号转导[5],因此,miRNA可能与乳腺癌相关受体有一定的相关性,本研究通过分析miRNA与ER、PR、DFS的相关性,因而可认为其能成为一种新的预测内分泌治疗敏感度及评估预后的标记物。
miR-206是最早发现的与乳腺癌相关的miRNA。miR-206对癌细胞ER的表达可能起负调控作用。ADAMS等[6]发现miR-206可与ER mRNA 3′端的结合位点结合,导致ER数量下调。将miR-206转染入乳腺癌MCF-7细胞系中,癌细胞ER表达下调[7]。YIN等[8]培养ER阳性的乳腺癌细胞后发现,miR-206可通过转化生长因子-β(TGF-β)通路抑制上皮-间质细胞的转化。本研究结果亦显示miR-206在乳腺癌组织中的表达与ER的表达呈负相关,而与PR无相关性,可能与miR-206的作用机制有关。多项研究发现,miR-206主要通过下调ER及ER共调节蛋白mRNA、蛋白表达[9],或直接作用于Notch3、Cdc42等蛋白,从而抑制癌细胞增殖、转移,未经过PR及相关作用途径。miR-155是最早被发现的具有促癌活性的miRNA,有研究发现:miR-155在ER、PR阴性的乳腺癌组织中的表达水平明显高于ER、PR阳性患者,在三阴性或Her-2型乳腺癌组织中高表达。且血清或癌组织miR-155能早期预测ER、PR状态,以协助判断临床乳腺癌的分子分型[10-11]。本研究结果显示,miR-155在乳腺癌组织中的表达与ER、PR的表达均呈负相关。
既往研究发现,miR-206通过TWF1/MKL1-SRF/IL11信号通路抑制乳腺癌细胞增殖和迁移[12]。而miR-155可促进肿瘤的侵袭转移,从而产生负性预后效应[1]。本研究结果也发现,miR-206和患者DFS呈正相关,miR-155与DFS呈负相关。可见,二者对疾病的预后评估也存在潜在价值。
综上所述,乳腺癌组织中miR-206、miR-155的表达与ER、PR、DFS均有相关性,其可成为新的预测内分泌治疗敏感度及患者预后评估的标记物。下一步可增加样本量验证,探索miRNA在乳腺癌早期诊断、肿瘤转移侵袭、内分泌方案选择及预后等多方面的价值。

