槲皮苷对免疫功能低下小鼠的免疫调节作用①
陈龙云 周艳艳 徐安莉 赵 敏 黄 敏 陈会敏
(湖北中医药大学,武汉 430000)
槲皮苷(Quercitrin,QI)作为天然黄酮苷化合物具有广泛的药理活性,不仅在抗心脑血管疾病、神经保护及调血脂等方面具有良好药理活性[1],而且还具有抗过敏、抗氧化、止咳平喘、抗血小板聚集、降血糖和抗肿瘤等作用[2]。槲皮苷在自然界分布广泛且含量丰富,具有多种活性而又几乎无毒副作用,是非常有潜力的天然先导化合物。然而国内外关于槲皮苷针对免疫低下机体的免疫功能的影响相关研究较少。刘晓岩等[3]研究表明槲皮苷可能通过一氧化氮及免疫调节机制对睡眠剥夺大鼠的睡眠产生积极影响,同时也可对正常大鼠进行免疫调节。本实验采用实验性免疫抑制小鼠为模型,探讨槲皮苷对免疫抑制小鼠免疫功能的影响并研究其作用机制,为其在增强免疫低下人群的免疫功能及治疗相关疾病方面提供科学支持。
1 材料与方法
1.1材料 环磷酰胺(Cyclophosphamide,CTX)购自上海源叶生物,鸡红细胞购自武汉纯度生物,槲皮苷均购自美国Sigma公司;IgG、IgM、IL-2、IL-4、SOD、CAT等ELISA试剂盒均购自武汉伊莱瑞特生物科技有限公司;MDA试剂盒购自南京建成生物工程研究所2′,7′-二氯二氢荧光素二乙酸酯(2′,7′-Dichlorodihydrofluorescein diacetate,DCFH-DA);细胞ROS检测试剂盒、BCA试剂盒购自碧云天生物技术有限公司;CD4-FITC、CD8-PE antimouse单抗购自BioLegend公司;蛋白Marker购自北京全式金生物技术有限公司;小鼠单抗β-actin、HRP标记羊抗兔二抗、兔多抗NF-κB p65、兔多抗TLR2均购自Affinity公司;6周龄BALB/c小鼠购自武汉大学动物实验中心,许可证号:SCXK(鄂)2018-0003。
流式细胞仪(CytoFLEX,美国Beckman Coulter公司);倒置显微镜(IX51,中国OLYMPUS公司);低速离心机(5702R,德国Eppendorf公司);酶标仪(Multi skan MK3,美国Thermo Scientific 公司);凝胶电泳系统(美国Bio-Rad公司);凝胶成像仪 (BioSpectrum,美国UVP公司)。
1.2方法
1.2.1造模与给药 50只BALB/c小鼠体重18~22 g,雌雄各半,随机分为对照组、模型组(200 mg/kg)、槲皮苷低剂量组(20 mg/kg)、槲皮苷中剂量组(50 mg/kg)和槲皮苷高剂量组(80 mg/kg)(给药剂量参考Li及刘珊珊等[4,5]的研究),每组10只。于恒温(22~26℃)、恒湿(42%~65%)条件下适应性饲养1周,自由进食和饮水。7 d后模型小鼠均一次性腹腔注射CTX 200 mg/kg,对照组注射等体积生理盐水;槲皮苷低剂量组(20 mg/kg)、槲皮苷中剂量组(50 mg/kg)和槲皮苷高剂量组(80 mg/kg)均第2天开始灌胃给药,对照组及模型组每天灌胃等体积生理盐水。连续治疗14 d。
1.2.2称重法测定小鼠免疫器官指数 末次给药24 h后处死小鼠,立即称小鼠体重;无菌条件下迅速取出脾脏和胸腺器官洗净并称重,根据以下公式计算脾指数和胸腺指数。脾脏指数%=[脾脏重量(g)/小鼠体重(g)]×100%;胸腺指数%=[胸腺重量(g)/小鼠体重(g)]×100%。
1.2.3Giemsa染色法检测小鼠腹腔巨噬细胞吞噬功能 小鼠末次给药后腹腔注射0.5 ml生理盐水(含1%鸡红细胞),轻揉小鼠腹部使鸡红细胞分散。1 h后处死小鼠,暴露腹膜并注入200 μl PBS,反复混匀后吸取腹腔液均匀涂片,置于湿盒中37℃孵育,30 min后用生理盐水洗去未吸附鸡红细胞,丙酮-甲醇溶液固定5 min,Giemsa液染色15 min后镜检,每片计数200个巨噬细胞,按照以下公式计算吞噬百分率和吞噬指数。
吞噬百分率%=(吞噬鸡血红细胞的巨噬细胞数/计数的巨噬细胞数)×100%;吞噬指数%=(被吞噬的鸡血红细胞总数/计数的巨噬细胞数)×100%。
1.2.4ELISA测定小鼠血浆IgG、IgM、IL-2及IL-4水平 各实验组眼眶取血,低温高速离心取血浆。根据相应ELISA试剂盒说明书进行小鼠血浆IgG、IgM、IL-2及 IL-4含量的测定。
1.2.5流式细胞术检测小鼠脾淋巴细胞亚群 颈脱臼处死小鼠,无菌条件下取脾脏,经过研磨并过滤制成单细胞悬液,RPMI1640洗涤,以3 000 r/min的转速离心1 min,弃上清,加2 ml红细胞裂解液,室温静置3 min使红细胞完全裂解,然后再以3 000 r/min离心1 min,弃上清,以RPMIl640培养基洗涤并重复离心1次,得细胞沉淀制作小鼠脾细胞混悬液(1×107个/ml),各流式检测管中分别加入100 μl,再分别加入FITC-CD4、PE-CD8抗体各2 μl,振荡混匀后4℃避光静置30 min;PBS洗涤,离心2次,弃上清,再加入PBS重悬细胞后上机检测,Flow Jo软件分析。
1.2.6小鼠免疫器官组织学观察 脱颈椎处死小鼠,无菌取出胸腺、脾脏,以波恩固定液固定。组织依次用75%、85%、90%、95%及无水乙醇进行组织脱水,以二甲苯进行透明处理,后以60℃石蜡缸进行浸蜡,再进行石蜡包埋并切片,然后脱蜡,苏木素-伊红染色,1%的盐酸酒精分化,中性树胶封片,最后光学显微镜下观察并拍照。
1.2.7流式细胞术检测小鼠脾脏细胞ROS水平 小鼠脾细胞悬液(1×107ml-1)各取100 μl加入到流式检测管,按照DCFH-DA细胞ROS检测试剂盒说明操作。上机检测后以Flow Jo软件分析。
1.2.8ELISA测定小鼠血浆SOD、MDA及CAT的水平 各实验组随机取8只小鼠,末次给药24 h后,眼眶取血,低温高速离心取血浆。小鼠血浆中SOD、MDA及CAT的含量检测以相应ELISA试剂盒说明书进行操作。
1.2.9Western blot法检测NF-κB p65、TLR2蛋白表达情况 取剪碎的脾脏组织于自动匀浆机中充分匀浆,加入600 μl组织蛋白裂解液冰上裂解 15 min,4℃下以14 000 r/min转速离心 10 min,收集上层清液。BCA法测定相应蛋白浓度。取等量样品以12% SDS-PAGE电泳分离,PVDF转膜,5%脱脂奶粉缓冲液室温封闭2 h,经兔多抗NF-κB p65(1∶2 000)、兔多抗TLR2(1∶1 000)、内参β-actin(1∶1 000)等一抗4℃摇床孵育过夜,充分洗涤后,再以相应辣根过氧化酶标记的二抗37℃摇床孵育2 h,ECL化学发光显影。以美国 UVP 分析仪器扫描胶片,再以Quantity One 软件分析各蛋白条带灰度值。

2 结果
2.1小鼠免疫器官指数测定结果 如图1,较对照组而言,模型组小鼠的胸腺指数和脾脏指数均显著降低(P<0.000 1);与模型组相比,低剂量槲皮苷组小鼠的脾脏指数和胸腺指数上升,但差异无统计学意义(P>0.05),中剂量组和高剂量组小鼠的脾脏指数和胸腺指数均显著上升(P<0.05),且高剂量组的脾脏指数和胸腺指数大于中剂量组。
2.2小鼠腹腔巨噬细胞吞噬功能检测结果 Giemsa染色结果显示(图2A),巨噬细胞吞噬鸡红细胞程度不同:未被吞噬的鸡红细胞呈粉红色,散在分布,也有部分聚集在巨噬细胞周围,而吞噬细胞则呈球形,着蓝色;已吞入鸡红细胞的巨噬细胞整体形状不规则,着色加深;有的巨噬细胞吞入了多个红细胞,体积变大且着色更深,为紫黑色。统计结果显示(图2B、C),模型组吞噬百分率和吞噬指数均极显著低于对照组(P<0.000 1);与模型组相比,低剂量槲皮苷组小鼠的吞噬百分率和吞噬指数均上升,其中吞噬百分率差异无统计学意义(P>0.05),而吞噬指数统计有差异性(P<0.05);中剂量组及高剂量组小鼠的吞噬百分率和吞噬指数均显著上升(P<0.01),且高剂量组的吞噬百分率和吞噬指数均大于中剂量组。
2.3小鼠血浆免疫球蛋白及细胞因子水平测定结果 根据图3A、B,与对照组相比,模型组的IL-2、IL-4水平明显下降(P<0.000 1);与模型组相比,给予不同剂量槲皮苷干预组小鼠的IL-2、IL-4水平均发生明显上升(P<0.05),且高剂量组的IL-2、IL-4水平均高于中剂量组。同时,模型组IgG、IgM含量较之于对照组显著下降(P<0.000 1);与模型组相比,低剂量槲皮苷组的IgG含量均上升但差异未有统计学意义(P>0.05),IgM的含量统计差异性显著上升(P<0.000 1);中剂量组和高剂量组的IgG、IgM含量均显著上升(P<0.01),且高剂量组的IgG、IgM含量均大于中剂量组(图3C、D)。
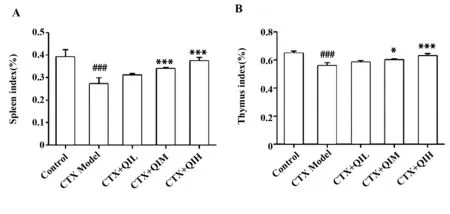
图1 小鼠免疫器官指数测定Fig.1 Determination of immune organ indices of miceNote: ###.P<0.000 1 vs control group;*.P<0.05,***.P<0.000 1 vs model group.Control.Control group;CTX Model.Model group which was dealt with cyclophosphamide (200 mg/ml);CTX+QIL.Group which was dealt with both cyclophosphamide and low dose of quercitrin (20 mg/ml);CTX+QIM.Group which was dealt with both cyclophosphamide and medium dose of quercitrin (50 mg/ml);CTX+QIH.Group which was dealt with both cyclophosphamide and high dose of quercitrin (80 mg/ml),similarly hereinafter.
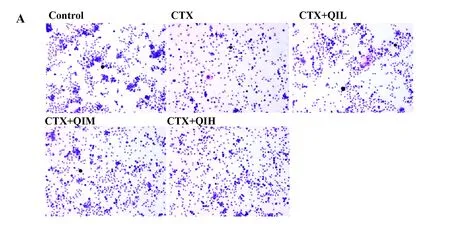
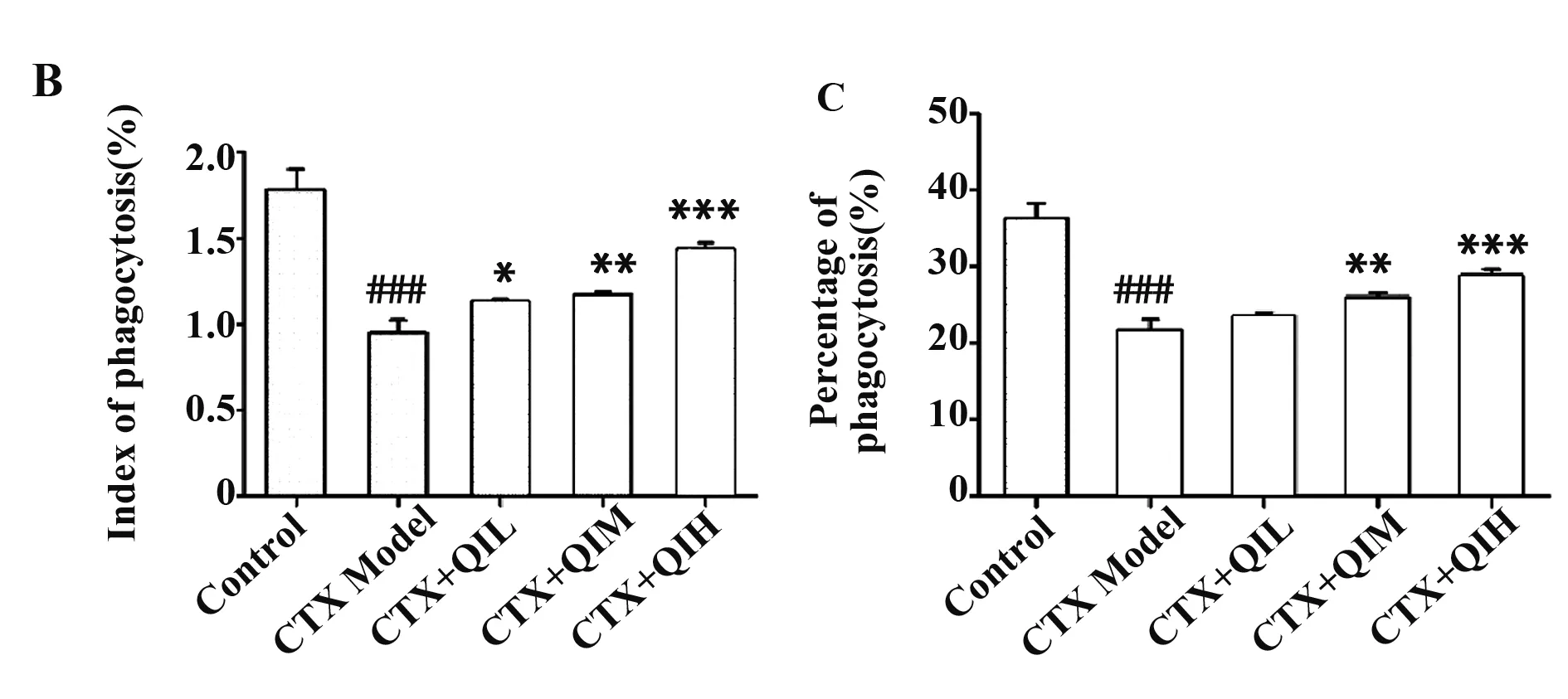
图2 小鼠腹腔巨噬细胞吞噬功能检测
Fig.2 Detection of phagocytic function of mouse perito-neal macrophages
Note: A.Result of giemsa staining (×400);B.Statistical graph of phagocytosis percentage;C.Statistical graph of phagocytosis index.###.P<0.000 1 vs control group;*.P<0.05,**.P<0.01,***.P<0.000 1 vs model group.
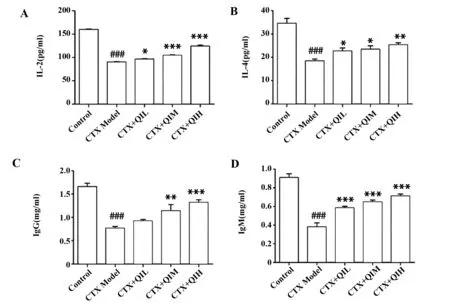
图3 ELISA检测小鼠血浆IgG、IgM及IL-2、IL-4细胞因子含量Fig.3 Detection of plasma IgG,IgM,IL-2,IL-4 cytokines in mice by ELISANote: A.IL-2;B.IL-4;C.IgG;D.IgM.###.P<0.000 1 vs control group;*.P<0.05,**.P<0.01,***.P<0.000 1 vs model group.
2.4小鼠免疫器官组织的影响 观察并分析HE染色结果发现,对照组的小鼠脾脏结构清晰,脾小体较大,中央动脉周围淋巴细胞较为密集;模型组小鼠脾脏组织白、红髓分界不清晰,脾小结数量减少;给予槲皮苷干预的各组脾脏白、红髓分界随剂量增大逐渐变清晰,脾小体数量逐渐增多,体积较模型组大;淋巴细胞数量也随着槲皮苷剂量的增加较模型组增多(图4)。
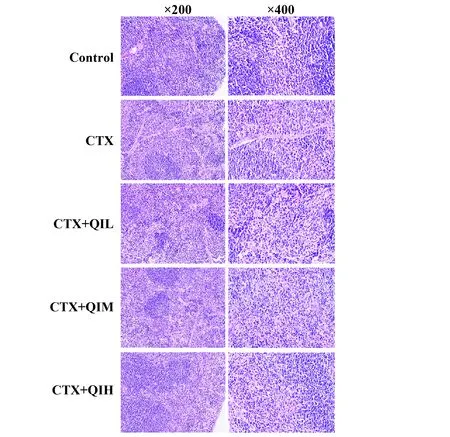
图4 小鼠免疫器官组织学观察Fig.4 Histological observation of mouse immune organsNote: The dark blue round or oval body are white pulp;the purple parts are mainly red pulp.
2.5小鼠脾淋巴细胞亚群检测结果 由图5可知,模型组的CD4+、CD8+脾淋巴细胞水平和CD4+/CD8+值均显著低于对照组(P<0.000 1);与模型组相比,低剂量槲皮苷干预下小鼠CD4+脾淋巴细胞水平及CD4+/CD8+值均显著高于模型组(P<0.05),CD8+脾淋巴细胞水平较之模型组差异无统计学意义(P>0.05),中剂量组和高剂量组的CD4+、CD8水平以及CD4+/CD8+值均显著上升(P<0.000 1)。
2.6小鼠脾脏细胞ROS水平的影响 DCF的荧光强度代表了细胞内ROS水平的高低。根据流式结果,模型组脾脏细胞ROS水平显著高于对照组(P<0.000 1);给予不同剂量槲皮苷干预的各组均较模型组ROS水平升高,差异有显著统计学意义(P<0.000 1),见图6。
2.7小鼠血浆中SOD、MDA及CAT水平的检测 与对照组相比,模型组的SOD和CAT水平明显降低(P<0.000 1),而MDA水平则显著升高(P<0.000 1);相较于模型组,槲皮苷低剂量组的SOD和CAT水平升高但差异无统计学意义(P>0.05),MDA水平显著降低(P<0.000 1);槲皮苷中剂量组和高剂量组的SOD和CAT水平均显著升高,且MDA水平显著降低(P<0.01)。结果见图7。
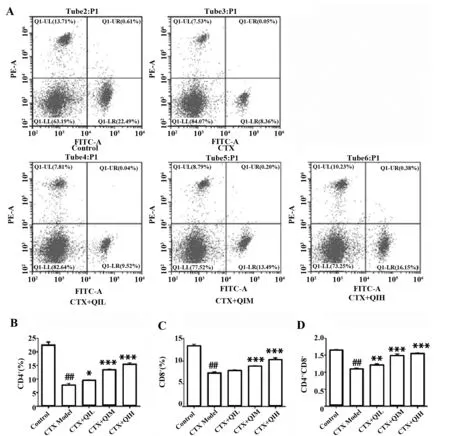
图5 流式检测小鼠脾CD4+、CD8+淋巴细胞亚群含量Fig.5 Flow cytometry detection of CD4+,CD8+ lympho-cyte subsets in mouse spleenNote: A.Result of flow cytometry;B.Statistical result of CD4+;C.Statistical result of CD8+;D.Statistical result of CD4+/CD8+.###.P<0.000 1 vs control group;*.P<0.05,**.P<0.01,***.P<0.000 1 vs model group.
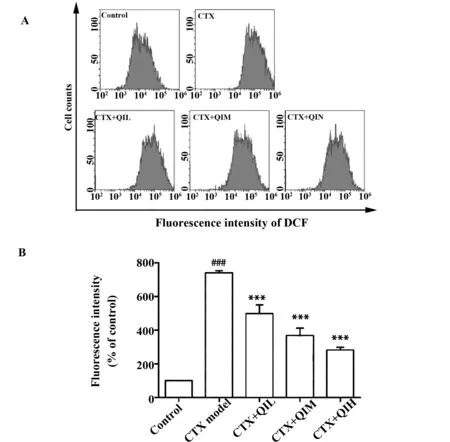
图6 流式细胞术检测小鼠脾脏细胞ROS水平Fig.6 Flow cytometry detection of ROS levels in mouse spleen cellsNote: A.Flow cytometry.B.Respective statistical result.###.P<0.000 1 vs control group;***.P<0.000 1 vs model group.
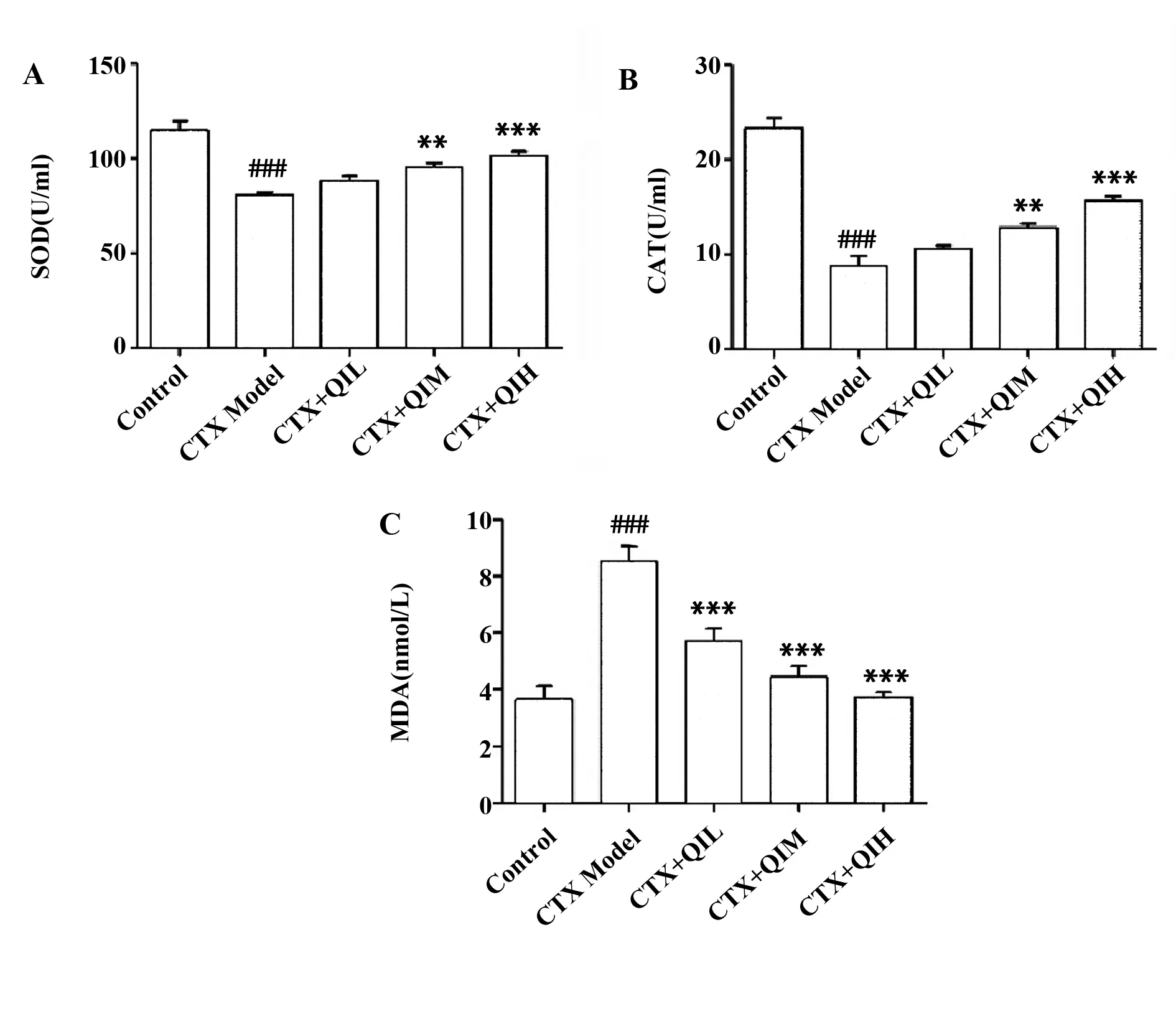
图7 小鼠血浆中SOD、MDA及CAT水平检测结果Fig.7 Results of SOD,MDA and CAT levels in mouseplasmaNote: A-C.Statistical results of SOD,MDA and CAT level,respectively.###.P<0.000 1 vs control group;**.P<0.01,***.P<0.000 1 vs model group.
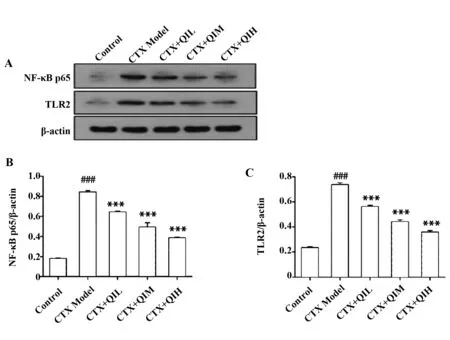
图8 WB检测脾脏NF-κB p65、TLR2蛋白表达水平变化Fig.8 WB determination of NF-κB p65 and TLR2 prote-in expression levels in spleenNote: A.Band of NF-κB p65 and TLR2 protein,respectively;B and C.Statistical graphs showing NF-κB p65 and TLR2 protein levels,respectively.###.P<0.000 1 vs control group;*.P<0.05,**.P<0.01,***.P<0.000 1 vs model group.
2.8WB检测结果 如图8,模型组中WB所检测NF-κB p65及 TLR2蛋白的表达水平较之对照组均显著升高(P<0.000 1);槲皮苷各剂量组的NF-κB p65及 TLR2蛋白水平均发生显著下降(P<0.000 1),且随着剂量增加,NF-κB p65及 TLR2蛋白水平下降越明显。
3 讨论
免疫力低下是导致疾病发生的关键原因之一。脾脏是机体最大的免疫器官,是机体的细胞免疫和体液免疫中心,既可通过吞噬作用发挥非特异性免疫功能,又可通过T、B细胞介导的细胞免疫和体液免疫发挥特异性免疫功能[6]。而胸腺作为机体免疫体系的主要内分泌腺体,可通过分泌T细胞及胸腺素来参与机体细胞免疫过程,使机体保持免疫稳态。胸腺可调控T细胞的分化成熟,使其表达不同的抗原,根据产生的免疫表型的不同分为CD4+、CD8+亚群,CD4+、CD8+T细胞可双向调控免疫应答,二者的比例失调会导致免疫功能失常。CD4+T细胞又可在外源抗原的刺激诱导下分化为Th1和Th2两类细胞,Th1细胞可分泌IFN-γ和IL-2,介导细胞应答;而Th2则主要产生IL-4、IL-6等细胞因子来介导体液免疫应答,其含量及功能变化决定机体免疫功能[7-9]。另外,IgG、IgM水平也是反映体液免疫能力的常用指标之一[10]。本研究通过CTX引起小鼠胸腺及脾免疫器官指数、腹腔巨噬细胞吞噬百分率及吞噬指数、CD4+、CD8+亚群及CD4+/CD8+值、IgG、IgM、IL-2及IL-4水平显著下降,表明小鼠免疫抑制模型成功。分别给予50 mg/ml和 80 mg/ml槲皮苷干预均可显著上调免疫抑制小鼠的免疫器官指数、腹腔巨噬细胞吞噬百分率及吞噬指数、CD4+、CD8+亚群及CD4+/CD8+值、IgG、IgM、IL-2及IL-4水平,20 mg/ml槲皮苷干预下免疫抑制小鼠的免疫器官指数、腹腔巨噬细胞吞噬百分率及吞噬指数、CD4+、CD8+亚群及CD4+/CD8+值、IgG、IgM、IL-2及IL-4水平等指标也均得到上调,但部分指标差异无统计学意义;脾脏组织病理学观察结果也显示脾脏红、白髓的分界随着槲皮苷干预剂量的增加逐渐清晰,高倍镜下观察到淋巴细胞也逐渐增多;以上均表明槲皮苷可呈剂量依赖性促进损伤脾脏组织的修复,并有助于淋巴细胞的增殖,调节淋巴细胞分泌细胞因子水平,促进吞噬功能恢复,增强免疫抑制小鼠的免疫器官功能,最终增强免疫低下小鼠的免疫功能。综上所述,槲皮苷可从器官、细胞及分子层面上上调机体的细胞免疫与体液免疫水平,其作用具有剂量依赖性。
研究表明,氧化应激可引起DNA损伤、蛋白变性或脂质过氧化,表现为线粒体等损伤,最终使细胞被氧化损伤无法恢复,诱发机体患病[11]。王斌等[12]研究表明,高脂膳食诱导大鼠处于氧化应激状态时,大鼠的体液免疫应答水平明显下降,且Billertakahashi等[13]也证实ROS含量过高可能导致机体免疫功能受抑,表明免疫功能的强弱与机体的抗氧化水平有关。因此,本实验进一步探究槲皮苷对免疫抑制小鼠抗氧化水平的影响。结果槲皮苷可以剂量依赖方式下调模型组ROS、MDA水平同时上调SOD、CAT水平,提高机体抗氧化水平;这与Jiang等[14]研究发现槲皮苷具有直接清除活性氧能力的结果相吻合。
NF-κB是核转录因子,家族成员包括p50(NF-κB1)、p52(NF-κB2)、RelA(p65)、RelB和cRel,参与调控氧化应激过程。正常细胞中NF-κB p50/p65二聚体与它的抑制蛋白(IκB)结合而处于三聚体状态,存在于胞浆。受外界刺激后,IκB发生磷酸化、泛素化并被降解,三聚体因此解离,NF-κB p50/p65转入细胞核并与DNA的靶向序列相结合,从而启动转录,在免疫、炎症、氧化及细胞凋亡等方面起重要作用[15,16]。NF-κB是TLR2信号通路的下游靶标蛋白,有研究证实来自生殖支原体的三酰基化脂蛋白可以通过TLR1和TLR2激活NF-κB的表达[17]。本研究中槲皮苷以剂量依赖方式显著下调小鼠脾脏组织NF-κB p65和TLR2蛋白的表达水平(P<0.05),表明槲皮苷可能通过抑制NF-κB p65和TLR2蛋白的表达来改善小鼠免疫功能低下状态。具体作用机制可能是通过抑制NF-κB p65和TRL2蛋白的表达,降低ROS水平并提高SOD水平和机体抗氧化水平,从而促进免疫器官功能恢复来提高免疫功能低下小鼠的免疫水平。
综上,槲皮苷能促进免疫低下机体恢复免疫功能,并呈剂量依赖性。其可能的机制是抑制NF-κB p65和TRL2等蛋白表达,调节机体免疫相关细胞因子及抗氧化物质,提高机体抗氧化水平,增强免疫器官水平,最终起到增强免疫低下小鼠免疫力的作用。

