98%呋虫胺原药对大鼠两代繁殖毒性研究
卢 昊,付少华*
(1.湖北省疾病预防控制中心,武汉 430079;2.应用毒理湖北省重点实验室,武汉 430074)
呋虫胺(dinotefuran),化学名称为(RS)-1-甲基-2-硝基-3-(四氢-3-呋喃甲基)胍,是日本三井化学AGRO株式会社研究开发的新烟碱类杀虫剂,因含有四氢呋喃,也将其称为“呋喃烟碱”[1-2]。它作用于昆虫神经传递系统中的乙酰胆碱受体,使昆虫麻痹而死,对半翅目、鳞翅目、直翅目等多种害虫均具有良好的防治作用[3-4]。农药作为一种常见的环境化学污染物,其安全问题一直备受关注。目前已有呋虫胺对家蚕、蜜蜂、蚯蚓、甲壳纲生物的毒性及大鼠免疫毒性的研究报道[5-9]。本研究探讨了98%呋虫胺原药对大鼠繁殖的毒性,以期为呋虫胺的安全性评价提供科学依据,预防其对人类的潜在影响。
1 材料与方法
1.1 供试药剂与动物
98%呋虫胺原药为白色至浅黄色粉末,由北京科发伟业农药技术中心提供。SPF级SD大鼠由上海西普尔-必凯实验动物有限公司[许可证号:SCXK(沪)2013—0016]提供,共4组,每组48只,雌雄比例2∶1。实验动物使用许可证号为SYXK(鄂)2012—0065。实验动物质量合格证号为2008001639726、2008001639727。
1.2 实验方法
前期实验表明,98%呋虫胺原药对雌雄大鼠LD50值均大于5 000 mg/kg;亚慢性毒性试验雌性LOAEL值为250 mg/kg,NOAEL值为50 mg/kg,雄性LOAEL值为1 666 mg/kg,NOAEL值为333 mg/kg。故本实验设1个阴性对照组和3个剂量组,各组饲料中的原药含量分别为0、100、500、2 500 mg/kg。根据大鼠实际摄食量与体重的比值计算染毒剂量,阴性对照、低、中、高剂量组的染毒剂量分别为0、8、40、200 mg/(kg·d),阴性对照组饲喂不含原药的标准饲料。亲代(F0)和子一代(F1)均染毒8周后,雌雄大鼠按2∶1进行非同窝交配。计算繁殖指数(交配成功率、受孕率、活产率、出生存活率、生存率、哺乳成活率)和体重等指标,每阶段实验结束时解剖该阶段实验动物,对子宫、卵巢、睾丸、附睾、前列腺、脑、肝、肾、脾和已知的靶器官进行称重,计算主要脏器系数并进行常规病理检查。F1代每组留取56只大鼠,雌雄各半。持续经口喂养给药,连续喂养8周后交配繁殖,测定F1代成年鼠和子二代(F2代)仔鼠的出生指标和生长指标。
1.3 饲养环境
饲育条件:实验在本单位SPF级屏障系统内进行。实验动物饲养于塑料饲育盒内,笼具、食盒每周更换1次并进行清洗消毒。
环境条件:温度23±3℃,湿度40%~70%,明暗交替12h,噪音在60dB以下,换气次数为10~18次/h。
1.4 数据处理
计量资料如体重、进食量、血液常规检验、血液生化检验、脏器重量等指标采用T检验;动物的临床症状观察、动物死亡率等计数资料的统计采用卡方检验;病理解剖所见、组织学所见、肿瘤性病变采用Fisher确切概率检验;数据采用SPSS17.0软件分析。
2 结果与分析
2.1 一般表现
繁殖期间,F0代和F1代大鼠进食、饮水和活动基本正常,未见明显异常表现。
2.2 F0代和F1代大鼠体重变化情况
F0代:与阴性对照组相比,雌性中剂量组14 d的体重偏高(P<0.05),雌性高剂量组7 d体重下降(P<0.05);雄性中剂量组7 d的体重偏高(P<0.05),其他各剂量组雌雄大鼠每周体重及总增重均无差异(P>0.05)。因此认为这一改变无剂量反应和时间效应关系。
F1代:与阴性对照组相比,雌性大鼠低剂量组初重、7 d的体重偏低(P<0.05,P<0.01),雌性大鼠高剂量组初重、7 d的体重偏低(P<0.05,P<0.01);雄性大鼠高剂量组初重、第5~8周体重降低(P<0.05,P<0.01)。综合分析,各差异主要是由初重分组造成,且各剂量组雌雄大鼠总增重与阴性对照组相对,差异均无统计学意义(P>0.05)。
2.3 F0代和F1代大鼠摄食量
F0代:与阴性对照组相比,雌性大鼠低剂量组第6~7周每日每只进食量减少(P<0.05),中剂量第2周每日每只进食量增加(P<0.05);雄性中剂量、高剂量组第1周每日每只进食量增加(P<0.05),雄性中剂量组第4~5周每日每只进食量减少(P<0.05);但各剂量组雌雄大鼠总摄食量没有差异(P>0.05)。
F1代:与阴性对照组相比,雌性大鼠低剂量及高剂量组第3周每日每只进食量减少(P<0.05;P<0.01),总摄食量没有差异(P>0.05);雄性低剂量组第2~4周每日每只进食量减少(P<0.05;P<0.01),总摄食量没有差异(P>0.05);雄性高剂量组第2~7周每日每只进食量减少(P<0.05;P<0.01),总摄食量减少(P<0.01)。差异有统计学意义,表明供试药剂对雄性高剂量组大鼠摄食有影响。
2.4 母鼠对仔鼠哺乳期体重的影响
2.4.1 F0代母鼠对F1代仔鼠哺乳期体重的影响
与阴性对照组相比,低剂量组与中剂量组仔鼠7 d的体重偏高(P<0.01,P<0.01),高剂量组仔鼠7 d、21 d的体重偏高(P<0.01 ,P<0.05),结果见表1。经比较分析,主要原因是对照组孕鼠生产的仔鼠总数偏高,造成对照组仔鼠的平均体重偏低。因此以上差异虽有统计学意义,但无毒理学意义。

表1 98%呋虫胺原药对F0代生F1代仔鼠哺乳期体重的影响
2.4.2 F1代母鼠对F2代仔鼠哺乳期体重的影响
与阴性对照组相比,低剂量组4 d的窝重及14 d、21 d仔鼠体重偏高(P<0.05),中剂量组7 d、14 d、21 d的体重偏高(P<0.05;P<0.01),高剂量组14 d的仔鼠体重偏高(P<0.01),具体结果见表2。

表2 98%呋虫胺原药对F1代生F2代仔鼠哺乳期体重的影响
2.5 繁殖指数
F0和F1代各组动物繁殖指数见表3。F0代中,与阴性对照组相比,各剂量组雌鼠交配成功率、受孕率、活产率、出生存活率、仔鼠哺乳存活率与对照组相比,差异均无统计学意义(P>0.05)。F1代中,与阴性对照组相比,高剂量组仔鼠出生存活率偏低,差异有统计学意义(P<0.05)。低、中剂量组雌鼠交配成功率、受孕率、活产率、出生存活率、仔鼠哺乳存活率等繁殖指数均无差异(P>0.05)。
2.6 对雄鼠精子活力的影响
F0代和F1代,高剂量组与阴性对照组相比,精子活力和精子百分比均没有差异(P>0.05)。
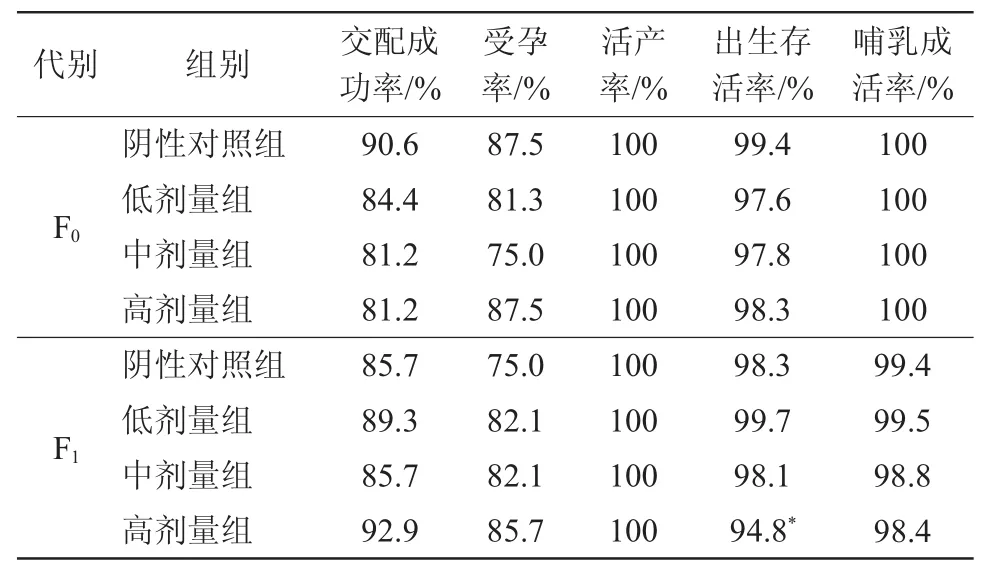
表3 F0代和F1代各组动物繁殖指数
2.7 脏器系数
F0代中,与阴性对照组相比,雌性大鼠低剂量组肾脏质量偏高(P<0.05);中剂量组脾脏质量偏高(P<0.01),肾脏质量及肾脏系数偏高(P<0.05,P<0.01),卵巢质量偏高(P<0.01);雌性大鼠高剂量组解剖质量偏高(P<0.01),脾脏质量偏高(P<0.05),肾脏质量偏高(P<0.01),卵巢质量偏高(P<0.01);雄性大鼠中剂量组肾脏系数偏高(P<0.01),具体结果见表4。
综合分析,与阴性对照组相比,雌性大鼠脏器质量及系数主要表现为脏体质量偏高,但脏器系数正常,此结果主要与解剖的雌性大鼠剖杀体重差异有关,也与解剖时实验员的熟练程度或放血程度有关;其余个别脏器系数出现显著性差异,但无明显剂量反应关系,且生殖系统组织病理学无实质性改变,无毒理学意义。

表4 F0代和F1代各组雌性与雄性大鼠脏器系数
与阴性对照组相比,F1代中雌性大鼠低剂量组肾脏质量偏高(P<0.05)、子宫质量及其脏器系数偏低(P<0.05);中剂量组肾脏质量偏高(P<0.05);雄性大鼠低剂量组解剖体重偏高(P<0.05)、肝脏质量及肝脏系数偏高(P<0.01;P<0.05)、睾丸脏器系数偏低(P<0.05)、附睾质量及其脏器系数偏低(P<0.05;P<0.01);雄性大鼠高剂量组肝脏脏器系数偏高(P<0.05)。
以上差异主要是由于剂量组动物禁食不够彻底,导致解剖体重有差异进而引起脏器系数的差异,部分数据差异较小且无明显剂量反应关系。
2.8 生殖系统组织病理学检查
F0代和F1代中,高剂量组和对照组(F0代)的少量雄性大鼠前列腺出现病理改变,主要表现为局部间质细胞增生,炎性细胞浸润,前列腺间质内炎性细胞浸润,其他大鼠各生殖系统均未见明显异常,应为动物自发性病理变化,表明该供试品未引起亲代生殖能力改变。
3 结论与讨论
本研究根据《农药登记毒理学试验方法》(GB 15670—1995)[10]进行98%呋虫胺原药对大鼠两代繁殖毒性的实验。结果表明:与阴性对照组相比,F0代低、中、高剂量组动物的交配成功率、受孕率、活产率、出生存活率、生存率、哺育存活率等繁殖指数均无差异(P>0.05)。F1代高剂量组雄鼠在第5~8周体重偏低,差异有统计学意义(P<0.01;P<0.05),但总增重与阴性对照组相比,差异均无统计学意义(P>0.05);高剂量组雌鼠第2~7周摄食量及总摄食量降低,差异有统计学意义(P<0.01;P<0.05);高剂量组仔鼠出生存活率偏低,差异有统计学意义(P<0.05);低、中剂量组雌鼠交配成功率、受孕率、活产率、出生存活率、仔鼠哺乳存活率等繁殖指数均无差异(P>0.05)。综合上述结果,认为在本实验条件下,高剂量组98%呋虫胺原药对SD大鼠具有繁殖毒性,表现为F1代成年雌性大鼠摄食量降低、F2代仔鼠出生存活率降低。98%呋虫胺原药对大鼠两代繁殖毒性最大无作用剂量为40 mg/(kg·d),最小有害作用剂量为200 mg/(kg·d)。因此在使用此农药过程中应充分做好防护工作,避免大剂量接触,尤其是孕妇及哺乳期妇女应尽量避免与该农药接触。

