外部性脑积水儿童脑部1H-MRS及DWI研究
钟晶晶 印洪刚 吴献华 张 勤
外部性脑积水(external hydrocephalus,EH)是脑积水的一种特殊亚型,通常认为是头围增长过快、蛛网膜下腔增宽造成。在影像学检查中其主要表现为额颞部、顶部脑外间隙的增宽,脑室系统正常或轻度扩张。这种表现多见于婴幼儿期,随着儿童的生长发育,扩大的蛛网膜下腔会逐渐缩小。因此,EH也被称为“良性外部性脑积水”,通常不需要临床干预[1]。而多篇关于EH儿童的随访报道提出了不同的观点:多数患儿在EH初期或长期可能表现正常,但也有患儿会表现出暂时或永久的精神运动发育延迟。目前对EH病理生理的研究相对少见[2]。磁共振波谱(magnetic resonance spectroscopy,MRS)及弥散加权成像(diffusion weighted imaging,DWI)可以对EH儿童脑内代谢产物变化及水分子微观运动情况进行观察,探讨脑组织微环境的改变。因此,本研究使用氢质子波谱(1H-MRS)及DWI序列对EH儿童脑内微观变化进行观察,并与正常儿童进行比较,旨在发现EH儿童大脑微环境的改变,为EH现存的争议提供证据。
方 法
1.一般资料
收集南通市妇幼保健院2016年6月-2017年9月EH儿童及正常发育儿童脑部2D1H-MRS及DWI资料,病例组与对照组各17例。由于婴幼儿期脑内代谢产物随月龄发生明显变化[3],所以两组资料按月龄匹配,月龄跨度1~24个月。由于婴幼儿期脑内代谢产物及表观扩散系数(apparent diffusion coefficient,ADC)不存在明显的性别差异[3-4],本研究未对资料进行性别分组。病例组入组条件,临床诊断头围过快增长,无明显颅内压增高表现,无明确异常出生史,常规MRI显示脑实质无明显异常;额颞部脑外间隙>5mm或前纵裂宽度>7mm(图1)。对照组入组条件:月龄与病例组相匹配的正常发育儿童,因其他疾病就诊(如发热、惊厥、轻度外伤等),临床无明显发育延迟表现,常规MRI无明显异常。
2.检查方法
采用2D-1HMRS及DWI序列对病例组及对照组多个脑区代谢产物信息及ADC值进行测量。设备采用西门子Avanto 1.5T MRI扫描仪,8通道头颅线圈。检查前20min患儿行10%水合氯醛口服或者灌肠镇静,用量0.5~1.0ml/kg,总量不超过10ml。待患儿熟睡之后再行扫描。所有入组者行2D1H-MRS及DWI检查。MRS参数:选用2D CSI序列(TR1500ms/TE135ms),层厚15mm,层数1,FOV16cm×16cm,矩阵8×8,激励次数4,成像时间432s;参考轴位T2WI图像将扫描中心位置约定于丘脑顶部层面,范围根据患儿头围大小进行微调并避开颅骨,包括两侧额叶、枕叶白质及基底节区;扫描前行自动预扫描,保证匀场效果达到全宽半高(full width at half maxi-mum,FWHM)<10%,水抑制(water suppression)≥98%。采用工作站内置软件对MRS数据进行处理,步骤如下:①选取T2WI轴位序列作为波谱信息的定位图像;②使用软件中的Spatial Fourier Transformation功能移动波谱光栅,使CSI体素位于预设的标准感兴趣区域,测量区域包括两侧额叶白质、两侧枕叶白质(测量区域尽量包括额叶枕叶均匀的白质区域)及两侧基底节区(测量中心位于内囊体部);③记录并比较代谢产物参数,包括NAA/Cr、NAA/Cho、Cho/Cr(图2)。DWI参数:使用ep2d-diff-3scan-trace-p2序列,在x、y、z轴方向施加扩散敏感梯度,b值取0和1000s/mm2,由系统生成ADC图。使用工作站内置软件进行ADC值测量,测量区域与MRS测量区域基本一致,采用圆形感兴趣区,面积0.82~1.2cm2,如图3所示。
3.统计学分析
采用SPSS 23.0软件对所得数据进行统计学处理,各脑区代谢产物计量资料采用(±s)表示,差异性比较采用配对样本t检验,P<0.05表示差异有统计学意义。
结 果
病例组右额叶白质Cho/Cr较对照组明显升高(P=0.031),右额叶白质NAA/Cr、NAA/Cho在两组之间差异无统计学意义。左侧额叶、两侧基底节区、两侧枕叶各代谢产物在两组之间差异无统计学意义(表1)。各脑区ADC值在两组间无明显差异(表2)。
讨 论
EH主要由影像科医生给出诊断,但该诊断是否存在临床意义一直是影像工作者面临的问题。对EH病例的随访结果显示,EH儿童可以出现运动、语言和精神发育的落后,这种异常可以是短暂的,也可以长期存在[2]。虽然多篇文献提示了EH的不良结局,但目前对EH的临床处理仍然以保守观察为主,这是由于目前对EH的病因及其病理过程还不明确。随着MRI技术的发展,越来越多的功能序列已经应用到神经系统疾病的诊断中。对EH的影像观察也不应该仅仅局限于对脑积水量的观察,更应该采用功能磁共振对其病理过程进行探究。

表1 对照组与病例组各部位代谢产物结果比较

表2 对照组与病例组各部位ADC值比较
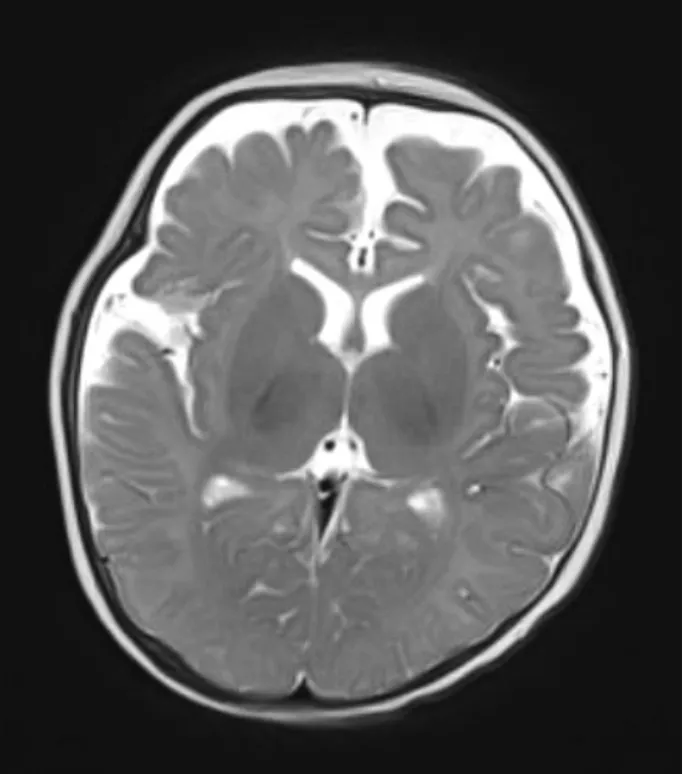
图1 EH儿童T2WI轴位图像,表现为额颞部脑外间隙增宽。
1.EH引起的代谢产物异常
本次研究结果显示EH儿童右侧额叶Cho/Cr明显升高。由于Cr的总量在同一个体中是相对稳定的,所以Cho/Cr的升高反映了Cho升高。MRS中Cho峰是由数个含胆碱的代谢产物组成,主要是磷脂酰胆碱和甘油磷酸胆碱,这些化合物是神经髓鞘化的底物。在正常脑发育过程中,特别是在生命的早期,可以观察到Cho的明显减低,因此Cho的变化可以反映神经髓鞘发育的过程。在正常脑发育过程中,Cho浓度应该逐渐减低,较高的Cho水平可以提示局部神经髓鞘化的落后[5]。

图2 MRS右侧额叶、基底节区、枕叶感兴趣区及代谢产物信息,左侧感兴趣区与右侧基本对称。

图3 两侧额叶白质、基底节区、枕叶白质ADC值测量感兴趣区。
2.EH的ADC值
Sun等采用磁共振弥散张量成像(diffusion tensor imaging,DTI)技术对EH儿童脑白质进行的研究结果显示EH儿童胼胝体及内囊出现部分各向异性指数(fractional anisotropy,FA)的异常升高及平均扩散率(mean diffusivity,MD)的异常减低,并认为这是由于积水压迫脑白质造成白质内细胞密度增加、水分子活动空间减小所致[6]。本次研究结果显示EH儿童脑部ADC值较正常儿童无明显差异。这可能是由于本研究采用的DWI技术对水分子运动的敏感性不及DTI技术所致,希望今后对EH可以进行进一步DTI研究。
3.髓鞘化异常对脑发育的影响
神经髓鞘化在脑发育过程中起着重要的作用,其对神经系统的形成和功能发育至关重要。完整的髓鞘可以对神经元轴突的传导速度和指向性产生重大影响,同样神经元的活性也依赖于神经髓鞘的形成。正常的髓鞘形成有助于控制和协调运动能力[7]。这似乎可以解释在发育迟缓的EH患者中,为什么运动发育迟缓占据了大多数。这一结论在早产儿髓鞘化延迟造成运动发育不良的研究中也得到了证实。部分研究结果还显示EH会造成心理测试的异常或神经认知的异常[2]。这似乎也可以用髓鞘化落后的原因来解释。因为,精神和心理异常同样与髓鞘化异常相关[7]。
4.EH影响脑发育的机制
本研究结果并不能直接反映EH如何影响脑发育,前人的研究提供了一些推断依据。有学者认为EH是儿童脑积水发展过程中的一个阶段,在脑积水初期蛛网膜绒毛不能吸收脑脊液,造成脑脊液堆积于蛛网膜下腔[8]。因此EH造成颅内压升高是必然的,虽然大部分EH儿童并没有颅内压增高的表现。EH儿童头围增大的症状会在2岁左右停止,但这可能都只是颅缝闭合的结果,其内在的脑脊液生产和吸收的不平衡可能持续存在,这会造成颅内压力在2岁后仍持续增加,这种表现可能是隐匿和长期的。两项随访至学龄阶段的研究[2],支持EH对大脑发育的长期影响。Hanlo等的研究显示颅内压可以影响髓鞘化的进程从而影响发育的结局[9]。大多数发育延迟的儿童在脑脊液分流手术后得到了恢复,也证实了颅内压的增高可能是EH影响发育的主要原因。动物实验证实脑积水会使得脑白质中的血流量减低,从而造成髓鞘化形成的障碍[10]。通过上述分析可以得出这样的结论。EH造成颅内压增高,虽然只是轻微、隐匿性的增高,但仍然阻碍髓鞘的正常形成,最终导致精神运动的发育迟缓。
本研究仅在额叶观察到Cho/Cr的升高,而其他部位各代谢产物及全脑ADC值都没有出现异常。这也反映了EH造成的颅内压增高是轻微的,因此仅仅累及与脑积水部位最为邻近的额叶白质,而没有对全脑造成影响。另外,由于大脑髓鞘化的过程存在一定的规律性,遵循着由后向前、由中央向外周的顺序,额叶是脑内髓鞘化形成相对较晚的部位,因此受到的影响也相对明显。
结 论
EH儿童存在着脑内代谢产物的异常,表现为右侧额叶胆碱的升高,反映了局部脑白质髓鞘化的落后。EH并不完全是一种自限性疾病,应该引起临床更多的关注和更多积极的处理。1H-MRS可以作为EH儿童的辅助检查,为临床提供更多的诊断信息。

